amino acid metabolism_mai2021.pdf
- 3. Outline 1. คุณสมบัติของกรดอะมิโนและโปรตีน 2. การจาแนกชนิดและการสกัดโปรตีน 3. Protein Turnover 4. Amino metabolism • carbon skeletal pathway • amino nitrogen pathway • biosynthesis of amino acids 5. การสังเคราะห์สารชีวโมเลกุลที่สาคัญจากกรดอะมิโน
- 4. https://mindfulmedstudent.net/2017/04/19/three-acronym-mnemonics-for-remembering-the-amino-acids/
- 5. สมบัติของกรดอะมิโน - Amino acids are compounds that have both an amine group and a carboxylic acid group, it can act as both a base and an acid. 1. สมบัติในการเป็นกรด-เบส และบัฟเฟอร์ – Zwitterion – Isoelectric point 2. สมบัติเชิงแสง 3. สมบัติทางเคมี
- 7. pKa1 = 2.34 pKa2 = 9.6 Net charge +1 Net charge 0 Net charge -1 Zwitterion pI = pKa1 + pKa2 2 Glycine 2.34 9.6 Isoelectric point Calculation
- 8. Glycine The buffer regions for glycine are pH 1.3 to pH 3.3 and from pH 8.6 to pH 10.6 A mixture of a weak acid and its conjugate base is a buffer. • In both regions, we can add small amounts of acid or base, and the pH will not change much.
- 9. Lysine pKa1 = 2.18 pKa2 = 8.95 Net charge +2 Net charge 0 Net charge -1 Zwitterion pI = pKa1 + pKa2 2 Net charge +1 pKa3 = 10.5 = 2.18 = 8.95 = 10.5 Isoelectric point Calculation R group
- 10. Protein structure + beta-turn เกิด 3D structure เฉพาะ พบ binding site (Cleft)
- 11. What is a Protein? (RCSBProteinDataBank)
- 15. • Unstructured proteins • Globular protein • fibrous protein –Collagen –Elastin –Keratin / tropomyosin –Plasma lipoprotein • Conjugated protein Classification of Proteins Based on Structure Based on composition
- 17. Protein separation and purification สิ่งที่ต้องคานึงเพื่อที่จะรักษาโครงรูปและสมบัติของโปรตีน 1. pH 2. Temperature 3. Degradative enzyme 4. Adsorption to surfaces 5. Long-term storage เทคนิคการแยกโปรตีนและทาให้โปรตีนบริสุทธิ์ 1. Salting in and salting out 2. Chromatography technique 3. Electrophoresis
- 18. Protein sequencing 1. Subunits separation 2. การย่อยกรดอะมิโนแต่ละตัวออก จากสายpeptide 3. Edman degradation 4. Mass spectroscopy
- 19. Proteomics • คือ การศึกษาโปรตีนทั้งเชิงคุณภาพ(ระบุชนิดของโปรตีน) และเชิงปริมาณ โดยศึกษา หน้าที่ และปริมาณของโปรตีนทั้งหมดที่อยู่ภายในเซลล์ซี่งเรียกว่า proteome นอกจากนี้การศึกษาทางด้าน proteomics ยังรวมไปถึงการศึกษาชนิดและปริมาณ โปรตีนในออร์แกเนลล์และระบบการทางานของโปรตีนที่ส่วนต่างๆ ของเซลล์ Protein database ในปัจจุบันมีฐานข้อมูลที่เกี่ยวของกับโปรตีนอยู่หลายฐานข้อมูล เช่น
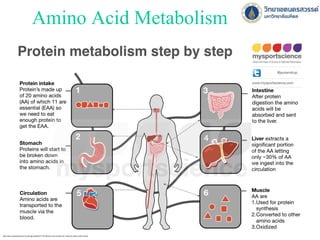
- 20. Source of amino acids 1. โปรตีนจากอาหาร 2. โปรตีนที่หลั่งออกมาในระบบทางเดินอาหาร 3. โปรตีนและกรดอะมิโนที่อยู่ในเซลล์(protein turnover) 4. กรดอะมิโนที่ได้จากการตายของจุลินทรีย์ในลาไส้ใหญ่ • นักโภชนาการแนะนาว่าควรบริโภคโปรตีนวันละ 50-100 กรัม • บริโภควันละ 20 กรัมก็ยังดารงชีวิตได้ปกติ ถ้าได้กรดแอมิโนจาเป็ นครบถ้วน • นักกีฬาอาจจะต้องได้รับ 1.4 – 1.7 g/kg/day เพื่อให้คงสภาพมวลกล้ามเนื้อ • โปรตีนจากพืช มักจะขาดกรดแอมิโน Lys, Met หรือ Trp • ถ้าบริโภคพืชหลากหลายชนิด ไม่มีปัญหา เพราะชดเชยกันได้
- 21. N balance = Nin - Nout Balance between the rate of protein synthesis and protein breakdown
- 22. 22 การหมุนเวียนของโปรตีน (Protein Turnover) Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt) Amino acids Absorbed 160g/day
- 24. m Mehenni, Assistant Professor of Biochemistry, Umm Al Qura University. Or 4-5 g per 1Kg body weight (gluconeogenesis)
- 26. การหมุนเวียนของโปรตีน (Protein Turnover) ทาไมต้องมีการหมุนเวียนโปรตีน ? -โปรตีนโดยธรรมชาติหรืออาจได้รับผลกระทบจากสิ่งแวดล้อมทาให้ โครงสร้างโครงรูปและกิจกรรมทางชีวภาพเปลี่ยนแปลงไป (denature) เช่น reactive oxygen -ควบคุมการทางานในกระบวนการหนึ่งๆ -การหมุนเวียนโปรตีน เป็นระบบควบคุมคุณภาพที่ไร้ประสิทธิภาพ เพราะย่อยทิ้งโปรตีนทั้งดีและไม่ดีแบบสุ่ม Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt)
- 27. การหมุนเวียนของโปรตีน (Protein Turnover) • โปรตีนมีการสังเคราะห์และการย่อยสลายอย่างต่อเนื่อง (hormone/Ab/enzyme/neurotransmitter/structure protein) • กรดแอมิโนที่ปล่อยออกมา จะถูกนากลับไปใช้สังเคราะห์โปรตีนใหม่ อัตราการหมุนเวียนโปรตีนไม่เท่ากัน • โปรตีนที่หลั่งออกสู่สิ่งแวดล้อมภายนอก เช่น เอนไซม์ย่อยอาหาร ฮอร์โมนโพลีเปป ไทด์ และแอนติบอดี หมุนเวียนเร็วมาก หรือ เอนไซม์ในตับมีการสลายและสร้าง ในช่วงนาทีถึงชั่วโมง • โปรตีนที่ทาหน้าที่เปนโครงสร้าง เช่น คอลลาเจนของเนื้อเยื่อเกี่ยวพัน จะมีความ เสถียรอยู่หลายเดือน • โปรตีนภายในเซลล์ ความเข้มข้นไม่ค่อยเปลี่ยนแปลงตามเวลา - ฮีโมโกลบิน มีอายุขัยเท่ากับเม็ดเลือดแดง (ราว 120 วัน) Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt)
- 29. กลไกการสลายโปรตีนในร่างกาย 1.Lysosomal autophagic system (by lysosome) 2. Ubiquitin proteosome system (UPS) เกี่ยวข้องกับ enzyme ที่ย่อยโปรตีนที่ชื่อ proteosome และ ubiquitin (peptide) * Protein turnover and disease * การสลายโปรตีนโดยระบบ Ubiquitin protease system จะทาให้เกิดโรค เช่น Alzheimer disease, Parkinson disease, motor neuron disease , tumor
- 30. กลไกการสลายโปรตีนในร่างกาย Ubiquitin proteosome system (UPS) เป็ น กระบวนการหนึ่งที่ใช ้ในการ สลายโปรตีนที่อยู่ภายใน เซลล์ โดยโปรตีนเป้ าหมายที่ ถูกสลายต้องเติมด้วย Ubiquitin จากนั้นจึงจะถูก สลายด้วยกลุ่มเอนไซม์ที่ เรียกว่า proteasome กระบวนการนี้มีความสาคัญ ในการสลายโปรตีนที่เสีย สภาพหรือเพื่อรักษาสมดุล ของปริมาณโปรตีนที่ เกี่ยวกับกระบวนการต่างๆ ของเซลล์เช่น การ เจริญเติบโตของเซลล์ การ ตายของเซลล์แบบ apoptosis เป็ นต้น สุปรานี กองคา , Thammasat Medical Journal, Vol. 13 No. 2, April-June 2013
- 32. OVERVIEW OF AMINO ACID METABOLISM ENVIRONMENT ORGANISM AMINO ACIDS Degradation (required) 1 2 3 a b Purines Pyrimidines Porphyrins c c Used for energy pyruvate α-ketoglutarate succinyl-CoA fumarate oxaloacetate acetoacetate acetyl CoA (glucogenic) (ketogenic) * Nitrogen Bio- synthesis Ingested protein Protein Urea Carbon skeletons
- 33. Amino metabolism กระบวนการเมแทบอลิซึมของกรดอะมิโน กระบวนการเมแทบอลิซึมของกรดอะมิโน แบ่งเป็น 2 ประเภท คือ 1 การสลายกรดอะมิโน (Catabolism of amino acids) 2 การสังเคราะห์กรดอะมิโน (Biosynthesis of amino acids) Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt)
- 34. การสลายกรดอะมิโน • โดยปกติแล้วกรดอะมิโนส่วนใหญ่มักถูกนาไปใช้ในการสังเคราะห์โปรตีนและสารชีว โมเลกุลที่จาเป็นต่อการดารงชีวิต รวมทั้งเป็นสารตั้งต้นที่ให้หมู่ α –อะมิโน แก่กรดอะ มิโนต่างๆ ที่สังเคราะห์ในร่างกาย • กรดอะมิโนที่เหลือจากการสังเคราะห์สารต่างๆ ดังกล่าวแล้วเท่านั้น ที่ถูกสลายด้วย กระบวนการสลายกรดอะมิโน ซึ่งต้องอาศัยวิถีการเปลี่ยนแปลงดังนี้ (1)วิถีโครงคาร์บอน (carbon skeletal pathway) โครงสร้างที่เหลือจากการกาจัด หมู่ α -อะมิโนของกรดอะมิโนถูกสลายต่อไปโดยเปลี่ยนให้เป็นสารตัวกลางในวัฏ จักรเครบส์หรือวิถีไกลโคลิซิส (2)วิถีไนโตรเจน (amino nitrogen pathway) เป็น การกาจัดหมู่อะมิโนในรูป แอมโมเนียและปฏิกิริยาการกาจัดแอมโมเนียรวมทั้งการกาจัดอะตอมกามะถัน หรือ อะตอมไนโตรเจนในแขนงข้างของกรดอะมิโน Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt)
- 36. 1. วิถีโครงคาร์บอนของกรดอะมิโน (Carbon skeletal breakdown ) • วิถีโครงคาร์บอนของกรดอะมิโนเป็นการสลายโครงคาร์บอนของกรดอะมิโน โดย การเปลี่ยนเป็นสารตัวกลางในวัฏจักรเครบส์ ไพรูเวตหรืออะซีทิล-โคเอ • กรดอะมิโนชนิดที่เปลี่ยนเป็นสารตัวกลางในวัฏจักรเครบส์หรือไพรูเวตได้ เรียกว่า glucogenic amino acid เพราะสามารถเปลี่ยนเป็นกลูโคสได้ • สาหรับกรดอะมิโนที่นาไปสังเคราะห์เป็นสารคีโทนได้ โดยการเปลี่ยนเป็นอะ ซิทิลโคเอ หรืออะซีโทอะซีทิลโคเอ เรียกว่า ketogenic amino acid • มีกรดอะมิโนบางชนิด เช่น ฟีนิลอะลานีนและ ไทโรซีนมีโครงคาร์บอนที่ สามารถเปลี่ยนเป็นฟูมาเรต และส่วนที่เหลือเปลี่ยนเป็นอะซีโทอะซีเทตได้จึงเป็น ทั้ง ketogenic และ glucogenic amino acid Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt)
- 37. Protein and amino acid metabolism, chayanon P. http://www.si.mahidol.ac.th/department/biochemistry/home/md/lecture/Protein%20and%20amino%20acid%20metabolismMed2009.pdf 1. วิถีโครงคาร์บอนของกรดอะมิโน (Carbon skeletal breakdown )
- 38. Protein and amino acid metabolism, chayanon P. http://www.si.mahidol.ac.th/department/biochemistry/home/md/lecture/Protein%20and%20amino%20acid%20metabolismMed2009.pdf
- 40. Amino acid metabolism : 2. amino nitrogen pathway • Metabolism of amino acids differs, but 3 common reactions: – Transamination/Deamination – Formation of urea
- 41. 2. Amino nitrogen pathway (วิถีไนโตรเจน) 1) ปฏิกิริยาย้ายหมู่อะมิโน (Transamination) • เป็นการย้ายหมู่ α -อะมิโนให้แก่กรดคีโทต่าง ๆ ได้ผลิตผลเป็น กรดคีโทและกรดอะมิ โนชนิดใหม่ที่สัมพันธ์กับกรดอะมิโนและกรดคีโทชนิดตั้งต้น โดยใช้เอนไซม์ทราสมิ เนส (transaminase) หรืออะมิโนทรานสเฟอเรส (aminotransferase) Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt) Asp/Ala/Leu Oxaloacetate /pyruvate
- 42. 2. Amino nitrogen pathway (วิถีไนโตรเจน) 1) ปฏิกิริยาย้ายหมู่อะมิโน (Transamination)
- 43. 2). ปฏิกิริยาขจัดหมู่อะมิโน (deamination) ปฏิกิริยาขจัดหมู่อะมิโน แบ่งออกได้เป็น 2 ชนิด คือ • – ปฏิกิริยาการขจัดหมู่อะมิโนชนิดออกซิเดชัน (oxidative deamination) • - ปฏิกิริยาการขจัดอะมิโนชนิดไม่มีออกซิเดชัน (non-oxidative deamination) Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt) 2. Amino nitrogen pathway (วิถีไนโตรเจน)
- 44. a. ปฏิกิริยาการขจัดหมู่อะมิโนชนิดออกซิเดชัน (oxidative deamination) เป็นปฏิกิริยาการขจัดหมู่อะมิโน โดยอาศัยการทางานของเอนไซม์หลายชนิดที่สาคัญ ได้แก่ (1) glutamate dehydrogenase กรดกลูทามิกเป็นสารตัวกลางที่สาคัญในกระบวนการเมแทบอลิซึมของกรดอะมิโน โดยหมู่ α - อะมิโนของกรดกลูทามิกถูกดึงออกในรูปแอมโมเนียใช้เอนไซม์กลูทาเมตดีไฮโดรจีเนตเร่ง ปฏิกิริยาในตับ ถ้าปฏิกิริยาเกิดที่ไซโตพลาซึมของตับใช้ NAD+ เป็นโคเอนไซม์ แต่ถ้าเกิดใน ไมโตคอนเดรียใช้ NADP+ เป็นโคเอนไซม์ ดังปฏิกิริยา Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt) Amino nitrogen pathway (วิถีไนโตรเจน)
- 45. a. ปฏิกิริยาการขจัดหมู่อะมิโนชนิดออกซิเดชัน (oxidative deamination) เป็นปฏิกิริยาการขจัดหมู่อะมิโน โดยอาศัยการทางานของเอนไซม์หลายชนิดที่สาคัญ ได้แก่ (2) amino acid oxidase • เป็นเอนไซม์ที่ทาหน้าที่เร่งปฏิกิริยาการขจัดหมู่ α –อะมิโนของกรดอะมิโน และมี FAD+ เป็น โคเอนไซม์ โดยเอนไซม์นี้ทาหน้าที่ออกซิไดส์หมู่ α –อะมิโนของกรดอะมิโน ได้เป็น α -อะมิ โน (α-amino) ที่ไม่เสถียรสลายต่อได้เป็นกรดคีโท สาหรับหมู่อะมิโนหลุดออกในรูปแอมโมเนียนั่น คือ ผลผลิตของปฏิกิริยาได้แก่ กรดคีโท และแอมโมเนีย Amino nitrogen pathway (วิถีไนโตรเจน)
- 46. b. ปฏิกิริยาการขจัดอะมิโนชนิดไม่มีออกซิเดชัน (non-oxidative deamination) • Oxidative deamination is the most active mechanism by which animal cells remove nitrogen from their amino acids • เป็นปฏิกิริยาขจัดหมู่อะมิโนโดยตรงใช้เอนไซม์จาเพาะและไม่สามารถผ่านกระบวนการ ออกซิเดชัน ดังนี้ (1) amino lyases เป็นเอนไซม์ที่สลายหมู่อะมิโนจาก กรดอะมิโนบางชนิด คือ แอสพาร์ติก อิสทิดีน ฟีนิลอะลานีน และไทโรซีน Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt) Amino nitrogen pathway (วิถีไนโตรเจน) •J. Reilly, Kyle A Troester, +2 authors Tiffiany R Risher •Published 2010 •Medicine, Chemistry •Photochemistry and Photobiology Ammonia lyases catalyze the reversible addition of ammonia to cinnamic acid and derivatives. From: Comprehensive Chirality, 2012
- 47. (2) Specific deaminase เอนไซม์กลุ่มนี้ทาหน้าที่ดึงหมู่อะมิโนออกมาในรูป แอมโมเนีย มี ไพริดอกซอลฟอสเฟตเป็นโคเอนไซม์ ตัวอย่างเอนไซม์ เช่น เซรีนไฮดรา เทส ทรีโอนีนไฮดราเทส และ ซีสเทอีนดีซัลไฮเดรส Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt) b. ปฏิกิริยาการขจัดอะมิโนชนิดไม่มีออกซิเดชัน (non-oxidative deamination) Amino nitrogen pathway (วิถีไนโตรเจน) (3) Deaminase เป็นกลุ่มเอนไซม์ที่สลายแอมโมเนียจากหมู่เอไมด์ของกลูทามีนและ แอสพาราจีน
- 49. การเปลี่ยนรูปแอมโมเนีย (Ammonia assimilation) •แอมโมเนียที่เกิดขึ้นจากการขจัดหมู่อะมิโนของกรดอะมิโนเป็นพิษ ต่อสมองโดยเฉพาะในเด็กแรกเกิด •ถ้าการขจัดแอมโมเนียไม่ทัน สมองอาจพิการได้ฉะนั้นแอมโมเนียที่ เกิดขึ้นจึงถูกขจัดโดยทันที ด้วยกระบวนการที่จะกล่าวต่อไปนี้ –การขนถ่ายแอมโมเนีย (Ammonia transportation) ไปยังตับ •จากกล้ามเนื้อ (Transport of ammonia as alanine) •จากเนื้อเยื่อต่างๆ (Transport of ammonia as glutamine) Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt)
- 50. • แอมโมเนียที่เกิดขึ้นที่กล้ามเนื้อในร่างกายถูกเปลี่ยนให้เป็นสารที่ไม่มีพิษและไม่มี ประจุก่อนส่งเข้าสู่กระแสโลหิตเพื่อส่งไปยังตับ โดยที่แอมโมเนียจะรวมกับ α –คี โทกลูทาเรต ได้เป็นกลูทาเมต มีเอนไซม์กลูทาเมตดีไฮโดรจีเนสเร่งปฏิกิริยา • กลูทาเมตที่ได้ไม่สามารถผ่านเยื่อหุ้มเซลล์ได้ ฉะนั้นกลูทาเมตต้องถูกเปลี่ยนเป็นอะ ลานีนก่อนส่งไปยังตับ และถูกเปลี่ยนกลับไปเป็นกลูทาเมตอีกที่ตับ โดยทา ปฏิกิริยากับ α - คีโทกลูทาเรต โดยใช้เอนไซม์อะลานีนทรานสมิเนสเร่งปฏิกิริยา การขนถ่ายแอมโมเนีย (Ammonia transportation) จากกล้ามเนื้อไปยังตับ Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt) NH4 + + α ketoglutarate + NADPH+H+ → Glutamate + NADP+ + H2O Glutamate + Pyruvate → + α ketoglutarate + alanine
- 52. • สาหรับในเนื้อเยื่อต่างๆ แอมโมเนียสามารถรวมกับ α –คีโทกลูทาเรต เช่นเดียวกับใน กล้ามเนื้อ • แต่กลูทาเมตที่เกิดขึ้นในเนื้อเยื่อต้องรวมกับแอมโมเนียอีก 1 โมเลกุล ได้เป็นกลูทามีน ก่อน • จะส่งไปยังตับที่ตับกลูทามีนถูกเปลี่ยนกลับไปเป็นกลูทาเมตและแอมโมเนียตามเดิมมี เอนไซม์กลูทามีเนส (glutaminase) เร่งปฏิกิริยา glutaminase Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt) การขนถ่ายแอมโมเนีย (Ammonia transportation) จากเนื้อเยื่อทั่วไปไปยังตับ NH4 + + α ketoglutarate + NADPH+H+ → Glutamate + NADP+ + H2O ATP + NH4 + + Glutamate → ADP + Pi + Glutamine + H+ Glutamine + H2O Glutamate + NH4 +
- 53. ฌสีแน Amino acids αKG αKG Urea Glutamate Glutamate NH+ 4 NH+ 4 NH+ 4 ATP Glutamine synthetase Glutamate dehydrogenase Glutaminase H2O Glutamine Glutamine Glu Glu Liver muscle เนื้อเยื่ออื่นๆ H2O ADP+Pi แสดงการขนถ่ายแอมโมเนียผ่านกระแสเลือดไปยังตับ Glucose alanine cycle Pyruvate alanine Pyruvate alanine Glucose Glucose Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt) การขนถ่ายแอมโมเนีย (Ammonia transportation)
- 54. Urea cycle From: Stryer, LS (1988) Biochemistry (3rd Ed). New York: WH Freeman & Co. p500 * • วัฎจักรนี้เกิดที่ไมโตคอนเดรียของ เซลล์ตับ ซึ่งจะเปลี่ยนแอมโมเนียไป เป็นยูเรียและขับออกนอกร่างกาย
- 55. วัฏจักรยูเรีย (Urea cycle) Aspartate NH3 Urea วัฎจักรนี้เกิดที่ไมโตคอนเดรีย ของเซลล์ตับ ซึ่งจะเปลี่ยน แอมโมเนียไปเป็นยูเรียและ ขับออกนอกร่างกาย
- 57. ปัจจัยที่มีผลต่อการสังเคราะห์ยูเรีย ปัจจัยที่มีผลต่ออัตราเร็วการสังเคราะห์ยูเรีย คือ 1. ปริมาณโปรตีน อัตราเร็วในการสังเคราะห์ยูเรียเปลี่ยนแปลงตามปริมาณโปรตีน ที่ได้ จากอาหารรวมทั้งที่ได้จากการสลายโปรตีนของกล้ามเนื้อ ถ้ามีปริมาณโปรตีน มากก็มีการสังเคราะห์ยูเรียมากด้วยเช่นกัน 2. ปริมาณเอนไซม์ในวัฏจักรยูเรีย จากการขาดเอนไซม์เนื่องจากโรคกรรมพันธุ์ ตับเสื่อม สมรรถภาพหรือสาเหตุใดสาเหตุหนึ่ง เช่น เป็นโรคตับแข็งเนื่องจากดื่ม สุราเรื้อรังมีผลให้การสังเคราะห์ยูเรียไม่ได้หรือได้แต่น้อยลง รวมทั้งทาให้เกิดภาวะ แอมโมเนียในเลือดสูง (Hyperammomia) 3. ปริมาณสารตัวกลางในวัฏจักรยูเรีย ในผู้ป่วยโรคกรรมพันธุ์ที่มีความผิดปกติ เกี่ยวกับการ ขนส่งกรดอะมิโนที่มีฤทธิ์เป็นเบส (อาร์จินีน ออร์นิทีน ไลซีน) เข้าสู่ เซลล์ที่มีผลให้อัตราการสังเคราะห์ ยูเรียน้อยลงและทาให้เกิดภาวะแอมโมเนียใน เลือดสูง Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt)
- 59. การสังเคราะห์กรดอะมิโน (Biosynthesis of amino acids) •กรดอะมิโน แบ่งเป็น 2 กลุ่ม คือ กรดอะมิโนจาเป็นและไม่จาเป็น •การสังเคราะห์กรดอะมิโนไม่จาเป็นแต่ละชนิด มีวิถีและเอนไซม์ที่ใช้ แตกต่างกันและเป็นคนละวิถีกับการสลาย •ร่างกายสามารถสังเคราะห์กรดอะมิโนได้จากกลูโคสโดยผ่านวิถีไกล โคไลซิสและวัฏจักรเครบส์ 9 ชนิด •สาหรับไทโรซีนกรดอะมิโนจาเป็นชนิดที่ 10 สังเคราะห์ได้จากฟี นิลอะลานีน Biochemistry II - ชีวเคมี กาแพงแสน Biochemistry KU KPS (biochem.flas.kps.ku.ac.th/01402313/01402313_157_Amino-met_20141029.ppt)
- 60. Protein and amino acid metabolism, chayanon P. http://www.si.mahidol.ac.th/department/biochemistry/home/md/lecture/Protein%20and%20amino%20acid%20metabolismMed2009.pdf * * ถึงแม้ร่ากายจะสามารถ สังเคราะห์ arginine ได้เอง แต่ ส่วนใหญ่จะถูกสลายไปอย่าง รวดเร็วในวิถีการสังเคราะห์ยูเรีย
- 61. https://www.pinterest.com/pin/572520171376443558/ Conditionally essential amino acids – กรดอะมิโนจาเป็นและไม่ จาเป็นนั้น ในบางครั้งก็ไม่มีกฎตายตัวซึ่งยังขึ้นกับสภาวะของร่างกาย ด้วย จึงได้มีกรดอะมิโนที่จาเป็นต่อสภาวะของร่างกาย เช่น การ เจ็บป่วยหลังผ่าตัด การเจริญเติบโต หรือเกิดสภาวะขาดกรดอะมิโน ชนิดอื่น
- 62. Conditionally essential AA Conditionally essential (i) ARG:can be made, but not enough (ii) HIS: controversial (essential for growth in children) (iii) PHE essential, TYR can be made from PHE but when enzyme is missing (phenyl- ketonuria) then PHE ≠> TYR; Therefore TYR is essential (iv) MET & CYS; Similarly, if MET ≠> CYS then CYS essential Even with excess, important in excretion NH4 + therefore continue to be made *
- 63. Figure 1. Pathways involved in the synthesis of non-essential amino acids glycine, alanine, serine cysteine, aspartic acid, asparagine, glutamic acid, glutamine, proline and ornithine
- 66. การสังเคราะห์สารชีวโมเลกุลที่สาคัญจากกรดอะมิโน : •กรดอะมิโนเป็นโครงสร้างหลักของโปรตีนและเป็นสารตั้งต้นของ สารไนโตรเจนที่มีบทบาท สาคัญต่อการดารงชีพของสิ่งมีชีวิต เช่น –amine –histamine –phosphocreatine –การสังเคราะห์ γ-อะมิโนบิวทาเรต (GABA) –serotonin –glutathione
- 67. การสังเคราะห์สารชีวโมเลกุลที่สาคัญจากกรดอะมิโน : การสังเคราะห์เอมีน • โดยอาศัยเอนไซม์ amino acid decarboxylase และมี pyridoxal phosphate (actived B6) เป็นโคเอนไซม์ กรดอะมิโนสลายหมู่คาร์บอกซิ ลออกไปได้เป็นสารเอมีน และ CO2 • สารเอมีนที่เกิดขึ้นเป็นฮอร์โมนที่ทาหน้าที่เกี่ยวกับ neurotransmission เช่น ฮอร์โมน serotonin จากกรดอะมิโนทริปโทเฟน สาหรับ epinephrine เกิด จากไทโรซีน
- 68. การสังเคราะห์สารชีวโมเลกุลที่สาคัญจากกรดอะมิโน : การสังเคราะห์ Serotonin • Serotonin เป็นสารชีวโมเลกุลที่มีฤทธิ์กระตุ้นการหดตัวของเส้นเลือดใน สัตว์ที่มีกระดูกสันหลัง ถูกสังเคราะห์ขึ้นจากกรดอะมิโน ทริปโทเฟน • Serotonin เป็นสารสื่อประสาทตัวหนึ่งที่ทาหน้าที่ส่งสัญญาณระหว่างเซลล์ ประสาทภายในสมอง Serotonin มีบทบาทสาคัญในการควบคุมอารมณ์ และการที่มี norepinephrine, serotonin ในสมองต่าก็มีความเกี่ยวข้องกับ การเกิดโรคซึมเศร้า https://bebrainfit.com/tryptophan-serotonin-mental-health/
- 69. อาหารและอาหารเสริมที่มี Serotonin • tryptophan เป็นส่วนประกอบสาคัญของการ สร้าง serotonin บางงานวิจัยเสนอว่าการ รับประทานอาหารที่มี tryptophan มาก อาจจะช่วยเพิ่มระดับของ serotonin ในสมอง และช่วยรักษาอาการของโรคซึมเศร้า • อาหารที่อุดมไปด้วย tryptophan เช่น ถั่ว, อาหารจากถั่วเหลือง ไข่ เนื้อสัตว์ สัตว์ปีก หน่อไม้ฝรั่ง ชอกโกแลตเป็นต้น • Research has also shown that when you follow a low-tryptophan diet, brain serotonin levels drop. However, research is ongoing to determine how much tryptophan-containing foods can affect serotonin levels in the brain. https://www.honestdocs.co/what-is-seratonin https://www.healthline.com/health/healthy-sleep/foods-that-could-boost-your-serotonin#eggs
- 71. การสังเคราะห์สารชีวโมเลกุลที่สาคัญจากกรดอะมิโน : การสังเคราะห์ Histamine • ปฏิกิริยาการขจัดหมู่คาร์บอกซิลของ histidine ได้เป็นสาร Histamine • Histamines start the process that hustles those allergens out of your body or off your skin. They can make you sneeze, tear up, or itch -- whatever it takes to get the job done. They are part of your body's defense system ฮิสตามี และยาต้านฮิสตามี บทที่ 12, CM 473, http://e-book.ram.edu/e-book/c/CM473(48)/CM473-12.pdf https://www.webmd.com/allergies/what-are-histamines#1 http://www.diagnosisdiet.com/histamine-intolerance-science/
- 72. การสังเคราะห์สารชีวโมเลกุลที่สาคัญจากกรดอะมิโน : การสังเคราะห์ γ-อะมิโนบิวทาเรต (GABA) • ปฏิกิริยาการขจัดหมู่คาร์บอกซิลของกลูตาเมตได้เป็นสาร γ- aminobutyrate (GABA) ทาหน้าที่เป็นสารสื่อในระบบประสาทส่วนกลาง γ-aminobutyrate จันทรพร ทองเอกแก ว , A Greatly Useful of GABA for Health, KKU Science Journal Volume 43 Number 2
- 73. • GABA is a neurotransmitter that acts to reduce communication between nerve cells in the brain, producing a calming effect (Promotes Sleep). • GABA powder might make it easier to fall asleep by lowering the activity of neurons in the brain. GABA powder might also increase the amount of human growth hormone in the body, which might improve sleep cycles and decrease disruptions in sleep. • Improves Chronic Pain: GABA inhibits the transmission of pain impulses throughout the body, as reported in January 2008. What is γ-aminobutyrate (GABA)
- 74. การสังเคราะห์สารชีวโมเลกุลที่สาคัญจากกรดอะมิโน : การสังเคราะห์ creatine และ phosphocreatine • ครีอาทีนถูกสังเคราะห์จากกรดอะมิโนอาร์จินีน ไกลซีน และเมไทโอนีน โดยมี S- อะดีโนซิลเมไทโนนีนเป็นตัวให้หมู่เมทิล Creatine is produced in the kidneys then transported to the muscle for uptake.
- 75. • Creatine is a compound formed from several amino acids that is found naturally in our body. • About 95% of the body's creatine is stored in muscles, in the form of phosphocreatine. The other 5% are stored in the brain, kidneys and liver (9). • Phosphocreatine is a form of stored energy in the cells, as it helps your body produce more of a high-energy molecule called ATP. • It helps your muscles produce energy during heavy lifting or high-intensity exercise. https://fitwhey.com/product/creatine1/ What is creatine? Rudy Mawer, MSc, sports nutritionist from the International Society of Sports Nutrition (ISSN), https://www.healthline.com/nutrition/what-is-creatine#section1
- 76. • Glutathione (กลูตาไทโอน) เป็นสารต้านอนุมูลอิสระที่เซลล์ในร่างกายมนุษย์ สามารถสังเคราะห์ได้เอง เป็นสารประเภท Tripeptide ที่ประกอบด้วย AA 3 ชนิดได้แก่ Cysteine, Glycine และ Glutamic acid และต้องการพลังงาน ATP เพื่อการสังเคราะห์ Protein and amino acid metabolism, chayanon P. http://www.si.mahidol.ac.th/department/biochemistry/home/md/lecture/Protein%20and%20amino%20acid%20metabolismMed2009.pdf การสังเคราะห์สารชีวโมเลกุลที่สาคัญจากกรดอะมิโน : การสังเคราะห์ Glutathione
- 77. Glutathione level •Glutathione levels in the body may be reduced by a number of factors, including poor nutrition, environmental toxins, and stress. Its levels also decline with age.’ •It’s also available as an oral supplement in capsule and liquid form. •However, oral ingestion of glutathione may not be as effective as intravenous delivery for some conditions. • Side effects and risks –A diet rich in glutathione-boosting foods does not pose any risks. However, taking supplements may not be advisable for everyone. Talk to your doctor about glutathione to determine if it’s right for you. Possible side effects may include: –abdominal cramps –bloating –trouble breathing due to bronchial constriction –allergic reactions, such as rash https://www.healthline.com/health/glutathione-benefits
- 78. 1. Detoxification : กลูตาไทโอนช่วยสร้างเอ็นไซม์ชนิดต่าง ๆ ในร่างกายโดยเฉพาะ Glutathion-S-transferase ที่ช่วยในการกาจัดพิษออกจากร่างกาย เช่น พวกโลหะหนัก สารระเหย ยาฆ่าแมลง แม้แต่ยาบางชนิด โดยเปลี่ยนให้เป็นสารที่ละลายน้าได้ดีขึ้นและง่าย ต่อการกาจัดออกจากร่างกาย นอกจากนี้ยังช่วยป้องกันตับ จากการถูกทาลายโดย แอลกอฮอล์ สารพิษจากบุหรี่ ยาพาราเซตามอลเกินขนาด (Overdose) 2. Antioxidant : กลูตาไทโอนมีคุณสมบัติเป็นสารต้านปฏิกิริยาออกซิเดชั่น (Antioxidant) ที่มีความสาคัญตัวหนึ่งในร่างกายและหากขาดไป วิตามินซีและอีอาจจะทางานได้ไม่เต็มที่ 3. Immune Enhancer : ช่วยกระตุ้นภูมิคุ้มกันในร่างกาย โดยกระตุ้นการทางานของ เอ็นไซม์หลายชนิดเพื่อให้ร่างกายต่อต้านสิ่งแปลกปลอมรวมถึงเชื้อแบคทีเรียและไวรัส นอกจากนี้กลูตาไทโอน ยังช่วยสังเคราะห์และซ่อมแซมสารพันธุกรรม(DNA) สร้างโปรตีน ให้ดาเนินไปอย่างเป็นปกติ http://www.biochemj.org/content/405/3/583 http://kbs.fda.moph.go.th/kbs2/upload_file/reading/20121023-013636-20121023013636.pdf หน้าที่หลักของกลูทาไทโอน ที่เด่นมีอยู่ 3 ประการคือ
- 79. • การใช้ยาฉีดกลูตาไธโอนเข้าหลอดเลือดดานั้น สามารถทาให้ผิวขาวขึ้นซึ่งเป็นผลข้างเคียงของยา ที่เกิดขึ้นชั่วคราวเท่านั้น หากต้องการให้ผลคงอยู่ไปตลอดจาเป็นต้องได้รับการฉีดซ้าเป็นระยะ ทาให้มีการสะสมยาในร่างกายมากขึ้น และอาจก่อให้เกิดอันตรายในระยะยาวได้ • กลูตาไธโอนในรูปแบบของยาฉีด ในประเทศไทยยังไม่ได้การรับรองจากคณะกรรมการอาหาร และยา การฉีดต้องอาศัยบุคลากรทางการแพทย์และมีวิธีการที่ถูกต้องตามหลักวิชาชีพ และอาจ ก่อให้เกิดอาการแพ้ยาเฉียบพลันรุนแรง ส่งผลให้ความดันโลหิตต่าลงจนเกิดภาวะ ช็อก (Anaphylaxis) และเสียชีวิตได้ • นอกจากนั้น การฉีดกลูตาไธโอนเป็นการทาให้เกิดการต้านการสร้างเม็ดให้สีในผิวหนัง (ซึ่งเม็ดสี เป็นตัวปกป้องผิวหนังจากพิษของแสงแดด) ที่เป็นปัจจัยเสี่ยงต่อการเกิดโรคมะเร็งผิวหนัง ดังนั้น ผู้ใช้สารกลูตาไธโอน จึงต้องตระหนักถึงผลลัพธ์เหล่านี้ด้วย • ปัจจุบัน การศึกษาในเรื่องของการนากลูตาไธโอนมาใช้ ประโยชน์และผลข้างเคียงหรือพิษ ใน ระยะยาวของกลูตาไธโอน ยังไม่ทราบชัดเจน แต่แพทย์ทุกคนมีความเห็นตรงกันว่า ไม่ควรใช้ก ลูตาไธโอน ในหญิงตั้งครรภ์และในหญิงให้นมบุตร เพราะอาจก่อผลไม่พึงประสงค์ต่อทารกได้ อันตรายจากการฉีด glutathione เข้าเส้นเลือดดา http://www.pharmacy.mahidol.ac.th/th/knowledge/article/6/%E0%B8%81%E0%B8%A5%E0%B8%B9%E0%B8%95%E0%B9%89%E0%B8%B2%E0%B9%84%E0%B8%98%E0%B9%82%E0%B8%AD%E0%B8%99-glutathione- %E0%B8%97%E0%B8%B3%E0%B9%83%E0%B8%AB%E0%B9%89%E0%B8%82%E0%B8%B2%E0%B8%A7%E0%B8%88%E0%B8%A3%E0%B8%B4%E0%B8%87%E0%B8%AB%E0%B8%A3%E0%B8%B7%E0%B8%AD/
- 80. END
