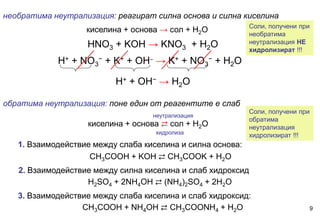
Разгледани са случаите, в които йонообменните реакции са обратими и практически необратими. Представен е начинът за изразяване на йонообменни реакции. Акцентира се на два важни йонообменни процеса във воден разтвор - неутрализация на киселина с основа и хидролиза на соли. Обяснена е връзката между силата на електролитите, от които е получена солта и химичния характер на водния й разтвор.









![А) Хидролиза на сол на слаба киселина и силна основа
(хидролиза по аниона на солта, защото той дава слабия електролит)
CN− + H2O ⇄ OH− + HCN
Na+ + CN− + H2O ⇄ Na+ + OH− + HCN
с(ОН-) > c(H+);
pH > 7;
основен химичен характер
O]
[H
.
]
[CN
[HCN]
.
]
[OH
2
C
K
]
[CN
[HCN]
.
]
[OH
h
K
Хидролизна константа
]
[H
]
[H
D
w
h
K
K
K
Примери: K2CO3, NaF, Na3PO4, Na2SO3
H+ + OH−
!!! Kh = f(KD)
3. Хидролиза на различни типове соли
KD – дисоциационната кон-
станта на слабата киселина
Как да потиснем хидролизата на такъв тип сол???
Чрез внасяне на ОН– , съгласно принципа на Льо Шателие. 11](https://image.slidesharecdn.com/v-240528131102-fc9f8c1d/85/V-6-11-320.jpg)
![Б) Хидролиза на сол на силна киселина и слаба основа - слаб или
практически неразтворим хидроксид
(хидролиза по катиона на солта)
Cu2+ + H2O ⇄ Cu(OH)2 + 2H+
]
[Cu
]
[H
.
]
[Cu(OH) 2
2
2
h
K
Хидролизна константа
2
2
]
[OH
]
[OH
D
w
h
K
K
K
Cu2+ + SO4
2− + 2H2O ⇄ 2H+ + SO4
2− + Cu(OH)2
Примери: Cu(NO3)2, ZnSO4, NH4Cl, AlCl3
2H+ + 2OH−
!!! Kh = f(KD)
с(ОН-) < c(H+);
pH < 7;
киселинен химичен характер
KD – дисоциационна константа
на слабия хидроксид
!! Не се пише знак за
утайка, защото е в нищожно
количество и в колоидна
форма; не се отделя като
утайка, но при престояване
агрегира.
12
Как да потиснем хидролизата на такъв тип сол???
Чрез внасяне на H+ , съгласно принципа на Льо Шателие.](https://image.slidesharecdn.com/v-240528131102-fc9f8c1d/85/V-6-12-320.jpg)
![В) Хидролиза на сол на слаба киселина и слаба основа – слаб или
практически неразтворим хидроксид (хидролиза по катиона и аниона)
NH4
+ + CN− + H2O ⇄ NH4OH + HCN
]
].[CN
[NH
[HCN]
.
OH]
[NH
4
4
h
K
Хидролизна константа
]
[OH
]
[H
]
[OH
]
[H
-
-
.
.
2
1. D
D
w
h
K
K
K
K
Примери: CH3COONH4, (NH4)2CO3
NH4
+ +OH− H+ +CN−
KD(1) KD(2)
KD(1)=2.10–5 KD(2)=5.10–10
При KD(1) > KD(2) pH > 7
При KD(1) < KD(2) pH < 7
При KD(1) ≈ KD(2) pH ≈ 7
Киселинността зависи от съотношението между дисоциационните
константи на киселината и хидроксида.
pH > 7
5 < pH < 9
!!! Kh = f(KD(1), KD(2))
Как да потиснем хидролизата на такъв тип сол???
13](https://image.slidesharecdn.com/v-240528131102-fc9f8c1d/85/V-6-13-320.jpg)




