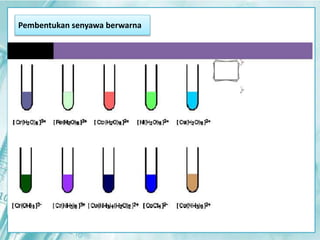
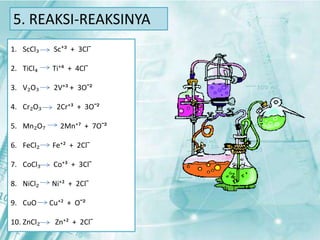
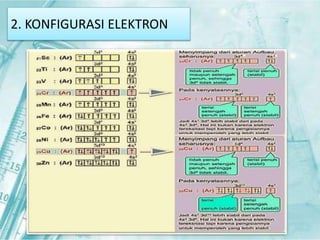
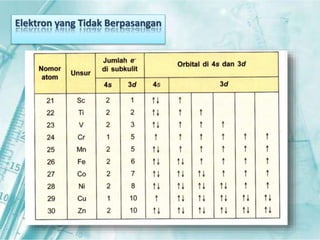
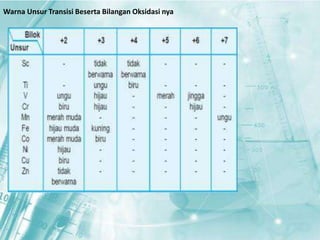
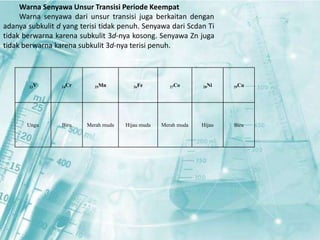
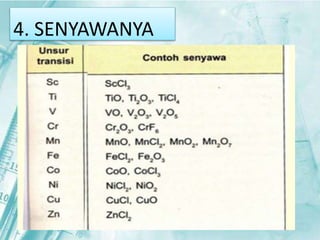
Dokumen ini membahas tentang unsur-unsur transisi pada sistem periodik, terutama yang terdapat pada periode 4, seperti scandium, titanium, vanadium, krom, mangan, besi, kobalt, nikel, tembaga, dan seng. Setiap unsur dijelaskan mengenai sifat fisik, sifat kimia, serta aplikasinya dalam kehidupan sehari-hari. Unsur transisi memiliki karakteristik khusus yang membedakannya dari unsur golongan utama, termasuk kemampuan membentuk berbagai senyawa warna dan bilangan oksidasi yang bervariasi.






![10. Seng
Sifat fisik dan kimia Seng merupakan logam yang berwarna putih kebiruan, berkilau,
dan bersifat diamagnetik. Walau demikian, kebanyakan seng mutu komersial tidak
berkilau. Seng sedikit kurang padat daripada besi dan berstruktur kristal Logam ini
keras dan rapuh pada kebanyakan suhu, namun menjadi dapat ditempa antara 100
sampai dengan 150 °C. Di atas 210 °C, logam ini kembali menjadi rapuh dan dapat
dihancurkan menjadi bubuk dengan memukul-mukulnya. Seng juga mampu
menghantarkan listrik. Dibandingkan dengan logam-logam lainnya, seng memiliki titik
lebur (420 °C) dan tidik didih (900 °C) yang relatif rendah.[4] Dan sebenarnya pun,
titik lebur seng merupakan yang terendah di antara semua logam-logam transisi
selain raksa dan kadmium.](https://image.slidesharecdn.com/kelompok2-141127093354-conversion-gate02/85/Unsur-transisi-periode-ke-empat-11-320.jpg)



![Senyawa Kompleks
Senyawa-senyawa seperti air H2O, asam hidroklorida HCl, natrium hidroksida NaOH,garam natrium
klorida NaCl, asam sulfat H2SO4, natrium sulfat Na2SO4 dan perak klorida AgCl menunjukkan ikatan
antara dua atom atau lebih berdasarkan valensi atom-atomnyayang sudah tepat atau jenuh, yaitu
masing-masing H = +1, O = -2, Na = +1, Cl = -1, S = +6,dan Ag =+1.
Demikian juga bagi senyawa-senyawa CoCl2, NiCl2 maupun CuSO4, valensi logam Co, Ni, dan Cu masing-masing
adalah +2. Senyawa-senyawa seperti ini dikatakan sebagai senyawa sederhana. Namun demikian,
peristiwa melarutnya endapan AgCl dalam larutan amonia, demikian juga berubahnya larutan biru muda
CuSO4 dalam air menjadi birutua pada penambahan larutan amonia, merupakan peristiwa yang
membingungkan para ahlikimia pada waktu itu. Hal ini disebabkan oleh hadirnya atau bergabungnya
molekul netral NH3 dalam suatu senyawa yang sudah netral tersebut, jelas tidak dapat dipahami
berdasarkan nilai valensi seperti halnya pada senyawa-senyawa sederhana di atas.Di kemudian hari
pelarutan tersebut masing-masing dapat diidentifikasi sebagai terbentuknya ion (kompleks) [Ag(NH₃)2⁺
dan [Cu(H₂O)₂(NH₃)₄]⁺².
Demikian jugakeberhasilan isolasi senyawa pink CoCl₂6H2O yang kemudian lebih tepat ditulis sebagai
[Co(H2O)6]Cl2, dan senyawa Fe(CN)2. 4KCN yang ternyata bukan garam rangkap karenatidak
menghasilkan ion CN-, lagi-lagi tidak dapat dijelaskan berdasarkan ikatan valensisederhana. Oleh karena
itu, senyawa-senyawa seperti ini dinyatakan sebagai senyawa
kompleks, sesuai dengan sifatnya yang rumit-kompleks, memerlukan pemahaman tersendirilebih lanjut.
Walaupun dewasa ini senyawa-senyawa tersebut relatif sudah bukan hal yangrumit lagi, istilah kompleks
masih tetap dipakai, istilah lain yang sering dipakai adalahsenyawa koordinasi karena senyawa kompleks
tersusun oleh ikatan koordinasi, meskipunadanya (ikatan) koordinasi tidak hanya ditunjukkan oleh
senyawa unsur-unsur transisi saja.](https://image.slidesharecdn.com/kelompok2-141127093354-conversion-gate02/85/Unsur-transisi-periode-ke-empat-18-320.jpg)