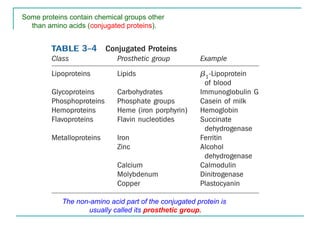
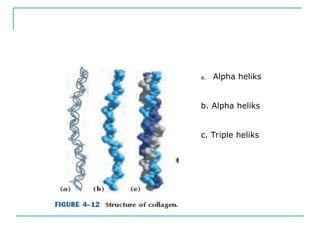
Dokumen ini menjelaskan tentang struktur dan klasifikasi protein, termasuk peptida dan polipeptida dengan variabel ukuran serta fungsi biologisnya. Protein diklasifikasikan berdasarkan fungsi, komposisi, dan struktur, serta penyebab denaturasi yang dapat mempengaruhi aktivitas biologisnya. Berbagai jenis struktur protein, seperti globular dan serabut, serta interaksi yang mempertahankan bentuknya juga dijelaskan.