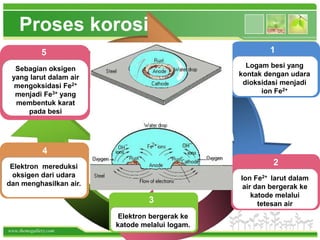
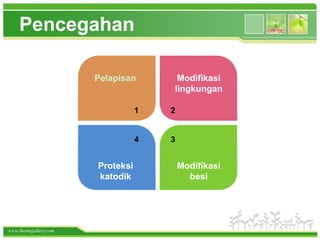
Korosi adalah reaksi kimia logam dengan lingkungan yang menghasilkan senyawa tidak diinginkan, dan paling umum terjadi pada besi, membentuk karat. Proses ini melibatkan oksidasi logam dan dapat dicegah melalui berbagai metode seperti penggunaan baja tahan karat atau pelapisan. Korosi menyebabkan kerugian besar karena mengurangi umur pakai bahan bangunan dan barang-barang yang menggunakan logam.