Hydro có cấu tạo nguyên tử đơn giản với 1 proton và 1 electron, có khả năng liên kết cộng hóa trị và tạo liên kết hydro. Tính chất vật lý của hydro bao gồm khí không màu, nhẹ, và hòa tan tốt, còn tính chất hóa học thể hiện qua khả năng tác dụng mạnh với nhiều nguyên tố và hợp chất. Trong tự nhiên, hydro thường tồn tại trong các hợp chất như nước và biểu hiện trong nhiều ứng dụng công nghiệp như sản xuất NH3 và HCl.









































![HỢP CHẤT M(+2)
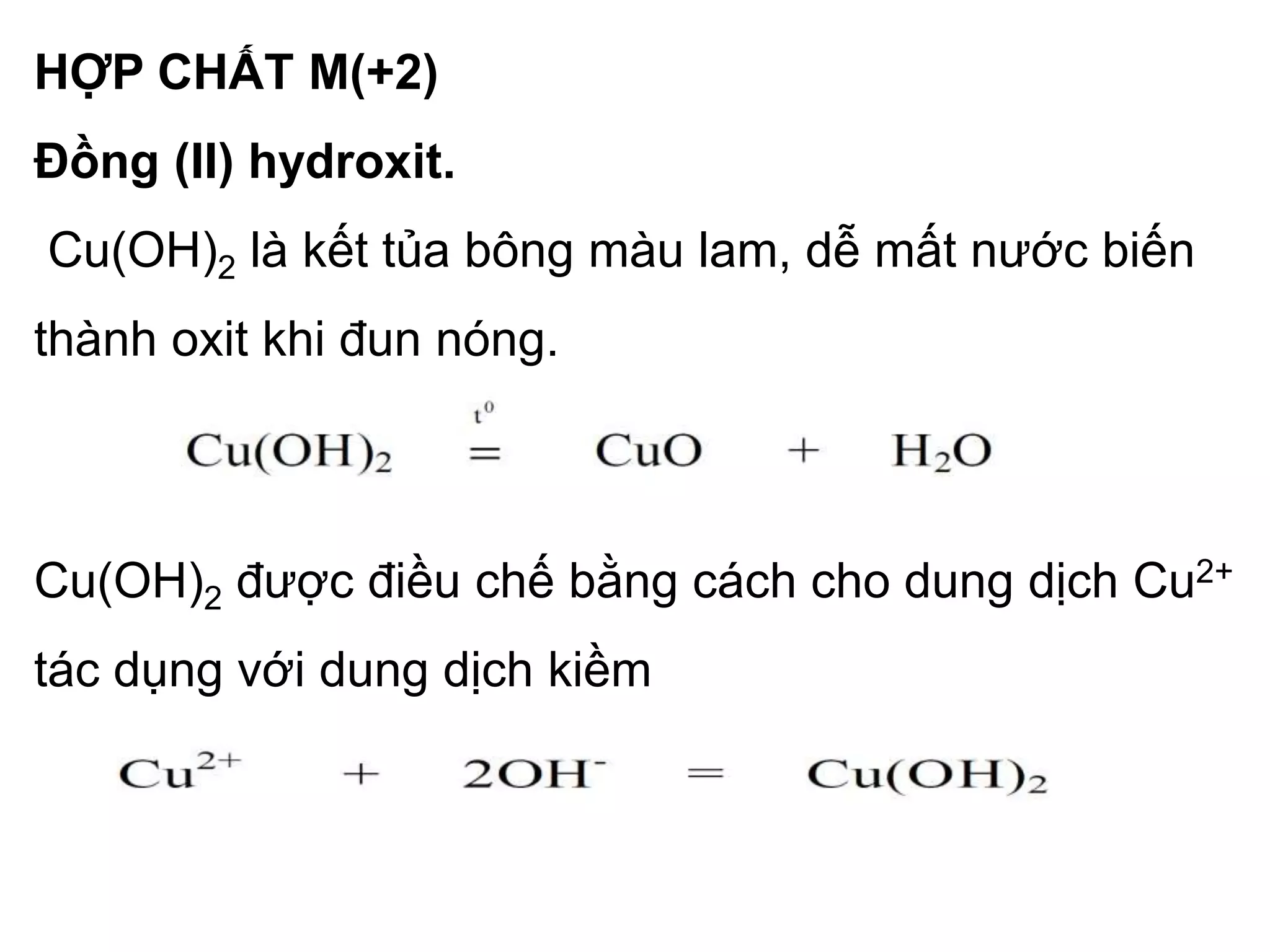
Muối đồng (II).
Đa số muối đồng (II) dễ tan trong nước, bị thủy phân
và khi kết tinh từ dung dịch thường ở dạng hidrat.
Dung dịch loãng của Cu2+ có màu xanh lam, ở trạng
thái rắn các muối của đồng có màu khác nhau.
Ion Cu2+ là chất tạo phức mạnh, những phức thường
gặp là [CuX3]- với X là F, Cl, [Cu(C2O4)2]2- ,
[Cu(NH3)4]2+](https://image.slidesharecdn.com/hvcochng1-151217062207/75/Hvco-ch-ng-1-45-2048.jpg)














