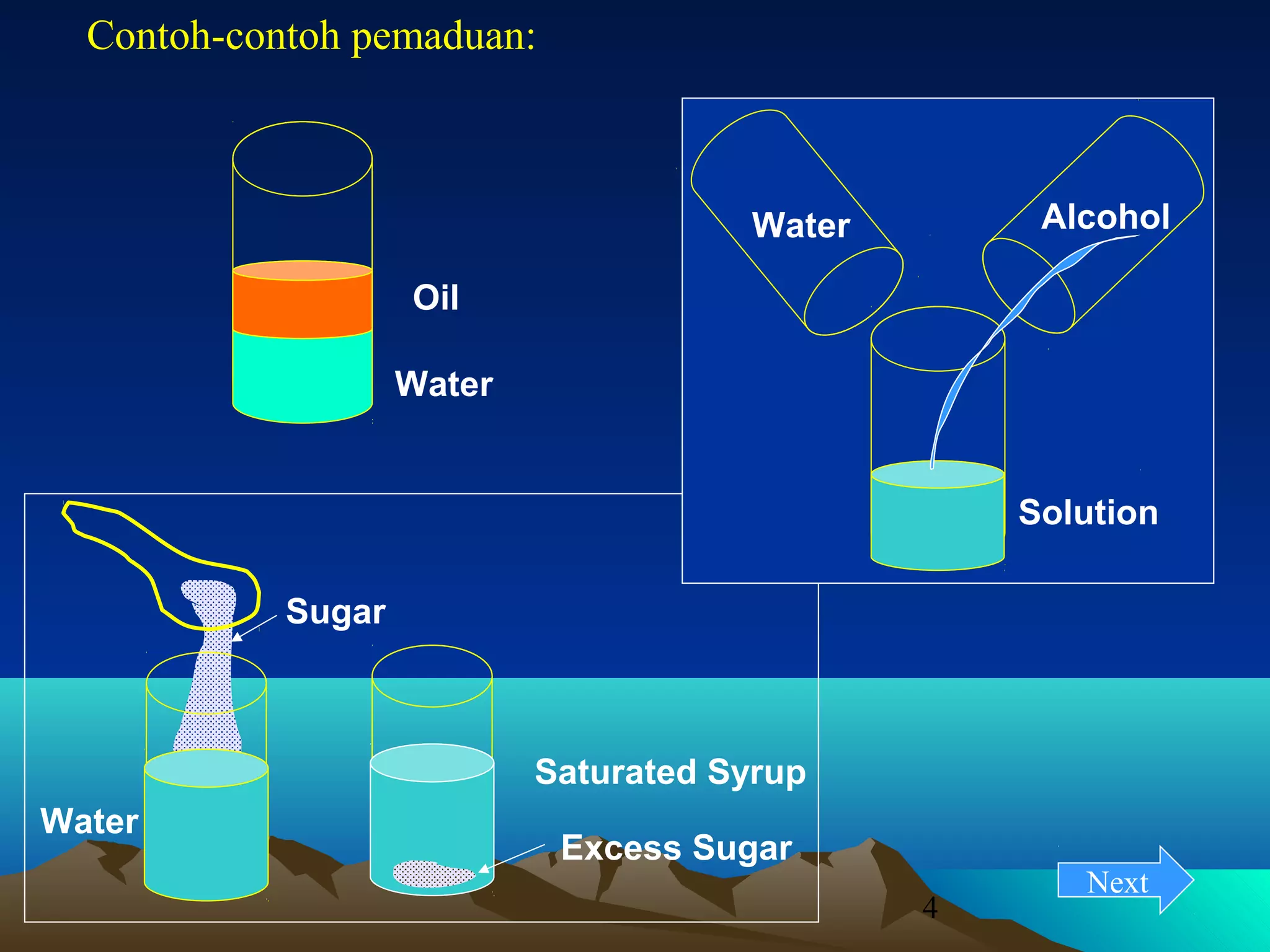
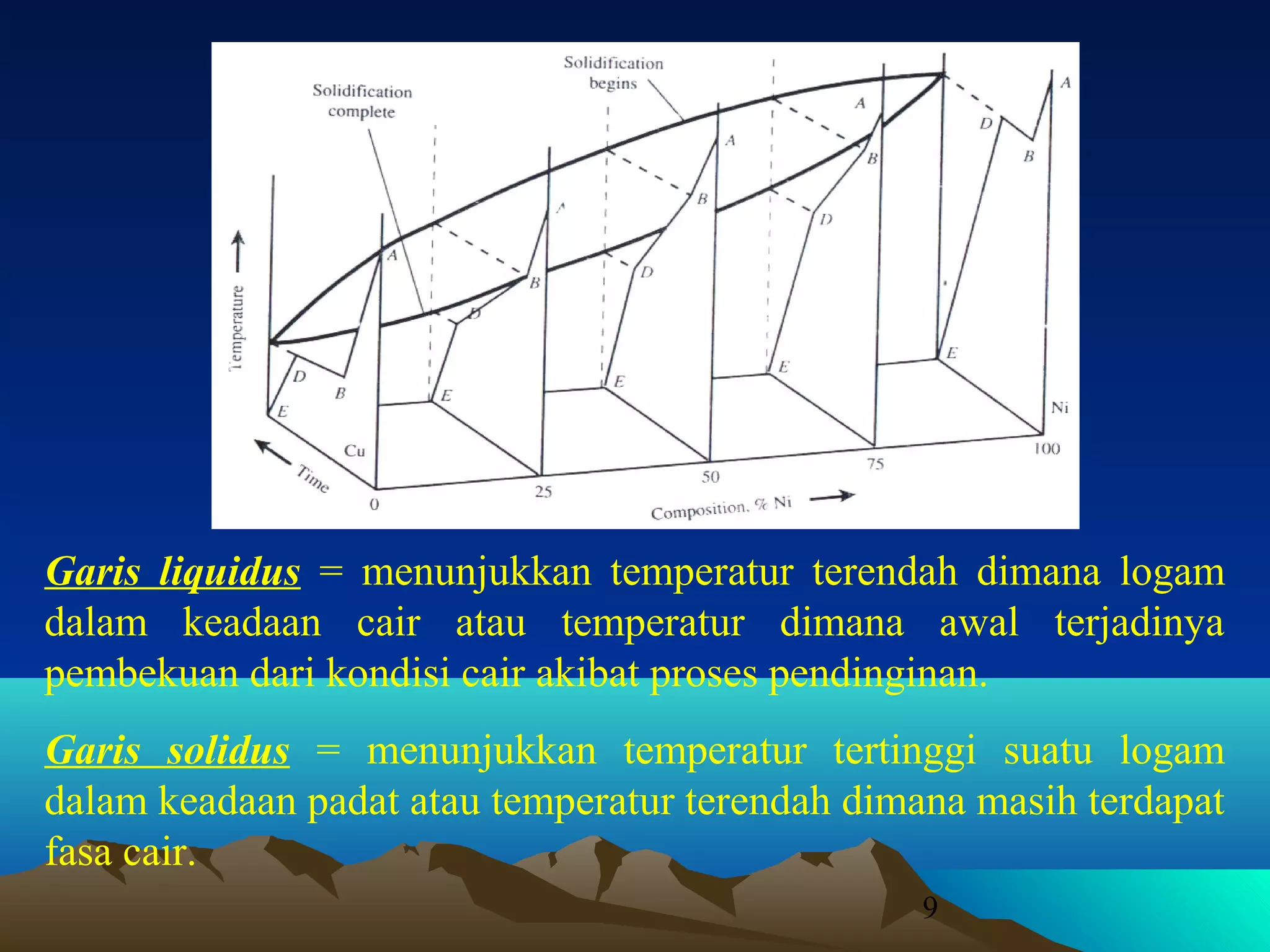
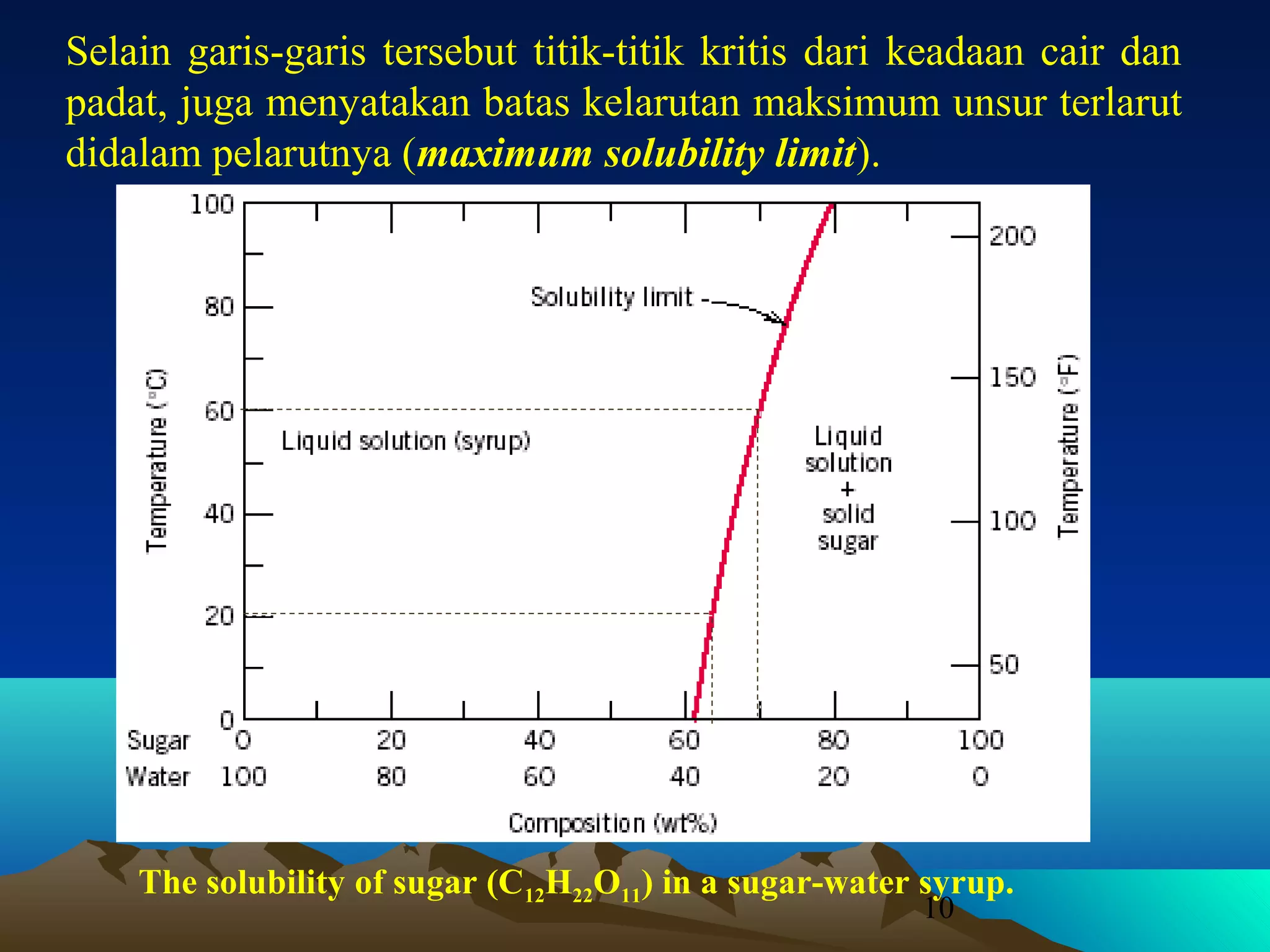
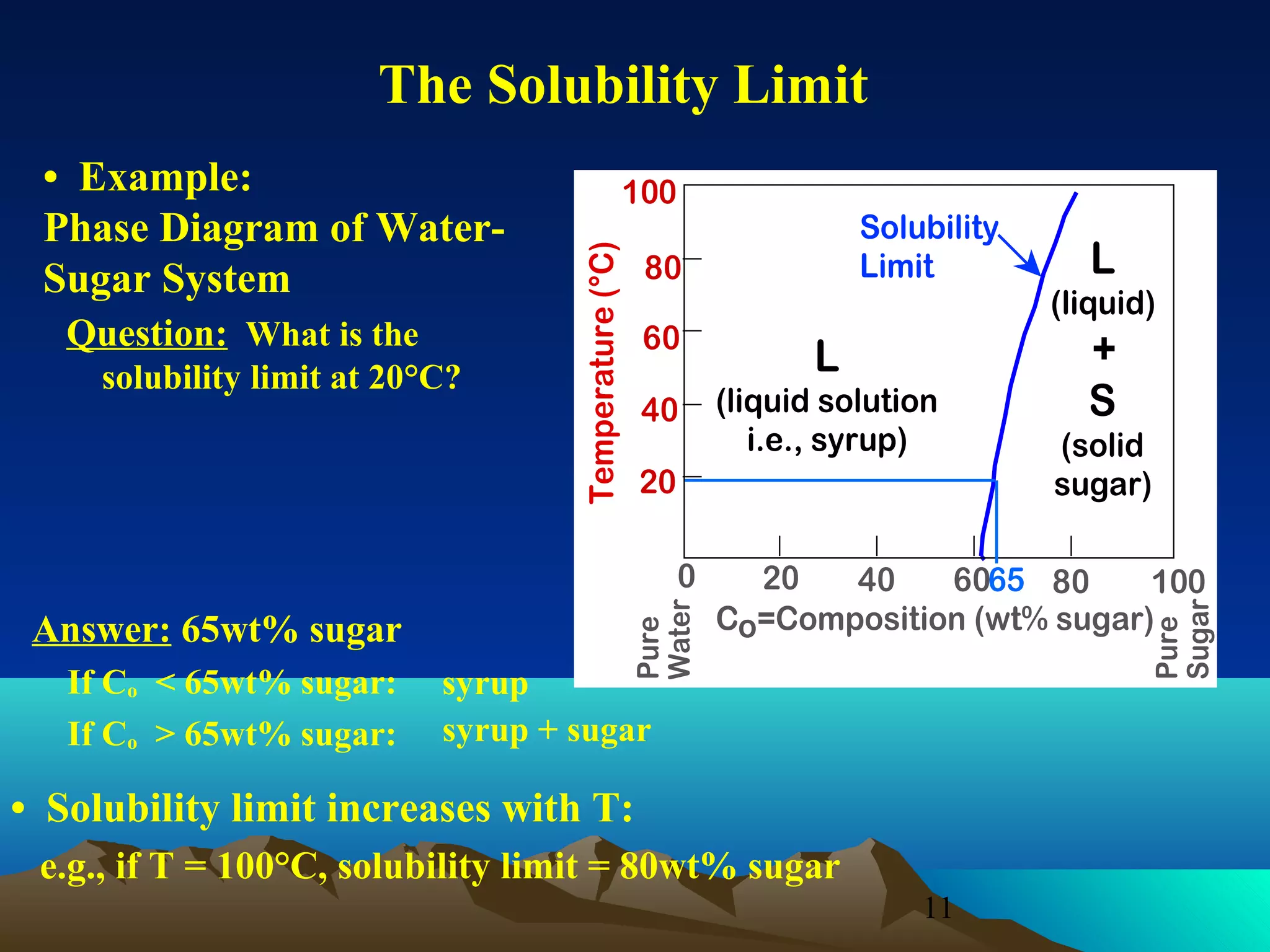
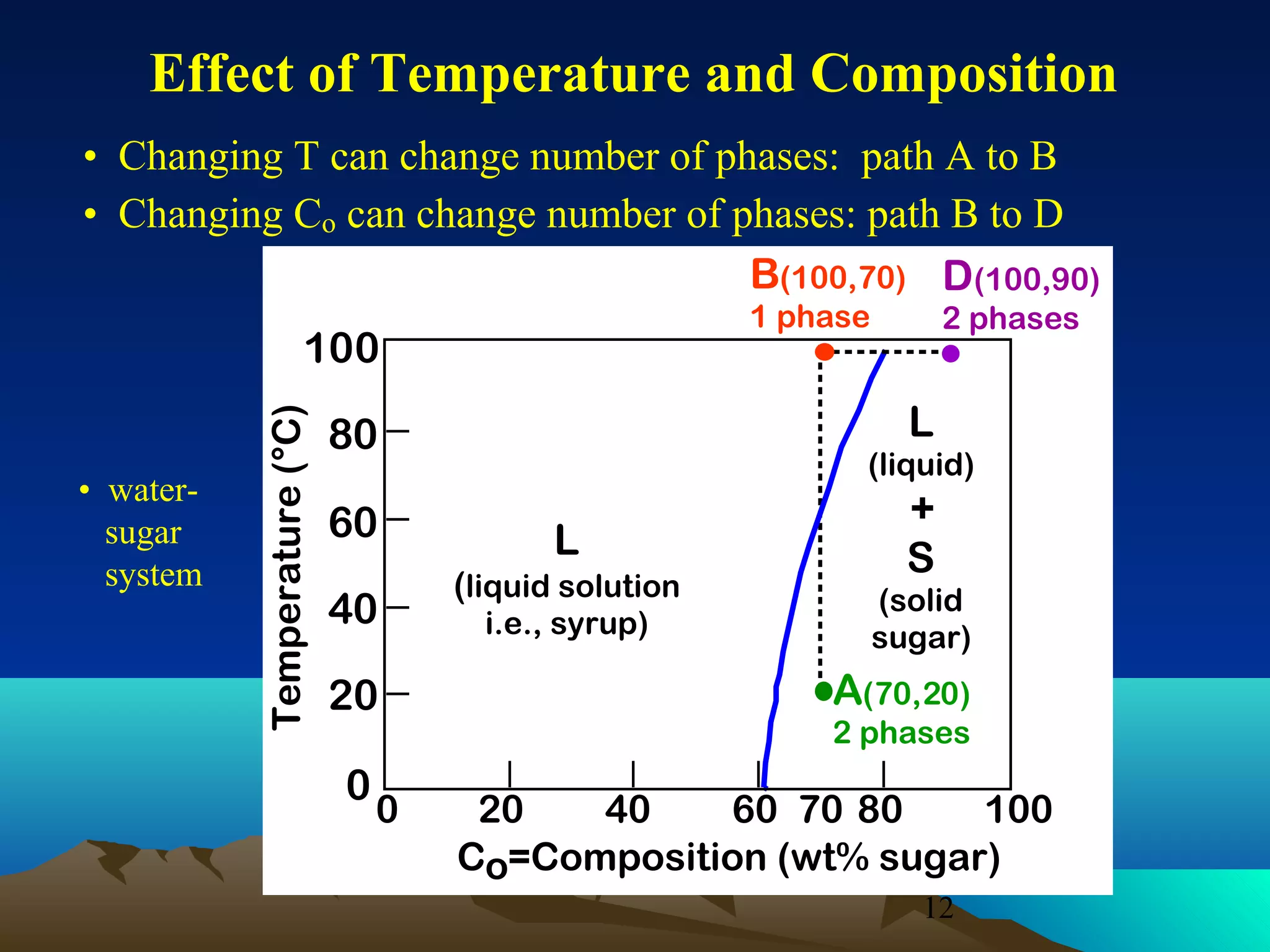
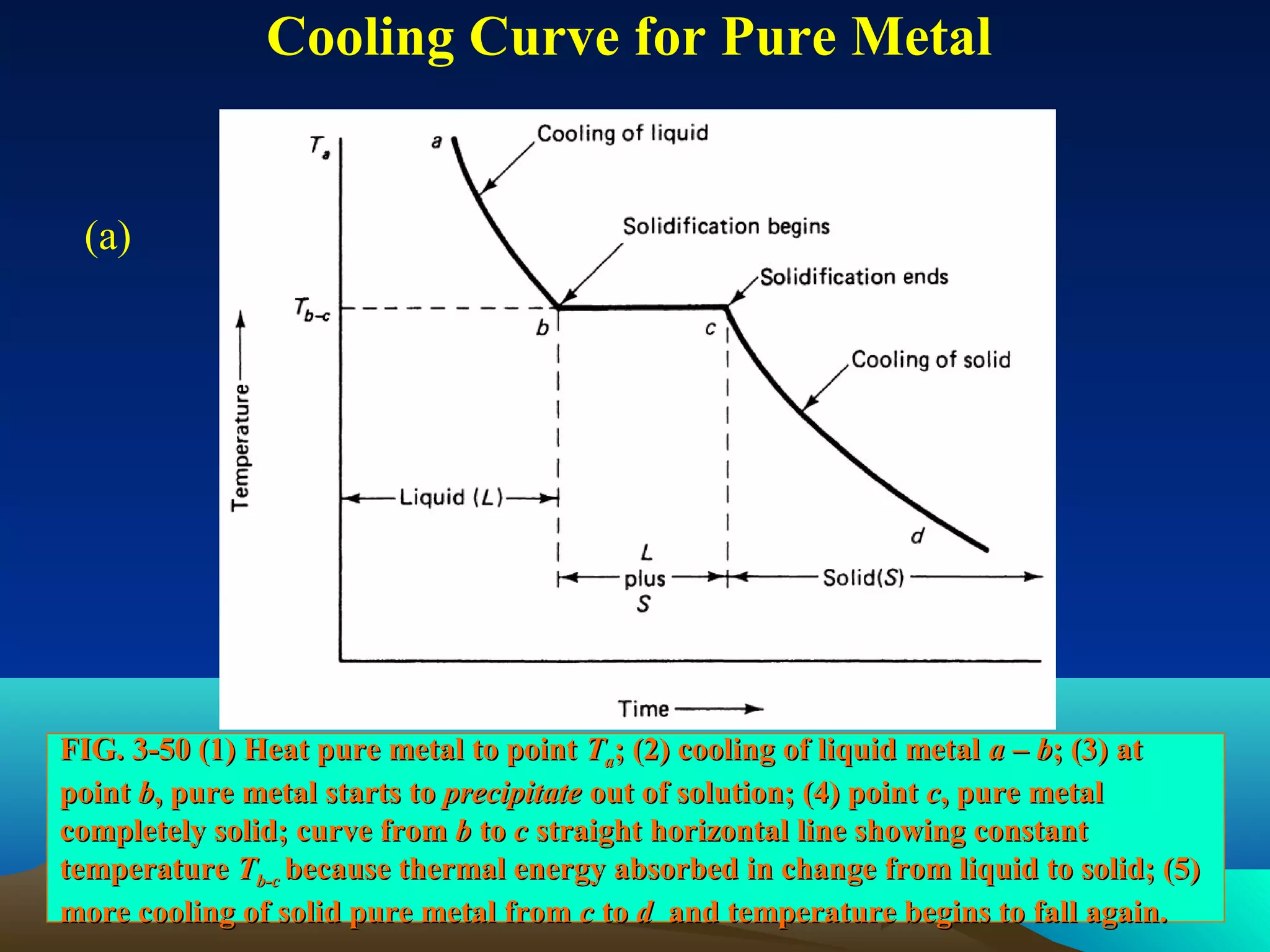
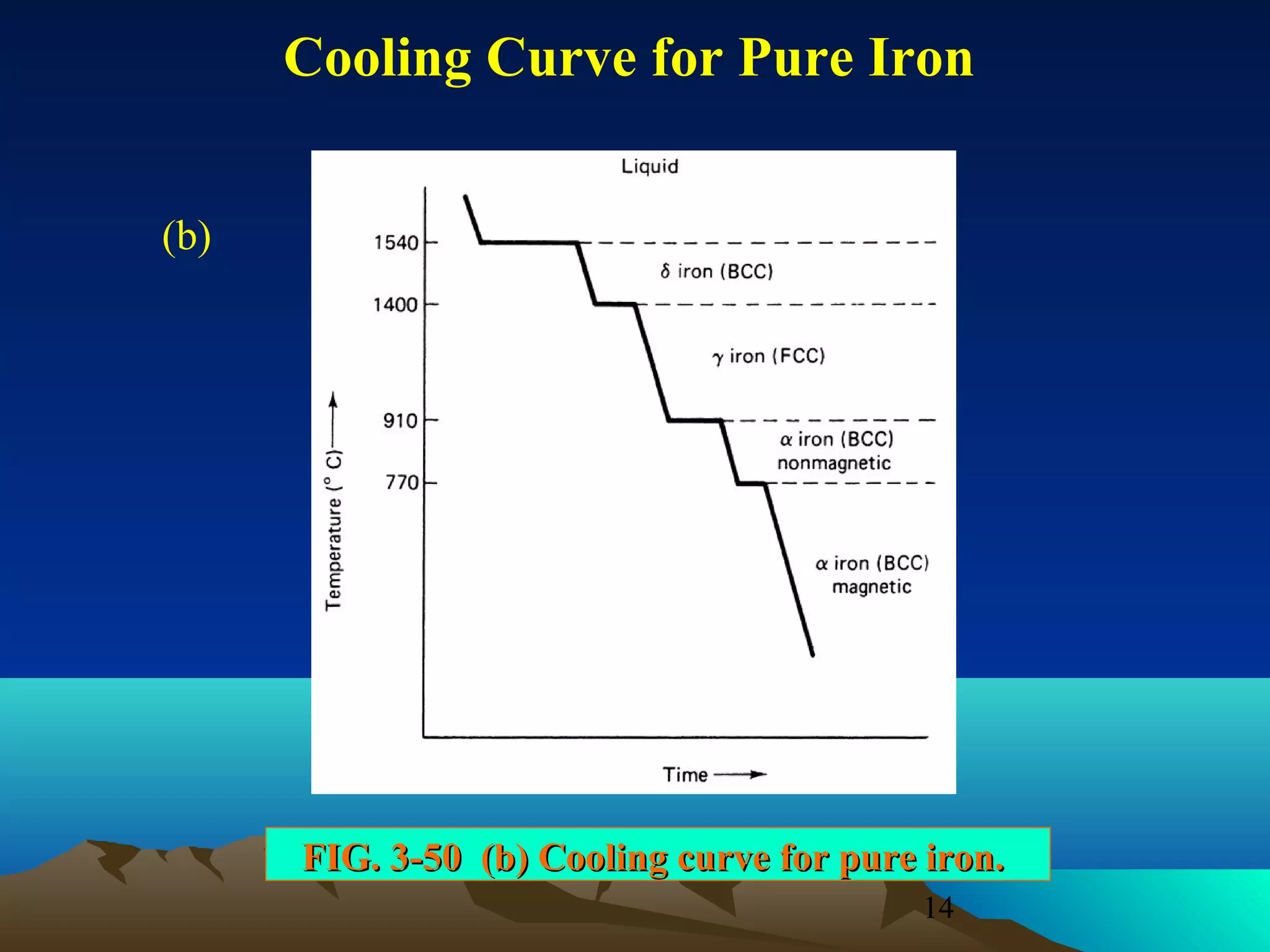
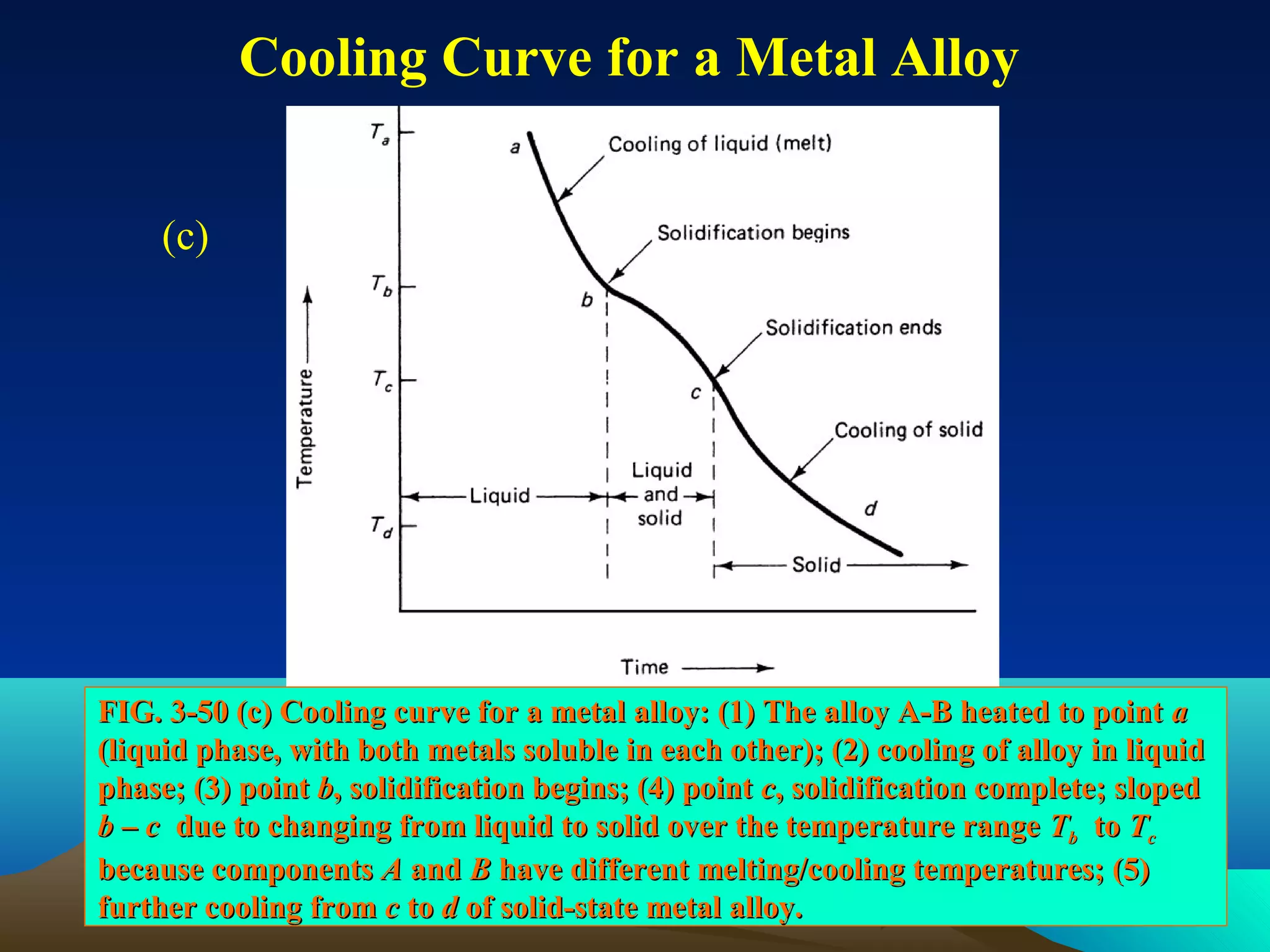
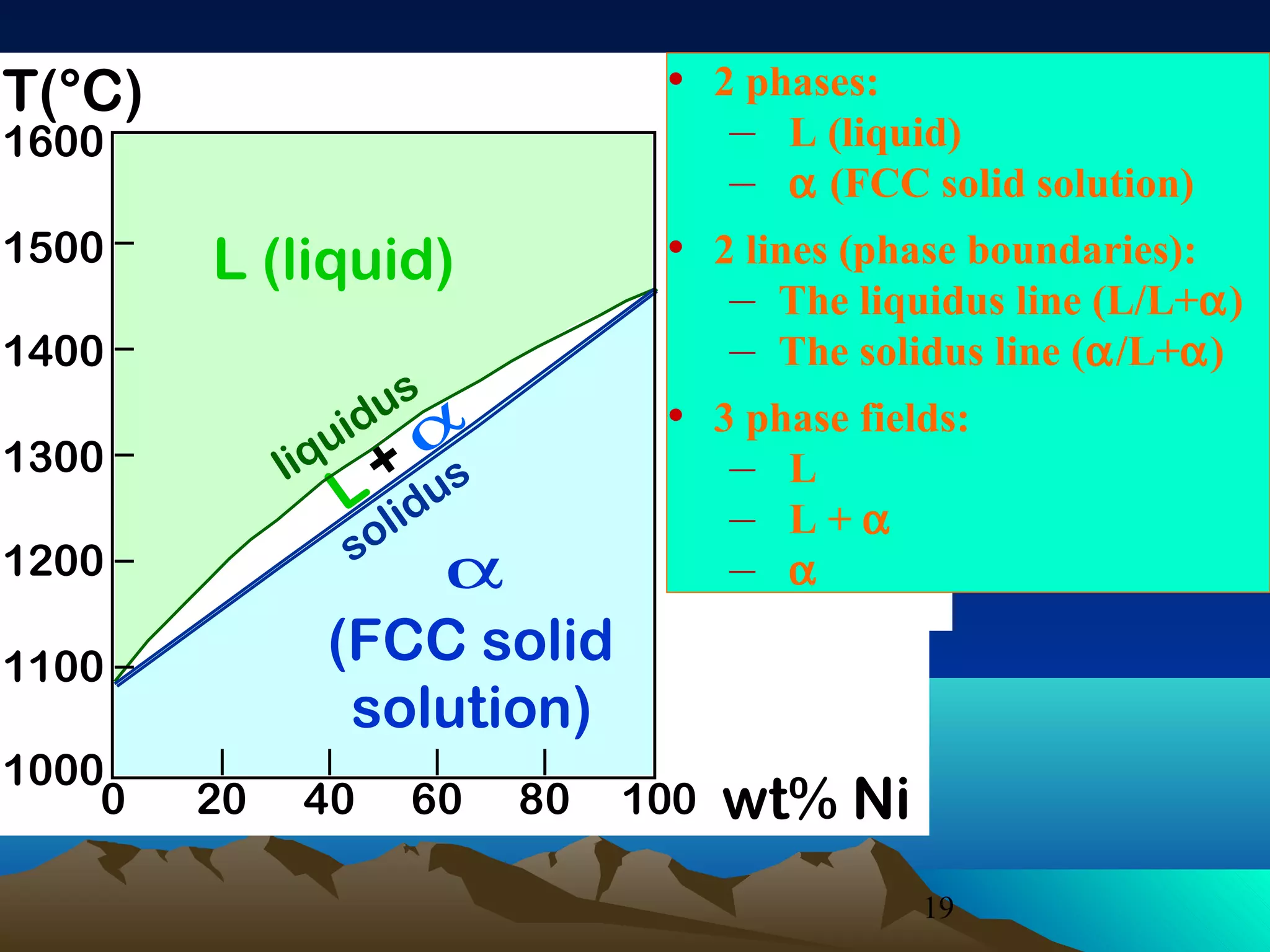
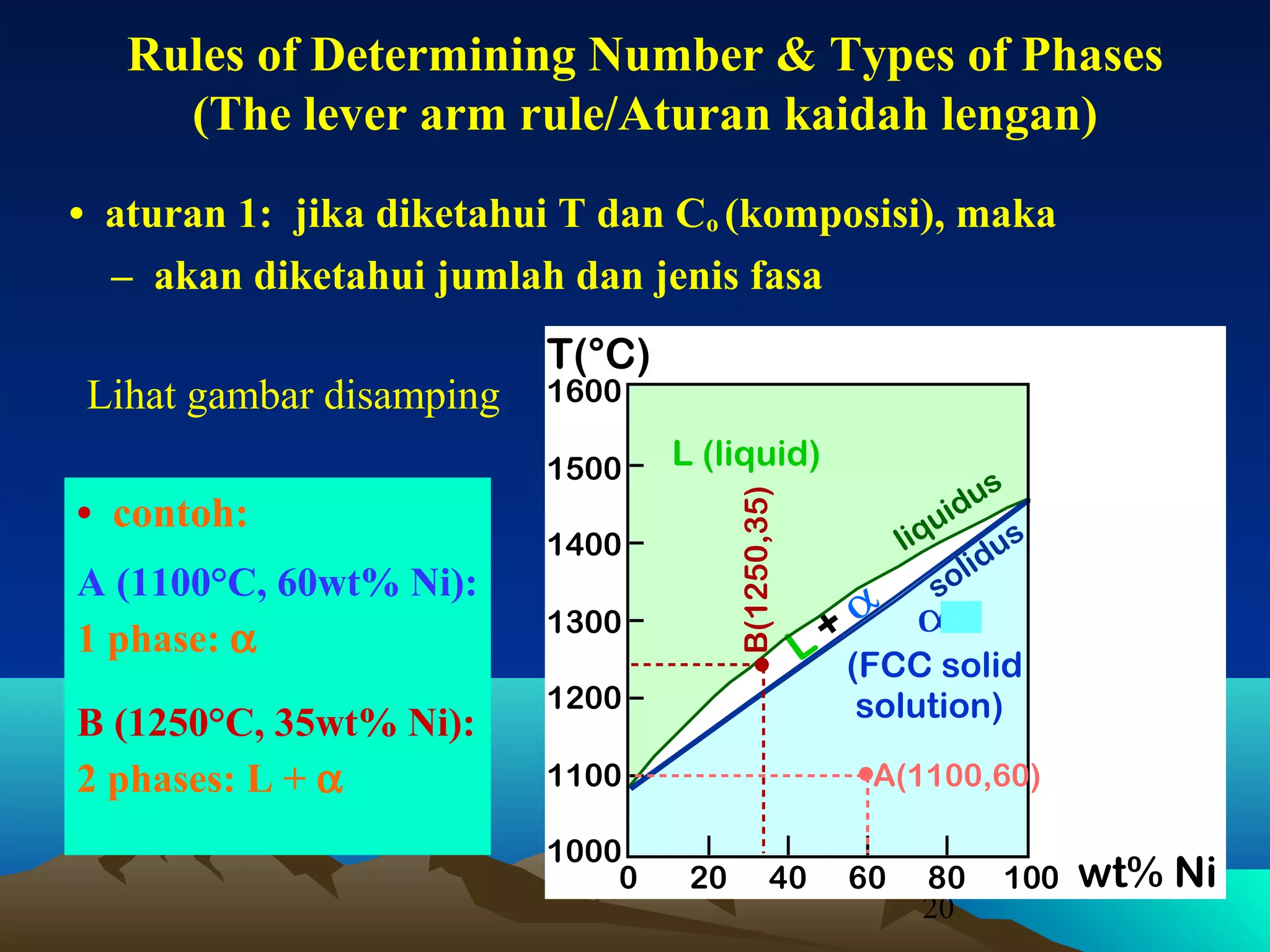
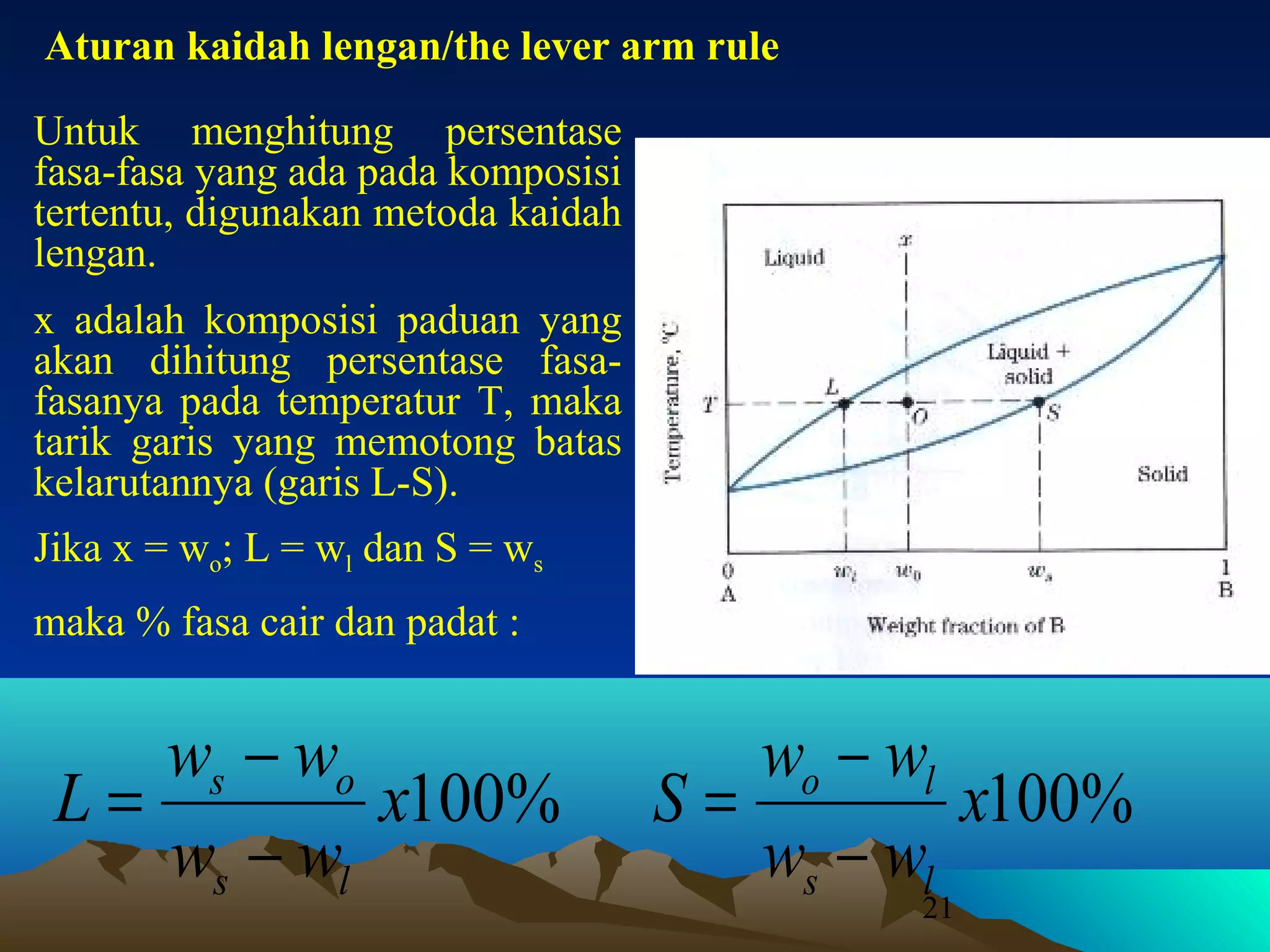
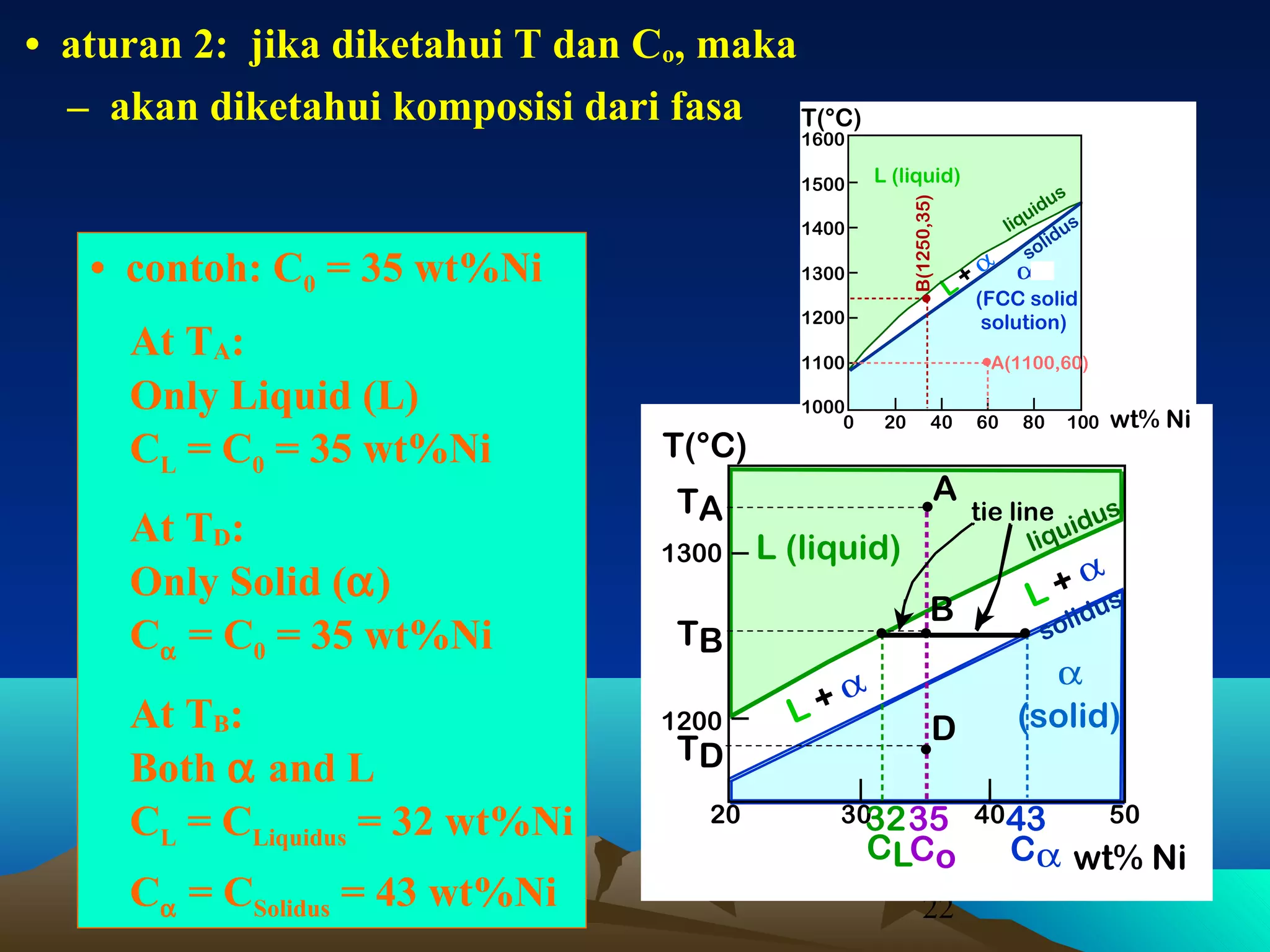
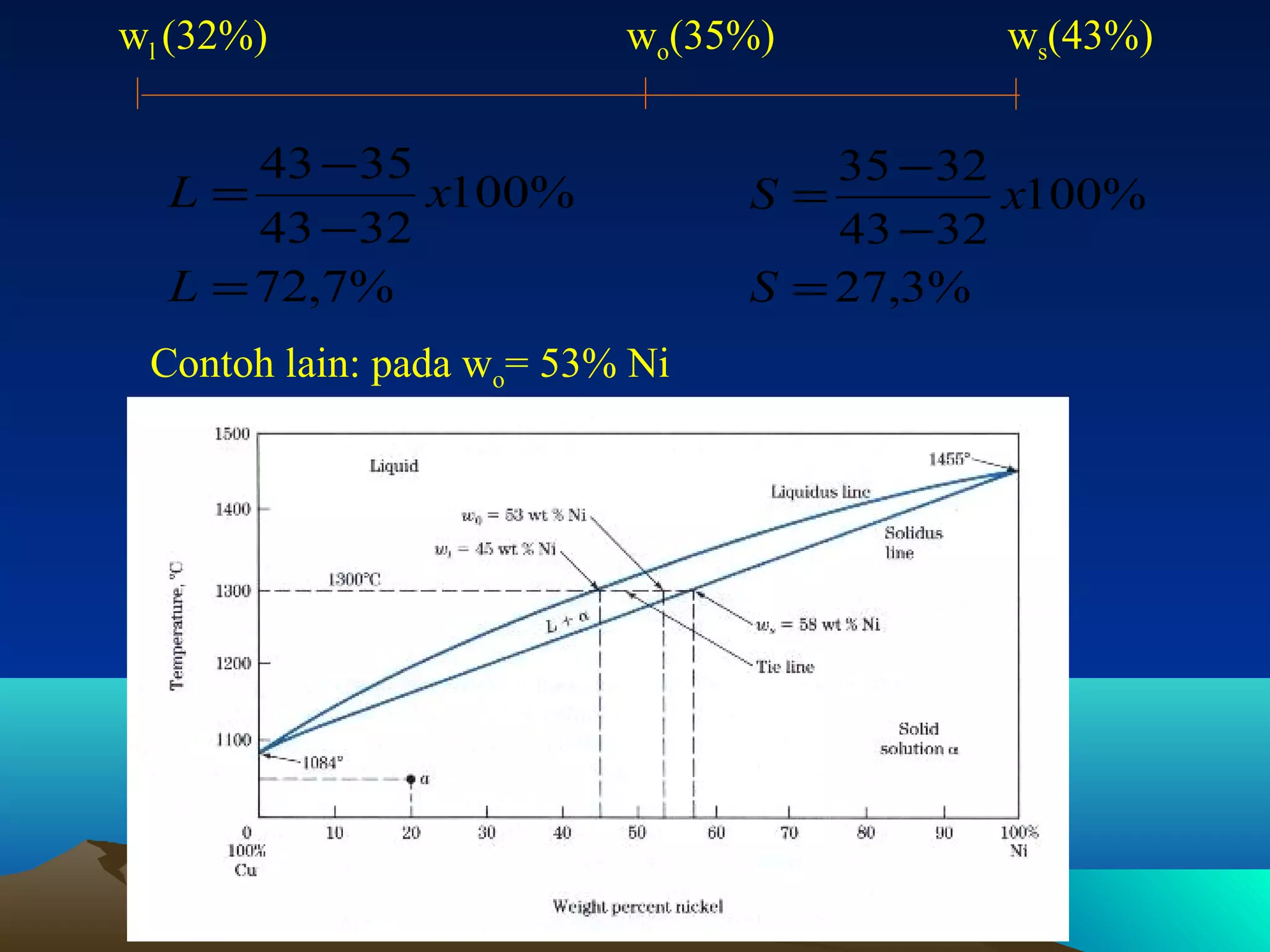
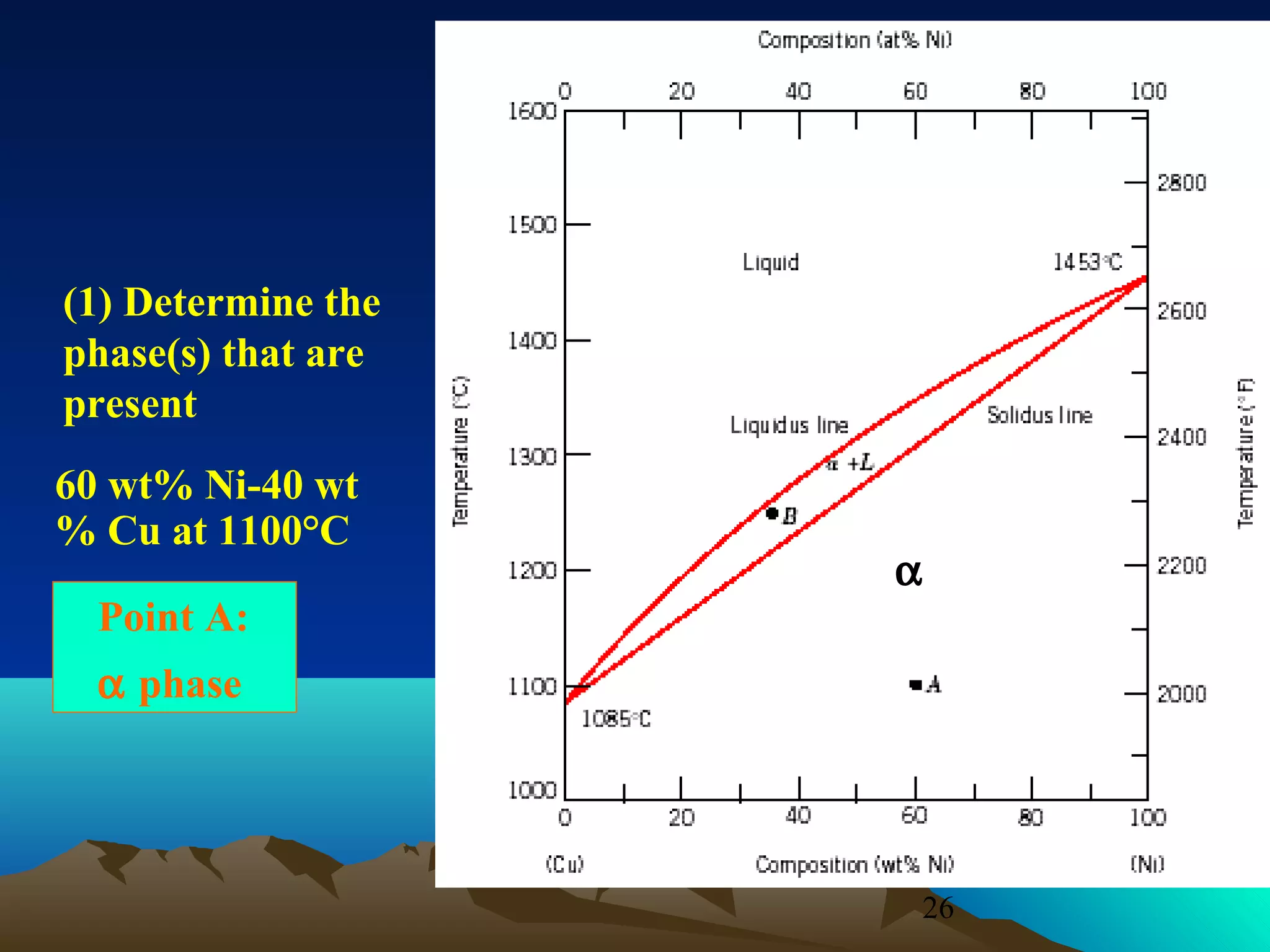
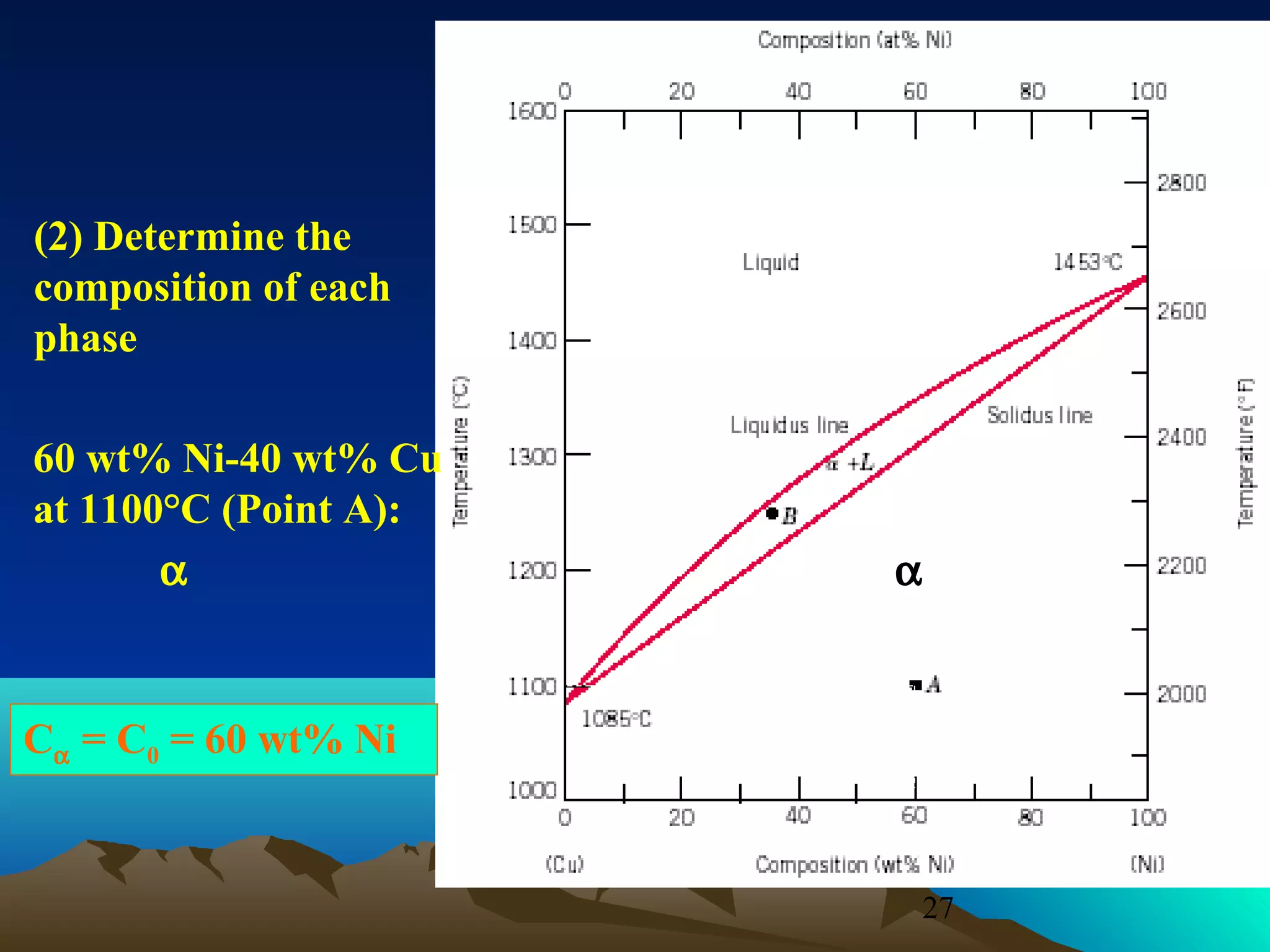
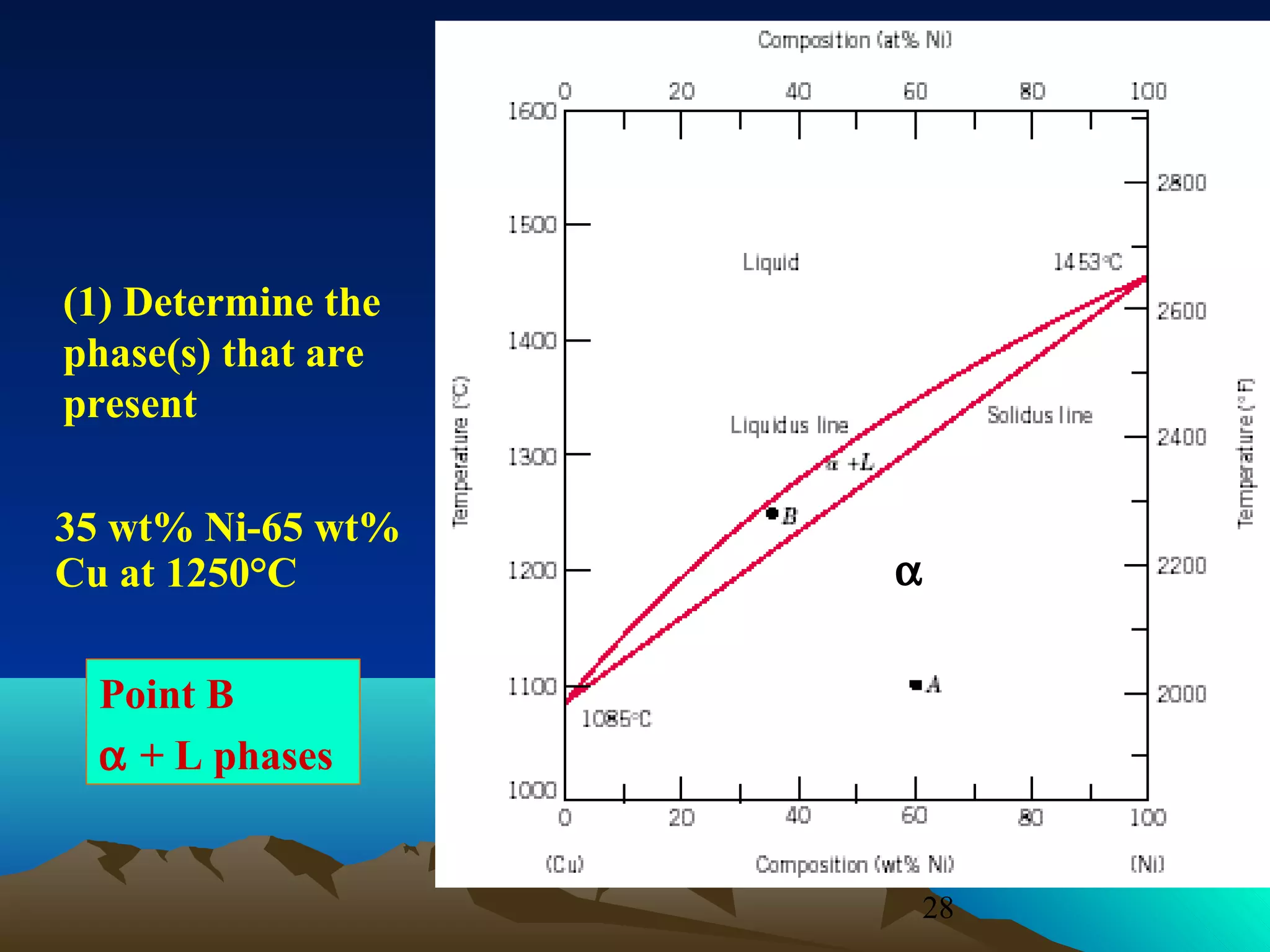
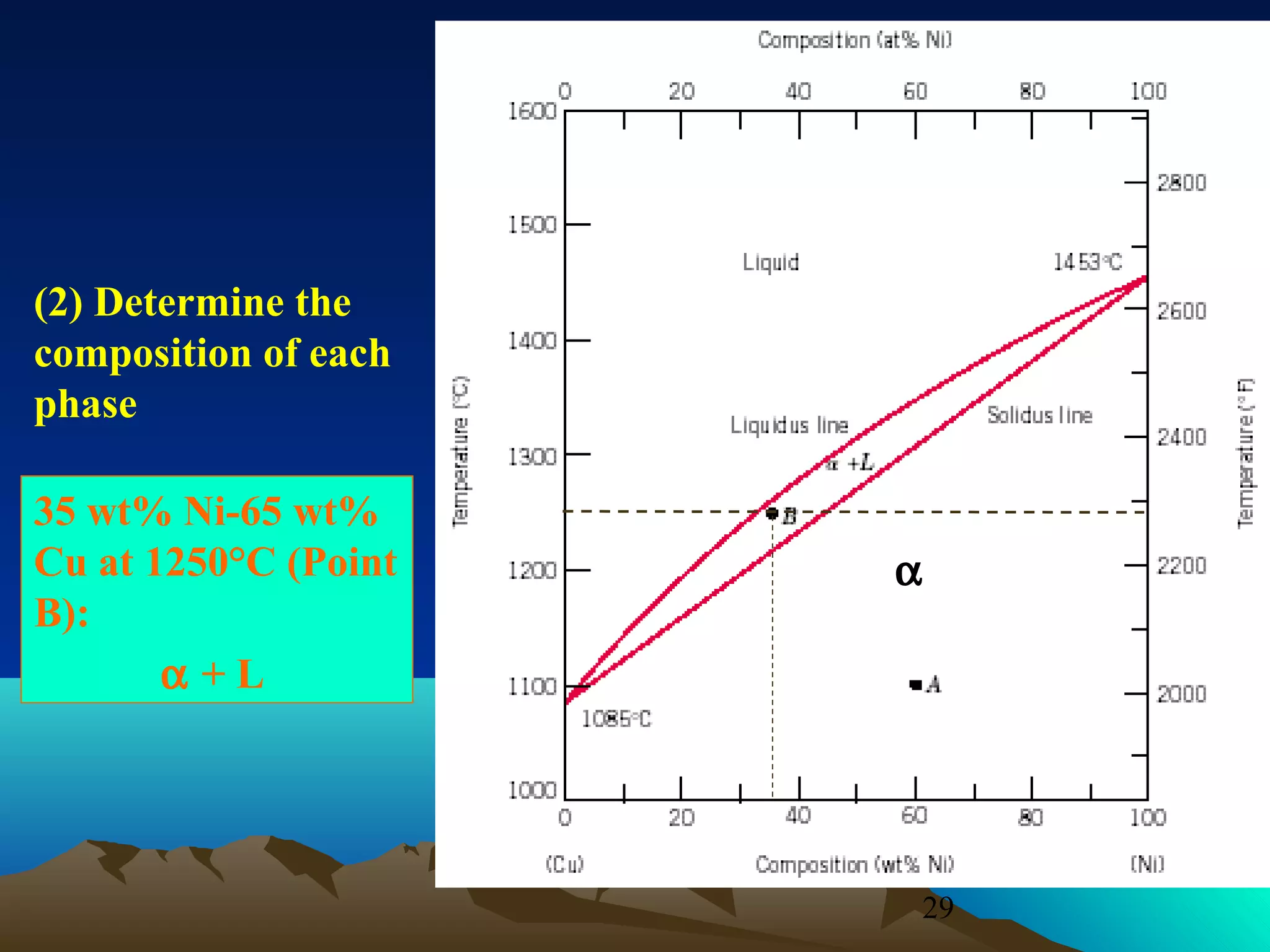
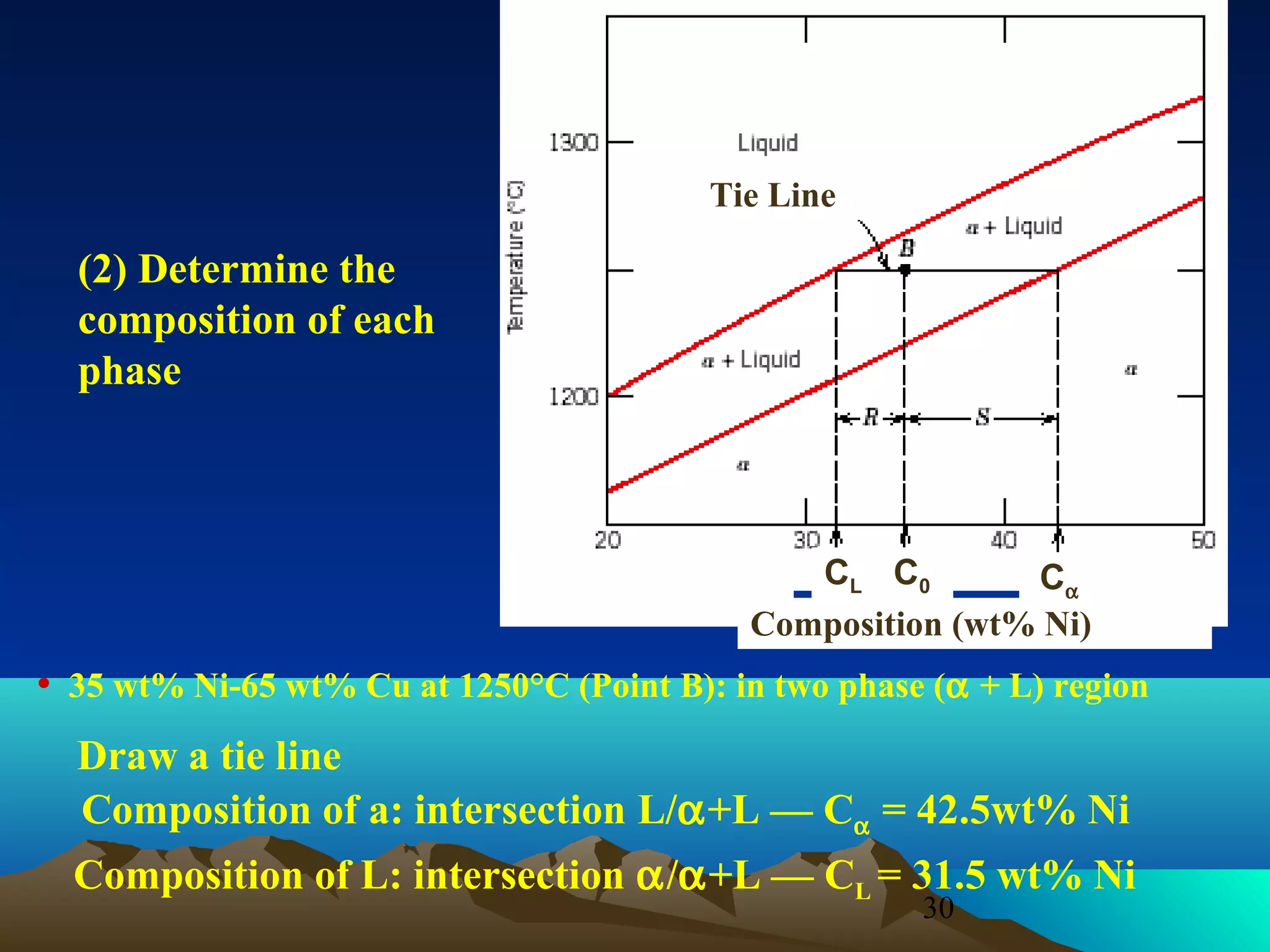
Diagram fasa menunjukkan hubungan antara komposisi, temperatur, dan fasa yang terbentuk pada suatu paduan logam. Diagram ini berguna untuk memprediksi sifat dan perubahan fasa pada suatu paduan dengan variasi komposisi dan temperatur. Terdapat beberapa jenis diagram fasa berdasarkan kelarutan logam dalam keadaan cair dan padat.