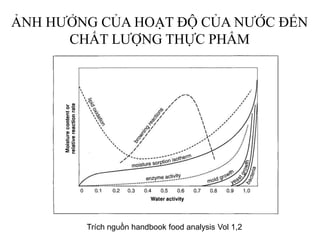
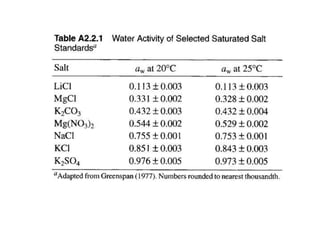
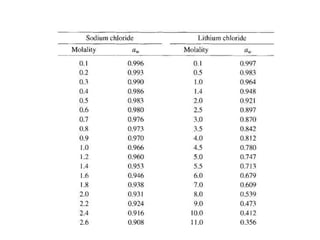
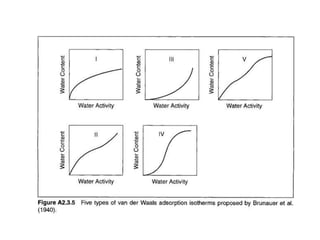
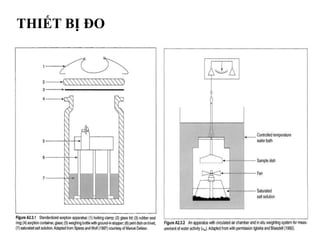
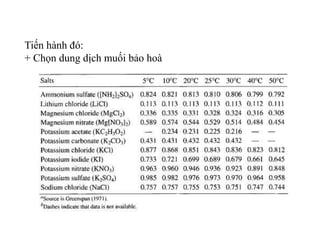
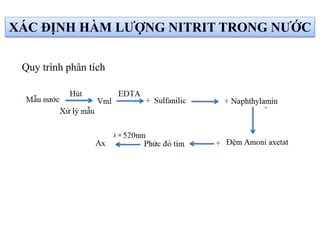
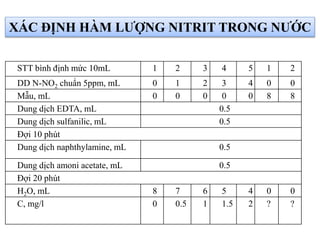
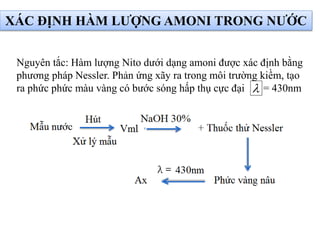
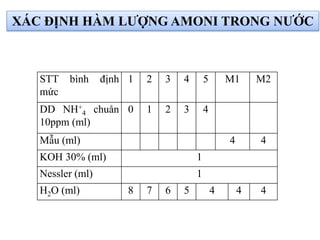
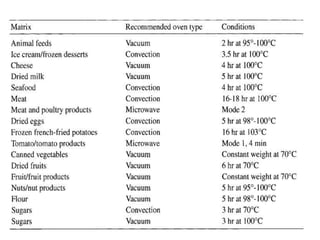
Tài liệu phân tích ảnh hưởng của nước đối với bảo quản thực phẩm và các phương pháp xác định hàm lượng nước trong thực phẩm. Các phương pháp bao gồm đo trực tiếp và gián tiếp, như sấy đối lưu, sấy chân không, sấy vi sóng và chuẩn độ Karl Fischer. Ngoài ra, tài liệu cũng đề cập đến hoạt độ của nước và ảnh hưởng của nó đến chất lượng thực phẩm.












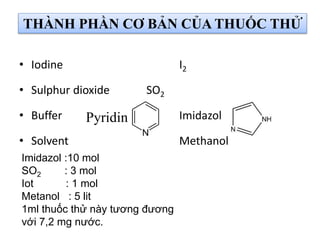
![Phản ứng KarlFisher I.
CH3OH + SO2 + RN [RNH]SO3CH3
II.
H2O + I2 + [RNH]SO3CH3 + 2RN
[RNH]SO4CH3 + 2[RNH]I
(RN = Base)
I2 + SO2 + 2H2O ↔ 2HI + H2SO4
KARL FISCHER TITRATION
Phản ứng Bunsen](https://image.slidesharecdn.com/bigingchng4phntchnc-141216205717-conversion-gate02/85/Bai-gi-ng-ch-ng-4-phan-tich-n-c-15-320.jpg)