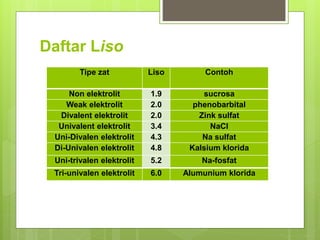
Dokumen tersebut membahas tentang isotonic dan pengatur pH. Isotonic merupakan larutan yang memiliki tekanan osmosis sama dengan cairan tubuh. Larutan obat suntik harus isotonic agar tidak merusak jaringan. Pengatur pH digunakan untuk menstabilkan obat dan mengurangi iritasi. Dapar seperti asam asetat dan sitrat dapat digunakan sebagai pengatur pH.