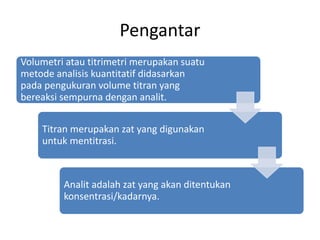
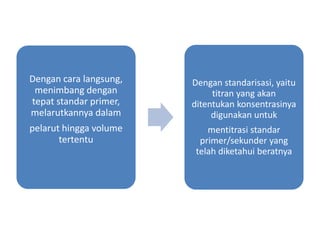
Volumetri atau titrimetri adalah metode analisis kuantitatif dengan mengukur volume titran yang bereaksi dengan analit. Metode ini memerlukan reaksi kimia yang tepat dan keakuratan dalam menentukan konsentrasi larutan standar. Titrasi balik digunakan untuk reaksi yang lambat, sementara alat ukur seperti buret dan labu takar harus memenuhi standar analisa kimia.