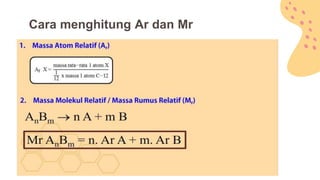
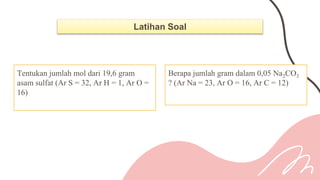
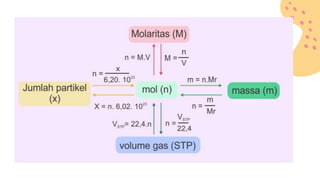
Dokumen ini membahas konsep stoikiometri, termasuk cara menghitung massa atom relatif (Ar) dan massa molekul relatif (Mr) dari berbagai senyawa kimia. Terdapat beberapa contoh perhitungan yang melibatkan penggunaan angka Avogadro dan hubungan antara mol, massa, dan volume gas pada kondisi standar. Juga disertakan latihan soal untuk pemahaman lebih lanjut mengenai topik-topik tersebut.