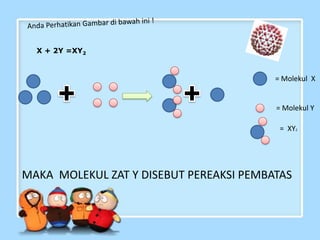
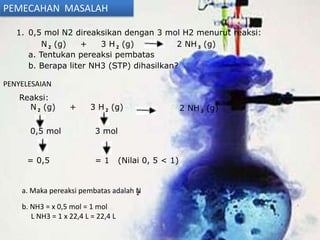
Dokumen ini menjelaskan tentang pereaksi pembatas dalam reaksi kimia, yaitu zat yang habis terlebih dahulu karena perbandingan koefisien reaksi yang tidak seimbang. Terdapat langkah-langkah untuk menentukan pereaksi pembatas dan beberapa contoh pemecahan masalah terkait. Selain itu, terdapat dialog antara Gina dan Ridwan yang mengaitkan konsep pereaksi pembatas dengan kehidupan dan keberuntungan dalam menghadapi ujian.