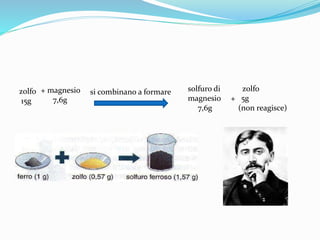
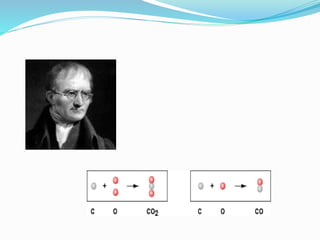
Il documento descrive le leggi ponderali in chimica, tra cui la legge di Lavoisier sulla conservazione della massa, la legge di Proust delle proporzioni definite e la legge di Dalton delle proporzioni multiple. Queste leggi evidenziano la regolarità delle reazioni chimiche e l'importanza del comportamento delle quantità di sostanze coinvolte. Viene anche menzionata la teoria atomica di Dalton, che afferma che la materia è composta da atomi, che si combinano in rapporti numerici definiti durante le reazioni.