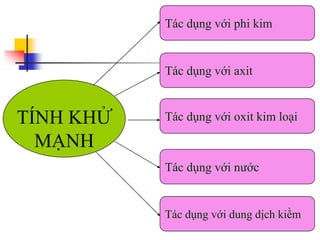
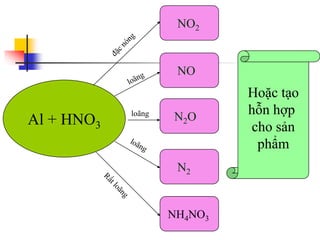
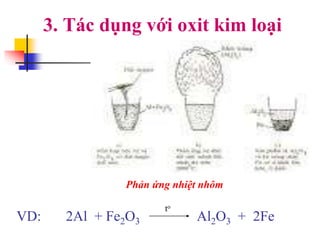
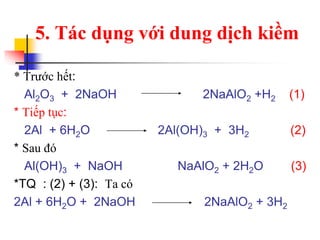
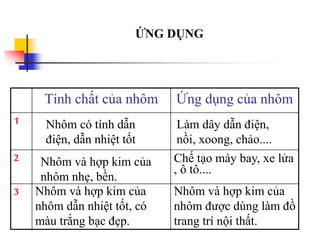
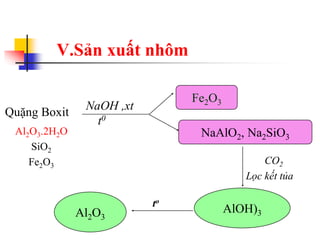
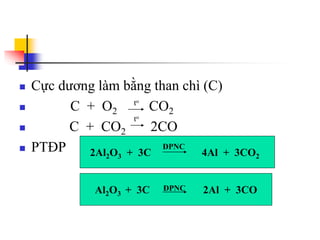
Tài liệu trình bày về kim loại nhôm, bao gồm vị trí trong bảng tuần hoàn, cấu hình electron, và các tính chất vật lý và hóa học của nó. Nhôm có ứng dụng rộng rãi trong đời sống và công nghiệp, từ đồ dùng hàng ngày đến vật liệu xây dựng. Nhôm tồn tại chủ yếu dưới dạng hợp chất trong tự nhiên và được sản xuất qua quá trình điện phân.





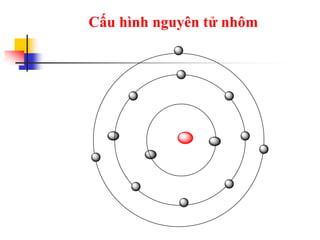
![* Cấu hình electron của nguyên tử: [Ne]3s23p1
* Độ âm điện: 1,61
* Số oxi hóa đặc trưng trong hợp chất: +3
*Al ở ô số 13, nhóm IIIA, chu kỳ 3 của bảng tuần
hoàn.
I . VỊ TRÍ - CẤU HÌNH ELECTRON NGUYÊN TỬ](https://image.slidesharecdn.com/bigingint-121225220757-phpapp01/85/Bai-gi-ng-dien-t-7-320.jpg)