Документ охватывает основы молекулярной физики и термодинамики, включая количество вещества, моль и молярную массу, а также уравнение состояния идеального газа. Он объясняет различные изопроцессы (изобара, изохора, изотерма) и их графическое представление, связывая микропараметры и макропараметры. Презентация содержит примеры вычислений и иллюстрации, помогающие понять термодинамические принципы.


![16.04.2014 3
Моль и молярная масса
Механика. Блок 3 Виктор Сиволгин victor.sivolgin@physics.msu.ru Слайд из 12
Измерение количества молекул и их массы
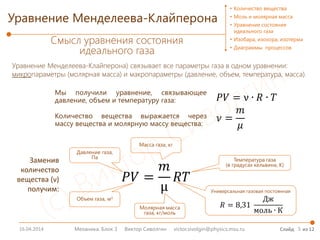
Мы обозначили количество вещества, содержащее 6,02∙1023 частиц вещества, за 1 моль.
Как измерять вещество в молях? Как количество молей связаны с массой вещества?
• Количество вещества
• Моль и молярная масса
• Уравнение состояния
идеального газа
• Изобара, изохора, изотерма
• Диаграммы процессов
1 моль содержит количество частиц вещества, равное числу Авогадро (NA = 6,02∙1023 ).
Если известна масса одной молекулы (m0), то можно вычислить молярную массу (μ):
µ = 𝑚𝑚0 ∙ 𝑁𝑁𝐴𝐴
Т.о. молярная масса – это масса одного моля вещества.
Молярная масса указана в таблице Менделеева (в граммах на
моль; для расчетов необходимо переводить в кг/моль).
молярная
масса
=
[килограмм]
[моль]
г/моль
𝝂𝝂 =
𝑁𝑁
𝑁𝑁𝐴𝐴
=
𝑚𝑚0 ∙ 𝑁𝑁
𝑚𝑚0 ∙ 𝑁𝑁𝐴𝐴
=
𝒎𝒎
𝝁𝝁
Как вычислить количество молей? Надо узнать, сколько раз
число Авогадро содержится в количестве частиц вещества,
т.е. сколько раз молярная масса содержится в массе вещества.
ν =
80 г
16 г/моль
= 5 моль
Пример. 48 грамм водорода
содержит 3 моля вещества:](https://image.slidesharecdn.com/3-140406150000-phpapp02/85/slide-3-320.jpg)