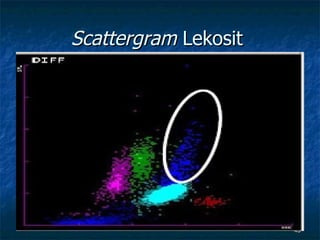
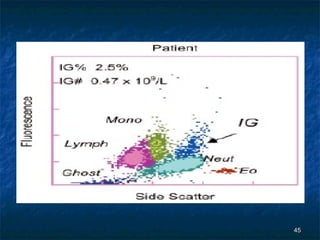
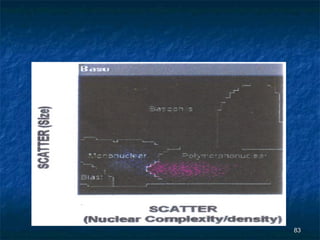
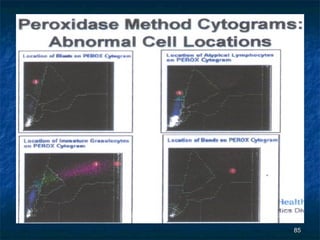
Dokumen ini membahas tentang pemeriksaan hitung jenis lekosit menggunakan berbagai metode, termasuk metode manual dan otomatis serta teknik pewarnaan dan analisis. Kegunaan klinis pemeriksaan ini adalah untuk membantu diagnosis kelainan darah seperti infeksi dan leukemia. Terdapat berbagai metode pengukuran untuk menentukan jenis dan jumlah lekosit, serta analisis morfologi yang penting dalam penilaian klinis.