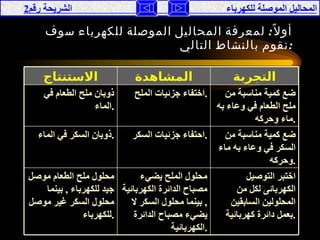
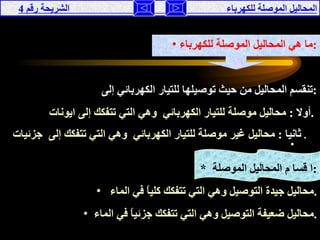
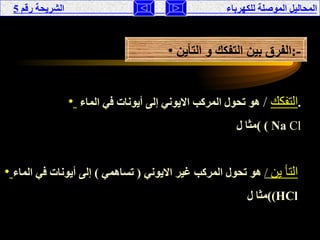
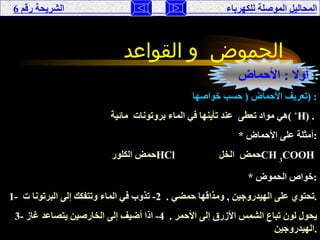
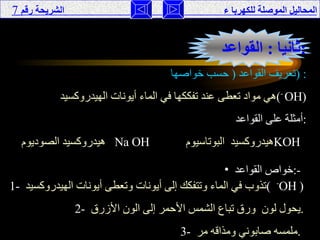
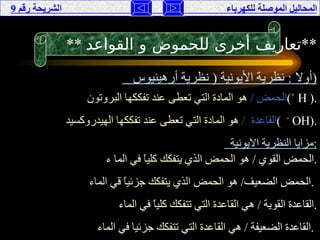
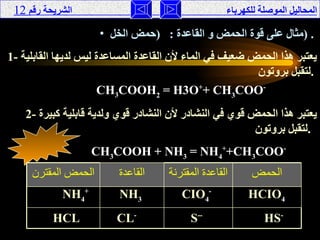
تناقش الوثيقة المحاليل الموصلة للكهرباء، حيث يتم تصنيفها إلى موصلة وغير موصلة بناءً على تفككها إلى أيونات أو جزيئات. تقدم الوثيقة شرحًا لخصائص الأحماض والقواعد، وتفسر كيفية إجراء التجارب لفهم توصيل الكهرباء في هذه المحاليل. كما تشمل مقارنة بين نظريات مختلفة تفسر سلوك الأحماض والقواعد.