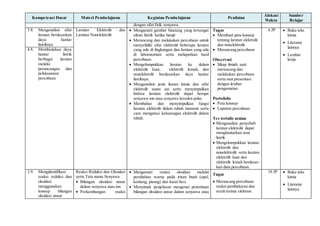
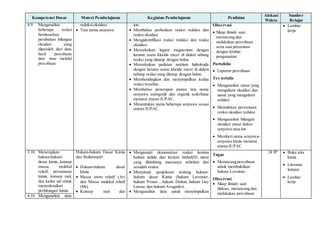
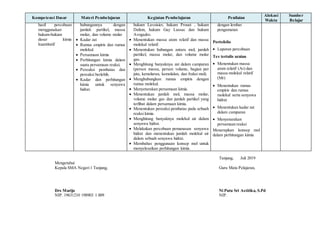
Dokumen ini adalah silabus untuk mata pelajaran kimia di SMA Negeri 1 Tanjung, yang mencakup kompetensi inti dan dasar untuk kelas X, alokasi waktu, serta rincian materi pembelajaran terkait metode ilmiah, struktur atom, tabel periodik, ikatan kimia, larutan, serta reaksi kimia. Silabus ini juga mencakup kegiatan pembelajaran, penilaian, dan sumber belajar yang dirancang untuk meningkatkan pemahaman dan penerapan konsep kimia. Tujuannya adalah untuk membangun keterampilan ilmiah dan pemecahan masalah siswa dalam konteks ilmu pengetahuan dan aplikasinya dalam kehidupan sehari-hari.