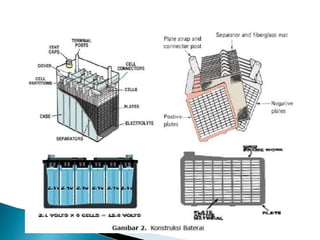
Dokumen ini menjelaskan tentang struktur dan fungsi baterai, termasuk proses pengisian dan pengosongan serta klasifikasi baterai menjadi primer dan sekunder. Baterai berfungsi sebagai sumber energi listrik pada kendaraan dan terdiri dari sel, elektrolit, dan elektroda dengan berbagai kapasitas yang diukur dalam ampere hour. Prosedur pengujian dan pemeliharaan baterai juga dibahas untuk memastikan kinerja optimal.