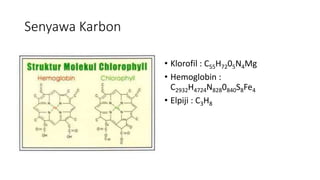
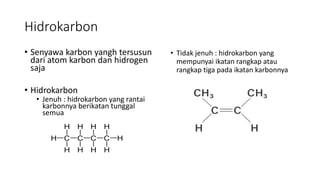
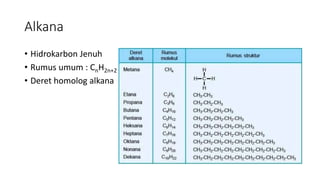
Dokumen tersebut membahas tentang hidrokarbon, yaitu senyawa karbon yang terdiri dari atom karbon dan hidrogen. Juga membahas tentang alkana, alkena, dan alkuna sebagai jenis hidrokarbon jenuh dan tidak jenuh serta sifat dan manfaatnya. Selain itu, dibahas juga tentang proses pengolahan minyak bumi dan mutu bahan bakar minyak.