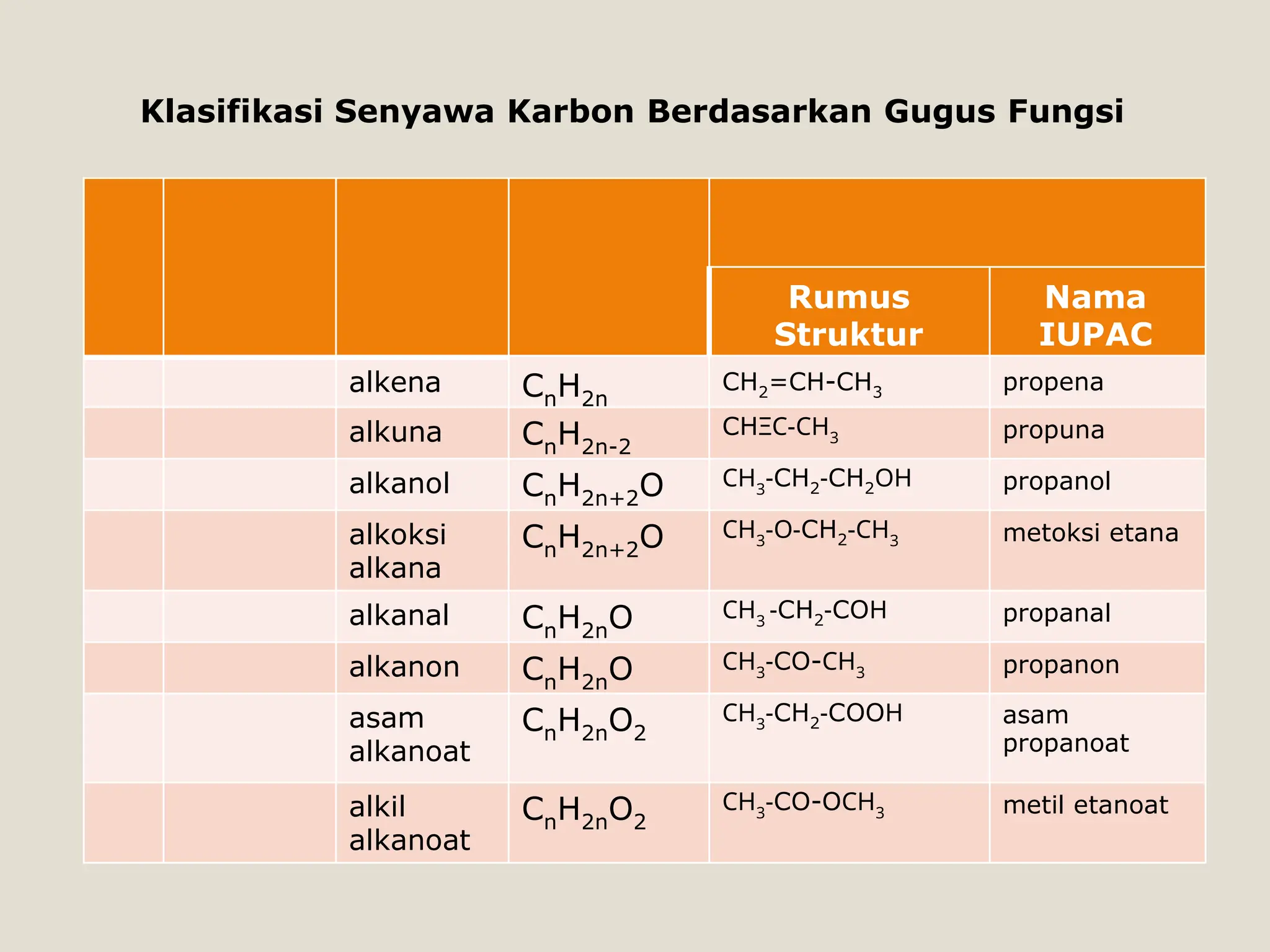
Dokumen ini membahas senyawa organik seperti alkohol dan eter, termasuk definisi, karakteristik, serta pemisahan berdasarkan gugus fungsi dan struktur. Terdapat penjelasan mengenai tata nama, isomer, serta sifat fisika dan kimia masing-masing senyawa. Selain itu, dokumen ini juga menyoroti reaksi dan kegunaan alkohol dan eter dalam kehidupan sehari-hari.











![2. Pembentukan Ester (Esterifikasi)
Alkohol dengan asam karboksilat dapat membentuk ester, reaksi
ini dinamakan esterifikasi. Reaksi umumnya:
R-CO-OH + HO-R’ ⇄ R-CO-O-R’ + H2O
asam karboksilat alkohol ester
Ex: CH3COOH + CH3CH2OH ⇄ CH3COOCH2CH3
asam asetat etanol etil asetat
3. Reaksi Membedakan Alkohol Primer, Sekunder, dan Tersier
Alkohol primer dapat dioksidasi mula-mula akan menjadi aldehid. Aldehida yang
dihasilkan siap menjadi asam karboksilat. Jadi, oksidasi alkohol primer dengan
zat oksidator kuat akan menghasilkan asam karboksilat.
Alkohol sekunder dapat dioksidasi menjadi keton saja.
Alkohol tersier tidak dapat mengalami oksidasi.
[O]
1o
: R-CH2-OH → R–CO-H → R-CO-OH
Kehilangan
2H
PCC
Aldehida Kehilangan 2H
CrO3, H2SO4
Ex: CH3(CH2)5CH2OH → CH3(CH2)5COH → CH3(CH2)5CO-OH
1-heptanol
CH2Cl2
1-heptanal
panas
Asam heptanoat](https://image.slidesharecdn.com/4a-senyawa-alkohol-eter-240901131304-8afc105d/75/4a-penjelasan-senyawa-alkohol-eter-docx-13-2048.jpg)



