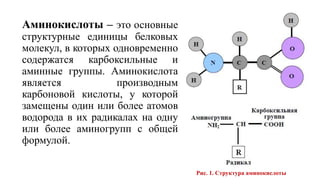
Документ представляет лекцию по биотехнологии первичных метаболитов, где обсуждаются методы получения аминокислот и их биосинтетические пути. Описываются классификации аминокислот по их незаменимости, выделяются основные микробные штаммы-продуценты и методы их применения в промышленности для синтеза аминокислот. Также рассматриваются особенности биотехнологического получения аминокислот с акцентом на ферментацию и микроорганизмы, используемые в этих процессах.