PROTEINAK 2_ENTZIMAK.ppt
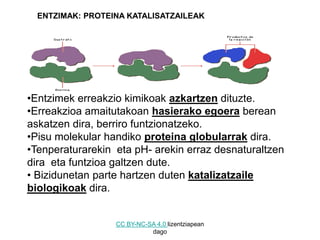
- 1. ENTZIMAK: PROTEINA KATALISATZAILEAK •Entzimek erreakzio kimikoak azkartzen dituzte. •Erreakzioa amaitutakoan hasierako egoera berean askatzen dira, berriro funtzionatzeko. •Pisu molekular handiko proteina globularrak dira. •Tenperaturarekin eta pH- arekin erraz desnaturaltzen dira eta funtzioa galtzen dute. • Bizidunetan parte hartzen duten katalizatzaile biologikoak dira. CC BY-NC-SA 4.0 lizentziapean dago
- 2. Entzimen jarduera- mekanismoa. E + S E-S P + E •Entzimak aktibazio energia murrizten du eta horrela erreakzio abiadura handitu egiten da, oreka aldatu gabe. •Gune aktiboa: Entzima substratoarekin lotzen den gunea (aminoazido gutxi batzuk soilik osatzen dutena). •Entzima bakoitza espezifikoa da, substratuarekiko edo erreakzio motarekiko eta hori entzimaren egitura tertziarioaren ondorioa da, bere gune aktiboaren araberakoa. •Molekula bera zenbait entzimen substratua izan daiteke CC BY-NC-SA 4.0 lizentziapean dago
- 3. Katalisia EA katalizatzaile gabe Energia Erreakzio koordenatuak erreaktiboak produktuak EA katalizatzailearekin CC BY-NC-SA 4.0 lizentziapean dago
- 4. Modelo honek entzimak aktibazio energia nola murrizten duen azaltzen du Entzima Substratua Produktua 1) Erreakzioa bere kasa gertatzeko, aktibazio-energia behar da. 2) Entzimak erreakzioaren aktibazio-energia murriztu edo deusezten du. CC BY-NC-SA 4.0 lizentziapean dago
- 5. Entzimarik gabe Erreakzio kimiko bati energia eman behar diogu gerta dadin CC BY-NC-SA 4.0 lizentziapean dago
- 6. Entzimarekin Entzimek aktibazio-energia gutxitzen dute erreakzioa errezagoa izateko CC BY-NC-SA 4.0 lizentziapean dago
- 7. ETZIMEN SAILKAPENA Entzimen izendatzea. Entzimak izendatzeko lehenik substratuaren izena jartzen da eta ondoren katalizatzen duen erreakzio motarena-asaz bukatua. Adibidez: sakarosa hidrolasa edo glizeraldehido 3-P deshidrogenasa. Hala ere, askotan, entzimen izena sinplifikatu egiten da eta horrela sakarosa hidrolizatzen duen entzimari sakarasa deritzo eta berdin amilasa , alfa 14 glukosidasa, zelulasa..e.a Batzutan aintzinako izenak ere erabiltzen dira: tripsina, pepsina..e.a CC BY-NC-SA 4.0 lizentziapean dago
- 8. ENTZIMA MOTAK 1-Oxidorreduktasak: elektroien transferentziak 2-Transferasak: talde funtzional baten transferentziak 3-Hidrolasak: Uraren bidezko apurketak 4-Liasak: Lotura bikoitzen apurketak urik gabe 5-Isomerasak: Isomero batetik bestera pasatzea 6-Ligasak: Sintesi erreakzioetan ATP molekularekin CC BY-NC-SA 4.0 lizentziapean dago
- 9. ENTZIMAREN EGITURA: Proteina globularra da eta substratuarekin GUNE AKTIBOAn lotzen da. Gune aktiboa substratuarekin elkartzen den entzimaren zatia ,aminoazido batzuk osatzen dute,. CC BY-NC-SA 4.0 lizentziapean dago
- 10. Gune aktiboa CC BY-NC-SA 4.0 lizentziapean dago
- 11. Entzimen espezifikotasunaren ereduak Sarraila eta giltza (Fisher, 1894): Gune aktiboa eta substratoa bat datoz erabat: Osagarriak dira Doitze induzitua: (Koshland,1958) Substratoarekin elkartzean gune aktiboan aldaketa bat induzitzen da, bien arteko osagarritasuna handitzen duena CC BY-NC-SA 4.0 lizentziapean dago
- 12. Molekula bera zenbait entzima ezberdinen substratua izan daiteke, erreakzio ezberdinetan eraldatuko direlako, produktu ezberdinak emanez. CC BY-NC-SA 4.0 lizentziapean dago
- 13. KOFAKTOREAK ETA KOENTZIMAK • Entzimak proteinak dira eta gehienak HOLOPROTEINAK dira, hots, zati proteikoa edo APOENTZIMA eta zati ez-proteikoa edo KOFAKTOREA izan behar dute funtzionalak izateko. APOENTZIMA + KOFAKTOREA HOLOENTZIMA CC BY-NC-SA 4.0 lizentziapean dago
- 14. Kofaktorea (entzima ez bezala) bai eraldatzen da erreakzioan e- -ak hartuz edo emanez adibidez; horrela entzimak ez bezala agortu edo “gastatzen” dira. Bi eratakoa izan daiteke: EZ-ORGANIKOA: • Ioi metalikoak: Fe, Cu, Mg, Mn, Zn, Ca, Co. ORGANIKOAK: • Koentzima: Molekula organiko ez-proteikoa. Lotura ahulen bidez lotzen dira apoentzimari Asko bitaminen eratorriak (CoA, NAD, NADP, FMN, FAD, e.a.) • Talde prostetikoa: Lotura kobalenteen bidez apoentzimari lotzen zaizkion molekula organikoak dira, adibidez hemo taldea. CC BY-NC-SA 4.0 lizentziapean dago
- 15. Apoentzima+kofaktoreaholoentzima Talde prostetikoa Koentzima CC BY-NC-SA 4.0 lizentziapean dago
- 16. Jarduera entzimatikoan eragina duten faktoreak • Entzima-kontzentrazioa. • Substratu kontzentrazioa. • Tenperatura. • pH. • Inhibitzaileak. CC BY-NC-SA 4.0 lizentziapean dago
- 17. Entzima-kontzentrazioa • Substratoa soberan dagoenean, zenbat eta entzima gehiago orduan eta jarduera entzimatiko handiagoa. Beraz, zelulak jarduera entzimatikoa handitu edo txikiagotu behar badu, entzimaren sintesia eragingo du edo blokeatuko du hurrenez hurren. Entzima gehienak behar direnean soilik sintetizatzen dira, edo forma inaktiboan (apoentzima gisa) daude. Bestetik azkar degradatu ohi dira. CC BY-NC-SA 4.0 lizentziapean dago
- 18. Substratu kontzentrazioa • Entzima-kontzentrazioa konstante batean, substrato-kontzentrazioa handituz gero, erreakzio abiadura handitzen da maximo batera heldu arte. Orduan, entzima guztiak substratei lotuta daude eta erreakzioa burutu arte entzima ez da askatuko beste substrato bati lotzeko CC BY-NC-SA 4.0 lizentziapean dago
- 19. Tenperatura • Entzima guztiek jarduerarako tenperatura optimo bat izaten dute, eta hau organismoaren tenperatura fisiologikoaren ingurukoa da. • 10ºC-ko igoera bakoitzeko abiadura bikoiztu ohi da, 40ºC ingurura heldu arte, hortik aurrera entzimak desnaturalizatzen direlako Aktibitatea CC BY-NC-SA 4.0 lizentziapean dago
- 20. pH-a • pH-ak proteinaren konformazioan eragina duenez, bere jardueran ere eragina du. • Entzimek pH optimo bat dute (ez denek berdina) eta balio horretatik gora edo behera proteina desnaturaliza daiteke eta jardueran gelditu Pepsina (urdailan) Kimiotripsina (heste-meharrean) CC BY-NC-SA 4.0 lizentziapean dago
- 21. Jarduera entzimatikoan eragina duten faktoreak CC BY-NC-SA 4.0 lizentziapean dago
- 22. Jarduera entzimatikoaren inhibizioa • Inhibitzaileak, entzima baten aktibitatea murrizten edo eteten duten substantziak dira. • Garrantzitsuak dira, beraien bidez bizidunetan ematen diren erreakzio metabolikoak kontrolatzen direlako. Batzutan gaixotasunak sendatzeko erabiltzen dira, adibidez, inhibitzaile batzuk, gaitzak sortzen dituzten bakterioen erreakzioak eteten dituzte. • Beste batzuk ordea arma biologiko bezala erabiliak izan dira. Adib, “gas nerbiosoa” honek, nerbio kinada garraiatzeko behar den entzima inhibitzen du, heriotza eraginez. CC BY-NC-SA 4.0 lizentziapean dago
- 23. Jarduera entzimatikoaren inhibizioa • Inhibizioa 2 motatakoa: itzulgarria eta itzulezina. • Itzulgarria: – Lehiakorra – Ez lehiakorra • Itzulezina: Substantzia batzuk entzimaren talde funtzionalak aldatu egiten dituzte, gune aktiboa aldatuz, eta inhibizioa behin- betikoa da. Lehen aipaturiko gas nerbiosoarena edo insektizidena adibidez. CC BY-NC-SA 4.0 lizentziapean dago
- 24. Inhibizio lehiakorra • Inhibitzaileak substratuaren forma antzekoa du eta gune aktiboa aldi baterako okupatzen du, substratuarekin lehiatuz. Substratuaren kantitatea handituz konpondu daiteke.Horregatik da itzulgarria. CC BY-NC-SA 4.0 lizentziapean dago
- 25. Inhibizio ez lehiakorra • Inhibitzailea,entzimari gune aktiboa ez den beste leku batean lotzen zaio, gune alosterikoan,hain zuzen ere, inhibizio alosterikoa edo erregulatzailea deritzo honi. • Honek entzimaren egitura piska bat aldatu egiten du, E-S lotura zailduz edo eragotziz. CC BY-NC-SA 4.0 lizentziapean dago
- 26. INHIBIZIO EZ LEHIAKORRA CC BY-NC-SA 4.0 lizentziapean dago
- 27. Entzima alosterikoak • Inhibizio ez lehiakorraren barruan entzima alosterikoen kasua aipatu behar da. Hauek metabolismoa kontrolatzen dute gune aktiboa inhibituz, egoeraren arabera. Esate baterako erreakzio segida (bide metaboliko) batean, azken produktu nahikoa badago, produktu horrek inhibitu dezake segida horretako lehen entzima edo erreakzio-segidako adarkadura garrantzitsuak: erretroelikadura bidezko inhibizioa edo feed-back inhibizioa CC BY-NC-SA 4.0 lizentziapean dago
- 28. CC BY-NC-SA 4.0 lizentziapean dago
- 29. Elkarrekintza alosterikoa • Entzimak aldi baterako aktibatu edo inaktiba daitezke • Ekintza entzimatiko ez-lehiakorra eta itzulkorra izan ohi da • Bi lotura-gune ditu: gune aktiboa eta gune erregulatzailea non efektore alosterikoa lotuko den. CC BY-NC-SA 4.0 lizentziapean dago
- 30. Efektore alosteriko inhibitzailea CC BY-NC-SA 4.0 lizentziapean dago
- 31. Efektore alosteriko aktibatzailea CC BY-NC-SA 4.0 lizentziapean dago
- 32. Enzima inactiva substratua Entzima produktuak koentzima Gune aktiboa Ekintza entzimatikoa: 1) Entzima-substratu konplexua eratzen da. 2) Koentzima konplexu honekin elkartzen da. 3) Gune aktiboan dauden aminoazidoek katalizatzen dute erreakzioa. Horretarako erreakzionatu behar duten molekulak hurbilaraziko dituzte elkarrekin errazago erreakzionatuz eta aktibazio energia murriztuz. 4) Produktua askatzen da eta entzima ere bai, baina aldaketarik izan gabe. 5) Koentzimak prozesuan parte hartzen dute energía (ATP-a), elektroiak (NADH/NADPH) edo katalisi entzimatikoan erlazionatutako beste funtzioren batean. CC BY-NC-SA 4.0 lizentziapean dago
- 33. Inhibidore alosterikoak gune alosterikoan elkartzen dira entzimara eta gune aktiboaren forma aldatzen dute substratua elkartzea eragotziz. substratua Inhibitzailea Enzima inactiva Entzima aktiboa Inhibizio alosterikoa Inhibitzailerik gabe Inhibitzailearekin CC BY-NC-SA 4.0 lizentziapean dago