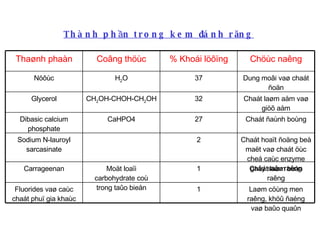
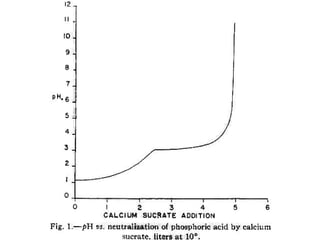
DCPD (dicalcium phosphate dihydrate) là một hợp chất được sử dụng trong kem đánh răng nhờ khả năng làm sạch và đánh bóng răng. Quá trình sản xuất DCPD phụ thuộc vào nhiệt độ và nồng độ các thành phần phản ứng, điều này ảnh hưởng đến hiệu suất hình thành DCPD. Các phân tích cũng chỉ ra rằng sản phẩm thu được phải đảm bảo chất lượng và độ tinh khiết ngăn ngừa sự hiện diện của các tạp chất kim loại nặng.












![Caùc nhaän xeùt : - Khi pH=pKa, noàng ñoä cuûa hai daïng acid vaø base lieân hôïp töông öùng vôùi pKa ñoù seõ baèng nhau. Khi pH=pKa-n, [acid]=10 n [base lieân hôïp vôùi acid] (n coù theå aâm hoaëc döông). - Theo quy öôùc khi noàng ñoä cuûa daïng naøy cheânh leäch hôn 100 laàn so vôùi noàng ñoä cuûa daïng kia thì coù theå xem nhö söï toàn taïi cuûa daïng coù noàng ñoä nhoû hôn laø khoâng ñaùng keå](https://image.slidesharecdn.com/semiar-d-c-p-d-1206439360927434-5/85/Semiar-D-C-P-D-15-320.jpg)






