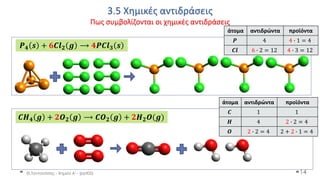
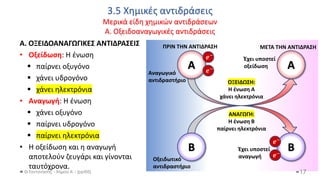
This document discusses various types of oxides, including their definitions, naming conventions, and classifications. It describes some common oxides that have importance in everyday life, such as carbon dioxide, sulfur dioxide, nitrogen oxides, and carbon monoxide. It also discusses how acidic oxides are derived from acids by removing water, and how basic oxides are derived from bases in the same way. Oxides can be classified as acidic, basic, or amphoteric depending on their chemical behavior.