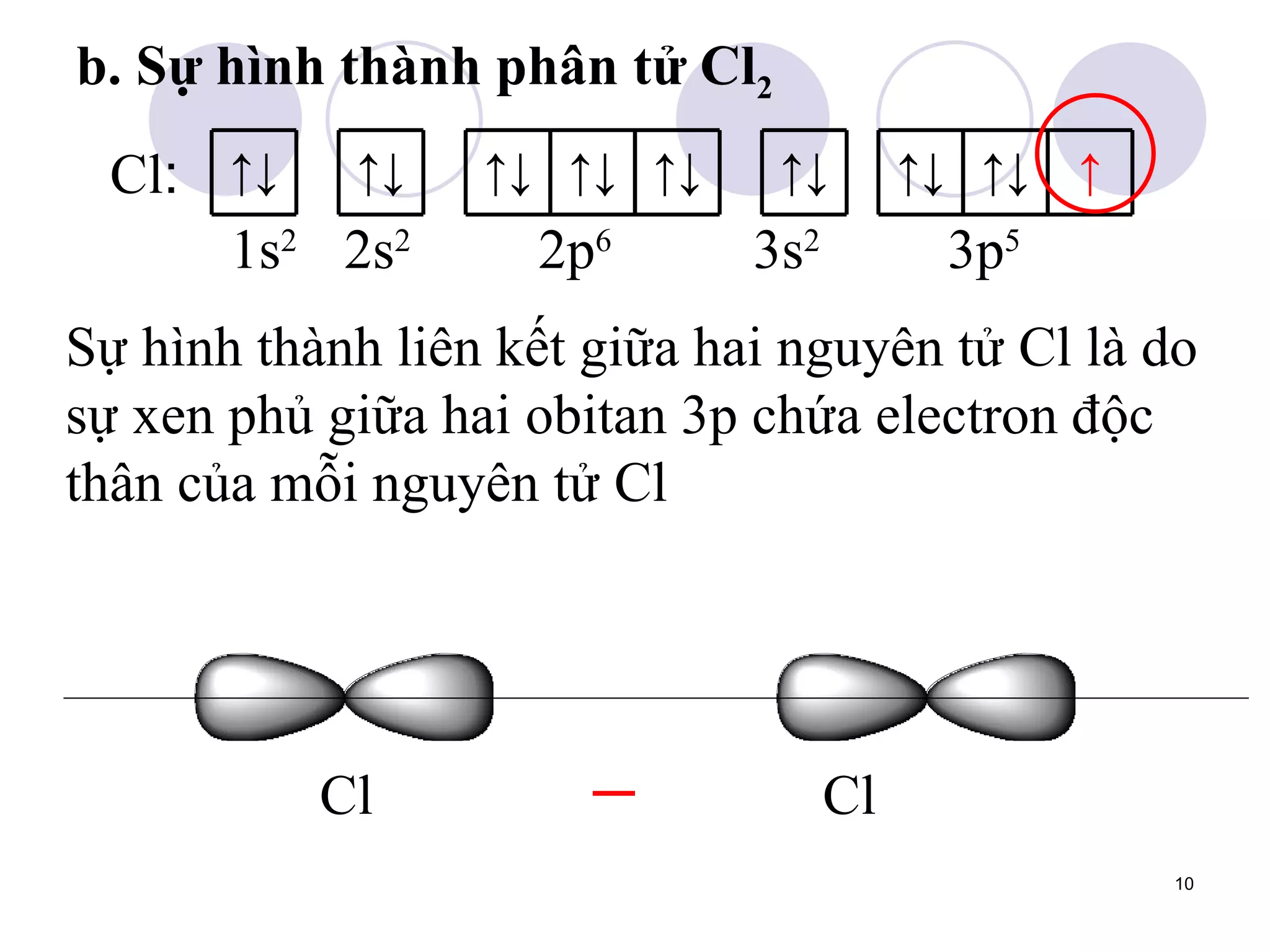
Tài liệu trình bày về liên kết cộng hóa trị, bao gồm sự hình thành liên kết bằng cặp electron chung trong các phân tử đơn chất và hợp chất. Liên kết có thể không cực hoặc cực, tùy thuộc vào sự phân bố điện tích trong phân tử. Tài liệu cũng đề cập đến cách xen phủ obitan nguyên tử trong quá trình hình thành các liên kết hóa học.




![2. Sự hình thành phân tử hợp chất: a. Sự hình thành phân tử HCl H (Z = 1): 1s 1 Cl (Z=17): [Ne] 3s 2 3p 5 H Cl H Cl + H Cl H Cl Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực. - + H =2,2 Cl =3,16](https://image.slidesharecdn.com/lienketcht-111116093411-phpapp01/75/Lien-ket-cht-5-2048.jpg)

![c. Liên kết cho nhận S (Z=16): [Ne] 3s 2 3p 4 O (Z=8): 1s 2 2s 2 2p 4 O O S S O O S O Chú ý : trong trường hợp, cặp electron chung chỉ do một nguyên tử đòng góp thì liên kết giữa hai nguyên tử được gọi là liên kết cho - nhận .](https://image.slidesharecdn.com/lienketcht-111116093411-phpapp01/75/Lien-ket-cht-7-2048.jpg)