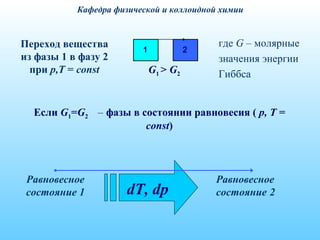
Лекция посвящена основному закону фазового равновесия, диаграммам состояния однокомпонентных систем и уравнению Клапейрона-Клаузиуса. Рассматриваются основные понятия, правило фаз Гиббса и фазовые превращения веществ, сопровождающиеся изменением температуры и давления. У Lecturing विवरण वे फेज़ संतुलन, गैसों के व्यवहार, और अन्य विषयों का उपयोग करते हुए पूरे विषय का अवलोकन करते हैं।










![При протекании химических реакций
К = к – х,
где К – число независимых
компонентов системы
к – число составных частей системы
х – число уравнений, связывающих
концентрации этих компонентов в
равновесной системе.
СаСО3 (тв) СаО (тв) + СО2 (г)
[СО2] = Кр
К = 3 – 1 = 2
Кафедра физической и коллоидной химии](https://image.slidesharecdn.com/i-180105094715/85/I-11-320.jpg)