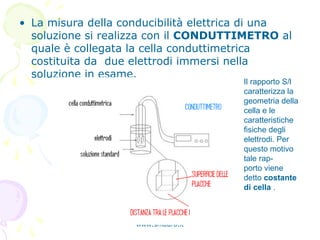
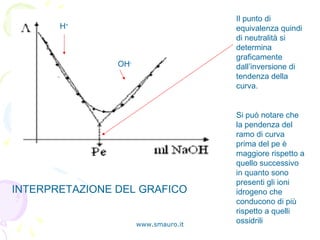
Il documento tratta la conduttimetria, una tecnica che misura la conducibilità elettrica degli ioni in soluzione, evidenziando i prerequisiti e le leggi fondamentali della conduzione. Viene descritto l'uso del conduttimetro e come effettuare titolazioni conduttimetriche, con particolare attenzione alla determinazione del punto di equivalenza in una titolazione tra HCl e NaOH. Vengono inoltre discussi i fattori che influenzano la conduttività e le caratteristiche della cella conduttimetrica.