Лекция посвящена процессам адсорбции, их медико-биологическому значению и важным понятиям, связанным с этим процессом, включая сорбенты, сорбтивы и поверхностное натяжение. Рассматриваются принципы адсорбции, влияющие факторы, такие как размеры поверхности адсорбента, температура, и тип сорбента, а также уравнения Фрейндлиха и Ленгмюра. В заключение отмечается значение адсорбции в хроматографии и детоксикации организма.




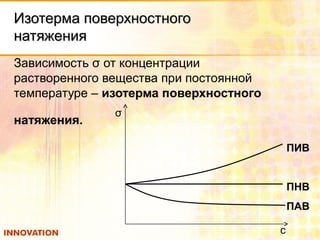
![Поверхностное натяжениеПоверхностное натяжение
Поверхностное натяжение (σ) равно работе,
которую нужно совершить для создания
единицы поверхности [Дж/м2
].
Поверхностное натяжение зависит от:
природы жидкости
σ(Н2О)=72,8 Дж/м2
; σ(сыворотки крови)=45,4 Дж/м2
).
температуры (↑t ↓σ , при tкип σ =0).
давления (↑p ↓σ ).
концентрации растворенного вещества.](https://image.slidesharecdn.com/58807-130919063404-phpapp02/85/58807-5-320.jpg)



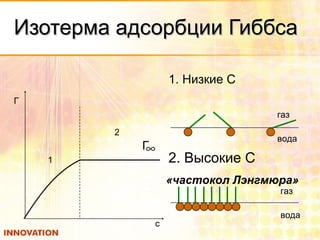
![Уравнение ГиббсаУравнение Гиббса
>0 Г < 0, т.е. ↑с ↑σ (ПИВ)
С вещества в поверхностном слое < С вещества в
объёме фазы
<0 Г > 0, т.е. ↑с ↓σ (ПАВ)
С вещества в поверхностном слое > С вещества в
объёме фазы
RT
C
c
à ⋅
∆
∆
−=
σ
c∆
∆σ
c∆
∆σ
c∆
∆σ
Г - количество адсорбированного вещества [моль/мГ - количество адсорбированного вещества [моль/м22
]]
С - молярная концентрация раствора [моль/л]С - молярная концентрация раствора [моль/л]
R - универсальная газовая постоянная = 8,31 Дж/моль.град(К)R - универсальная газовая постоянная = 8,31 Дж/моль.град(К)
- поверхностная активность растворенного вещества.- поверхностная активность растворенного вещества.](https://image.slidesharecdn.com/58807-130919063404-phpapp02/85/58807-11-320.jpg)