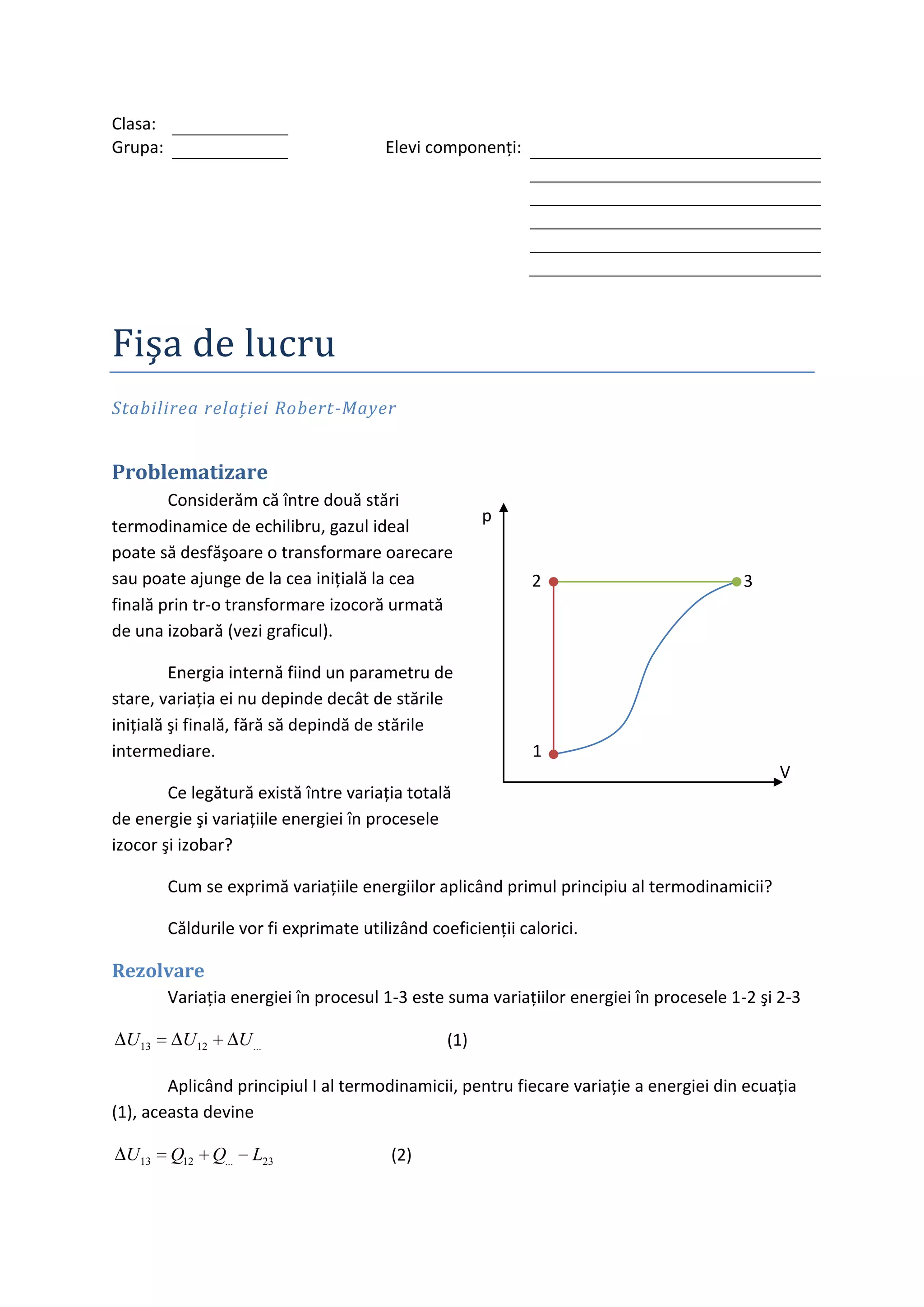
Documentul analizează relația Robert-Mayer în termodinamică, care descrie legătura dintre capabilitățile calorice ale gazelor ideale. Se explică modul în care variațiile energiei pentru procesele izocore și izobare contribuie la variația totală a energiei între două stări de echilibru. Relația finală arată că cp - cv = r pentru un mol de gaz ideal.