More Related Content
PDF
PDF
สารและการจำแนก (Matter and Substance) PDF
PDF
เรื่องสารรอบตัว ครูเจริญ มีเหมือน PDF
3.เปลี่ยนแปลงสารgs เปลี่ยนแข็งกับเปลี่ยนเหลว PDF
เคมีพื้นบท1ธาคุและสารประกอบ PDF
PPTX
Similar to 1. สารและการเปลี่ยนแปลง.pptkjytydrtseraezsdxgfxf
PPTX
PPTX
PPT
สมบัติของสารและการจำแนกสาร PPTX
PPT
PPTX
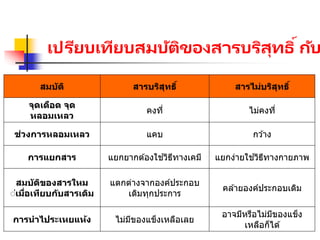
สมบัติสารบริสุทธิ์และสารผสม ชั้นม.1.pptx PPT
PPT
PPTX
PDF
PDF
PPT
PDF
PDF
PDF
PDF
PDF
PDF
PDF
PPT
1. สารและการเปลี่ยนแปลง.pptkjytydrtseraezsdxgfxf
- 2.
- 3.
- 4.
- 5.
- 6.
- 7.
- 8.
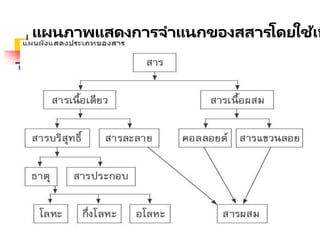
การจัดจาแนกสาร
ส า รใน ท า ง เ ค มี จ า แ น ก
หมวดหมู่ได้เป็ นหลายประเภท ขึ้นอยู่กับ
ว่าจะใช้หลักเกณฑ์ใดมาเป็ นแนวทางใน
การพิจารณา
เช่น
- ถ้าใช้สถานะเป็ นเกณฑ์
- การนาไฟฟ
้ าเป็ นเกณฑ์
- เนื้อสารเป็ นเกณฑ์
- 9.
- 10.
สารเนื้อเดียว (Homogeneous subs
คือส า ร ที่มีอ ง ค์ป ร ะ ก อ บ
ภายในเหมือนกัน มองเห็นเป็ นเนื้อ
เดียวกัน แบ่งออกได้เป็ น สาร
บริสุทธิ์ สารละลาย ตัวอย่างเช่น
น้า น้าเกลือ สารหนู เป็ นต้น
- 11.
- 12.
- 13.
- 14.
คอลลอยด์
ค อ ลล อ ย ด์ เ ป็ น ข อ ง ผ ส ม ที่
ประกอบด้วยอนุภาคที่มี
ขนาดเส้นผ่านศูนย์กลาง 10-7เชนติ
เมตร ถึง 10-4 เซนติเมตร โดยกระจาย
อยู่ในสารอีกชนิดหนึ่งที่เป็ นตัวกลาง
ตัวอย่าง เช่น น้านม น้าสลัด น้าแป้ งสุก
หมอก ควันไฟ เป็ นต้น
- 15.
สมบัติสาคัญของคอลลอยด์
1. สามารถ กระเจิงแสงได้เรียกปรากฏการณ์นี้
ว่า ปรากฎการณ์ทินดอลล์
2. คอลลอยด์ไม่ตกตะกอน
3. เส้นผ่านศูนย์กลางยาว 10-7 เซนติเมตร ถึง
10-4 เซนติเมตร
4.เมื่อส่องดูด้วยเครื่องมือ ที่เรียกว่า อัลตราไม
โครสโคป(Ultramicroscope) จะพบว่าอนุภาค
มีการเคลื่อนที่ แบบบราวเนียน (Brownion
Movement) คือ เคลื่อนที่เป็ นเส้นตรง ไม่มี
- 16.
- 17.
- 18.
- 19.
- 20.
- 21.
- 22.
1. ดูสถานะ
ถ้าสาร 2ชนิดที่มีสถานะต่างกันมา
ละลายซึ่งกันและกัน
ให้ถือว่าสารที่มีสถานะเดียวกับ
สารละลายเป็ นตัวทาละลาย
สารอื่นที่เหลือเป็ นตัวถูกละลาย
- 23.
- 24.
- 26.
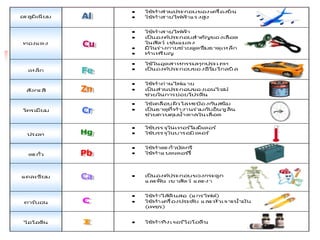
ธาตุ
ธ า ตุห ม า ย ถึ ง ส า ร
บริสุทธิ์ที่ประกอบด้วยอะตอม
เพียงชนิดเดียว ได้แก่ ธาตุ
ทุกตัวในตารางธาตุ
- 27.
- 28.
- 29.
- 30.
- 31.
- 32.
- 33.
- 34.
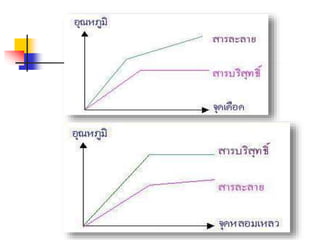
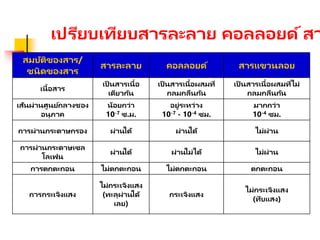
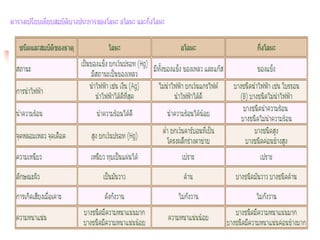
เปรียบเทียบสารละลาย คอลลอยด์สา
สมบัติของสาร/
ชนิดของสาร
สารละลาย คอลลอยด์สารแขวนลอย
เนื้อสาร
เป็ นสารเนื้อ
เดียวกัน
เป็ นสารเนื้อผสมที่
กลมกลืนกัน
เป็ นสารเนื้อผสมที่ไม่
กลมกลืนกัน
เส้นผ่านศูนย์กลางชอง
อนุภาค
น้อยกว่า
10-7 ซ.ม.
อยู่ระหว่าง
10-7 - 10-4 ซม.
มากกว่า
10-4 ซม.
การผ่านกระดาษกรอง ผ่านได้ ผ่านได้ ไม่ผ่าน
การผ่านกระดาษเซล
โลเฟน
ผ่านได้ ผ่านไม่ได้ ไม่ผ่าน
การตกตะกอน ไม่ตกตะกอน ไม่ตกตะกอน ตกตะกอน
การกระเจิงแสง
ไม่กระเจิงแสง
(ทะลุผ่านได้
เลย)
กระเจิงแสง
ไม่กระเจิงแสง
(ทึบแสง)
- 35.
- 36.
สรุป
1. การดูว่าเป็ นสารเนื้อเดียวหรือเนื้อผสม
ให้ใช้พิจารณาด้วยตาเลยแต่ถ้าดูไม่ออกค่อยใช้
วิธีอื่น เช่นกระดาษกรอง
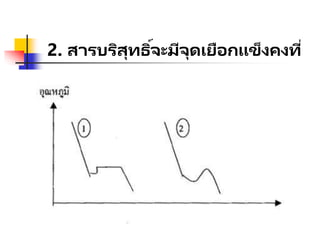
2. สารบริสุทธิ์กับสารละลายใช้การหาจุด
เดือดเป็ นหลักในการตัดสิน
3. ระเหยแล้วเหลือของแข็งอยู่ สรุปได้
ทันทีว่าไม่บริสุทธิ์แต่ถ้าไม่เหลืออะไรเลยต้อง
ตอบว่าสรุปไม่ได้
4. ทดสอบคอลลอยด์ใช้การกระเจิงแสง
เป็ นหลัก
5. ธาตุกับสารประกอบ ทดสอบโดยนาไป
เผาถ้าได้สารใหม่ออกมาก็สรุปเลยว่าเป็ น
- 37.
- 38.
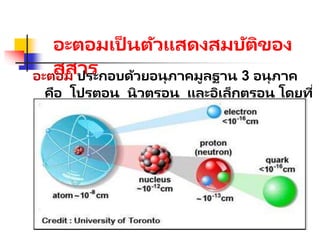
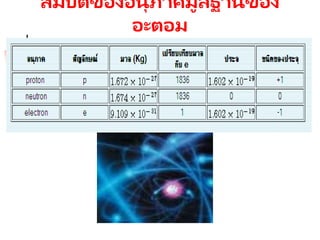
โปรตอน มีมวล 1.673x
10-24 g
มีประจุไฟฟ
้ า
+6.75 x 10-19 C
นิวตรอน มีมวล 1.675 x
10-24 g
ไม่มีประจุไฟฟ
้ า
- 39.
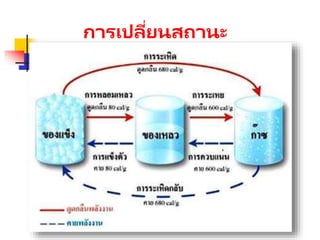
สสารแบ่งออกเป็ น 3ชนิด คือ
ของแข็ง
อะตอมภายในของแข็งถูกยึดแน่นอยู่กับที่
แต่สามารถสั่นไปมารอบๆตาแหน่งของ
อะตอมนั้นๆ
ของเหลว
แรงยึดเหนี่ยวระหว่างอะตอมน้อยลง มี
อิสระในการเคลื่อนที่มากขึ้น สามารถ
ไหลได้
ก๊าซ
แรงยึดเหนี่ยวระหว่างอะตอมมีน้อยมาก
จนแทบไม่มี ทาให้แต่ละอะตอมเคลื่อนที่
ได้อย่างอิสระอย่างสมบูรณ์
- 40.
- 41.
- 42.
สารบริสุทธิ์
แบ่งเป็ น 2ประเภท ได้แก่
สารประกอบและธาตุ
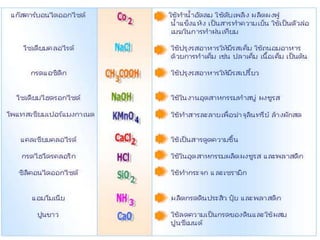
1. สารประกอบ ประกอบด้วยธาตุตั้งแต่ 2 ชนิด
ขึ้นไปรวมตัวกัน
อัตราส่วนที่คงที่ เช่น น้า (H2O)
H2O H : O เป็ น 2:1 เสมอ
มีสมบัติต่างจากธาตุที่เป็ นองค์ประกอบอย่าง
สิ้นเชิง
เช่น O แก๊สช่วยให้ไฟติด
H เป็ นแก๊สติดไฟ
- 43.
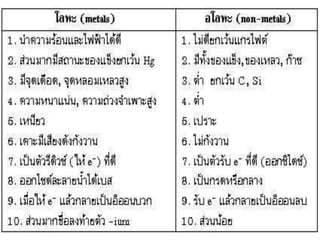
2. ธาตุ ประกอบด้วยอะตอมเพียงชนิดเดียวและ
ไม่สามารถแยกเป็นองค์ประกอบย่อยโดยวิธีการ
ทางเคมีได ้ แบ่งเป็น 3 ประเภท ได ้แก่
โลหะ อโลหะ กึ่ง
โลหะ
เช่น ทองคา เช่น คาร ์บอน
เช่น พลวง
- 44.
อะตอมและโมเลกุล
อะตอม คืออนุภาคที่เล็กที่สุดของธาตุ
อะตอมมักรวมตัวกันเป็นโมเลกุล
โมเลกุล แบ่งเป็ น 2 ประเภท
1. โมเลกุลของธาตุ เกิดจากการรวมกันของ
ธาตุชนิดเดียวกัน 2 อะตอมขึ้นไป เช่น O2
Cl2
2. โมเลกุลสารประกอบ เกิดจากการรวมกัน
ของธาตุต่างชนิดกัน เช่น NaCl CO2
- 45.
- 46.
- 47.
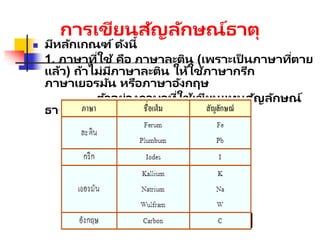
2. ใช้อักษรตัวแรกเป็ นตัวพิมพ์ใหญ่ตัวอักษรตัว
ถัดไปเป็ นตัวพิมพ์เล็ก
เช่น Ca (แคลเซียม)
Cl (คลอรีน)
Cr (โครเมียม)
Cu (คอปเปอร ์)
ธาตุบางชนิดมีสมบัติบางประการที่คล้ายกัน
นักวิทยาศาสตร ์จึงจัดธาตุเป็ นหมวดหมู่ใน
รูปแบบที่เรียกว่า ตารางธาตุ (periodic table)
มีหมู่ 1A (แถวแนวตั้ง) 8 หมู่
มีคาบ (แถวแนวนอน) 7 คาบ
- 49.
- 51.
- 52.
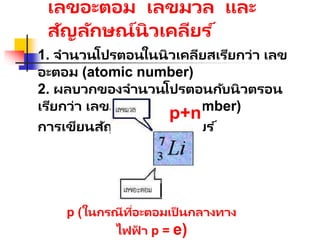
เลขอะตอม เลขมวล และ
สัญลักษณ์นิวเคลียร์
1. จานวนโปรตอนในนิวเคลียสเรียกว่า เลข
อะตอม (atomic number)
2. ผลบวกของจานวนโปรตอนกับนิวตรอน
เรียกว่า เลขมวล (mass number)
การเขียนสัญลักษณ์นิวเคลียร ์
p+n
p (ในกรณีที่อะตอมเป็ นกลางทาง
ไฟฟ
้ า p = e)
- 53.
- 54.
ตัวอย่างที่ 2การหาอนุภาคมูลฐานของอะตอม
จากสัญลักษณ์นิวเคลียร์
มีจานวนโปรตอน = 20 อนุภาค
แคลเซียม +2 หมายถึง เสียอิเล็กตรอน
ไป 2 อนุภาค
อิเล็กตรอน = 20 - 2 =
18 อนุภาค
- 55.