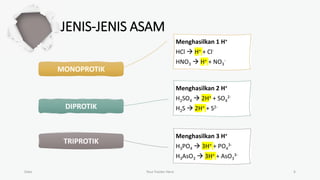
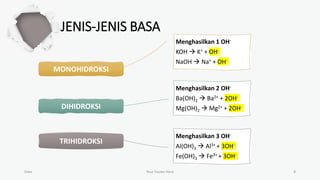
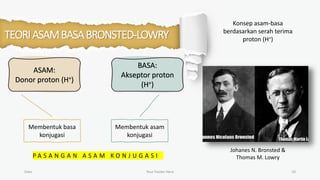
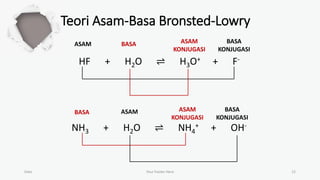
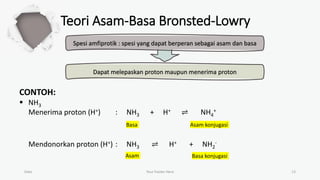
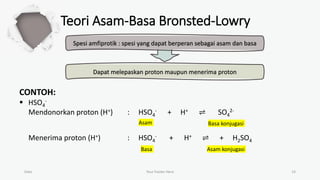
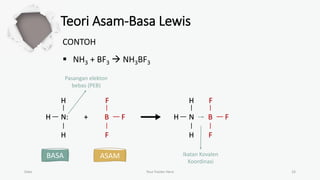
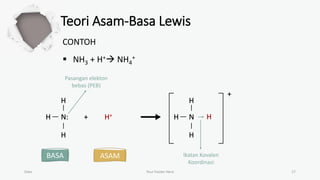
Dokumen ini membahas teori asam-basa, termasuk teori Arrhenius, Bronsted-Lowry, dan Lewis. Teori Arrhenius mengkategorikan asam dan basa berdasarkan ion yang dihasilkan dalam air, sementara Bronsted-Lowry fokus pada transfer proton. Teori Lewis menjelaskan asam dan basa berdasarkan penerimaan dan penyerahan pasangan elektron.