More Related Content
PPTX
تعیین قانون سرعت در ترکیبات معدنی PDF
آموزش ترمودینامیک ۲ بخش هفتم PPTX
به زبان فارسی اصول مهندسی صنایع غذایی.pptx PDF
Thermodynamic Termodinamika (Arabic Version) PPT
mabahesi_dar_termodinamike_tolide_ahan.ppt PPSX
PDF
PPTX
Advanced Solidification processingpart1a Similar to مهندسی واکنش های شیمیایی طراحی راکتور مقدمه
PPTX
Advanced Solidification processingpart2a PDF
Effect of Plenum reactor temperature "Reactor Plenum" on the production of pr... PDF
مجموعه آموزش های کاربرد متلب در شیمی - درس پنجم PPTX
بررسی تکنولوژی 퐂퐎_ퟐ−퐂퐚퐩퐭퐮퐫퐞 با استفاده از ممبران در نیروگاه های با سوخت گاز ط... PPTX
Aspen HYSYS-Fasl3- .تنظیم کننده گزارش گیریpptx PDF
آموزش ترمودینامیک ۲ بخش چهارم PPTX
این فایل رو برام طوری اصلاح کن که فونت ها زیبا تر و خوانا تر باشه.همچنین بشه ... PPT
ق ا ن و ن گ از ه ا ی ا ی د ه ا لتاذتااذ PPTX
PPTX
1_62q763571434791583689153762517688.pptx PDF
DOCX
Exploring the Relationship Between the Rubisco Enzyme and Carbon Dioxide with... PDF
Chapter no 1 mechanics and physics by rafi PDF
PDF
Lec 01 Introduction and Basic Concepts.pdf PPTX
entropy and thermodynamic in biology .pptx DOCX
PDF
PDF
Hydraulic simulation of oil and gas pipelines and calculation of pressure drop PPTX
sludge oil recovery by solvent extraction.pptx مهندسی واکنش های شیمیایی طراحی راکتور مقدمه
- 1.
- 2.
- 3.
- 4.
Introduction
4
واکنش سرعت
:
است غلظتو فشار ،دما به وابسته
.
با
𝑟𝑖
شودمی داده نشان
.
𝑟𝑖 = ƒ غلظت و دما و فشار
هستند وابسته یکدیگر به متغیرها این
.
می را فاز دمای و غلظت ،فشار کردن مشخص با نتیجه در
آورد دست به توان
.
برای پس
داریم متجانس هایواکنش
:
𝑟𝑖 = ƒ غلظت و دما
زیر متجانس واکنش در
:
aA + bB + … rR + sS +…
−𝑟𝐴 = 𝐾 𝑇 𝐶𝐴
𝑎
𝐶𝐵
𝑏
… → 𝑎 + 𝑏 = 𝑛
ابتدایی واکنش که صورتی در تنها و نیست استوکیومتری ضرایب با نمائی ضرایب برابری به لزومی
برابرند باهم باشد
.
aA + bB rR + sS از عبارتست اجزاء از هرکدام هایسرعت بین رابطه ،بگیریم درنظر را روبرو واکنش اگر
:
−𝑟𝐴
𝑎
=
−𝑟𝐵
𝑏
=
𝑟𝑅
𝑟
=
𝑟𝑆
𝑠
واکنش سرعت ثابت
واکنش کلی درجه
- 5.
5
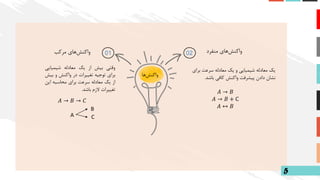
01 02
مرکب هایواکنشمنفرد هایواکنش
وقتی
بیش
از
یک
معادله
شیمیایی
برای
توجیه
تغییرات
در
واکنش
و
ب
یش
از
یک
معادله
سرعت
برای
محاسبه
ای
ن
تغییرات
الزم
باشد
.
برای سرعت معادله یک و شیمیایی معادله یک
باشد کافی واکنش پیشرفت دادن نشان
.
هاواکنش
𝐴 → 𝐵
𝐴 → 𝐵 + C
𝐴 ↔ 𝐵
𝐴 → 𝐵 → 𝐶
A
B
C
- 6.
6
منفرد هایواکنش
1
-
ابتدایی هایواکنش
(
بنیادی
:)
مبین مستقیمی یرابطه آنها در و گیرندمی صورت مرحله یک در که هستند هایواکنش
عادله
دارد وجود واکنش سرعت و شیمیایی
.
aA + bB rR + sS
𝑟𝐴 = −𝐾𝐶𝐴
𝑎
𝐶𝐵
𝑏
2
-
غیرابتدایی هایواکنش
:
ن وجود واکنش سرعت و شیمیایی معادله بین مستقیمی یرابطه هیچگونه که هنگامی
داشته
باشد
.
نمی هاواکنش از دسته این برای
نوشت باال صورت به را سرعت معادله توان
.
شیمیایی سینتیک نظر از ابتدایی هایواکنش در تعادل
A + B
است یکسان برگشت و رفت واکنش سرعت همواره تعادل حالت در
:
𝐾𝑐 =
𝐾1
𝐾2
=
𝐶𝑅𝐶𝑆
𝐶𝐴𝐶𝐵
𝐾1
𝐾2
R + S
- 7.
7
سرعت ثابت ابعادیافتن
:
سیستم در سرعت واحد
SI
:
𝑟𝐴 =
𝑚𝑜𝑙
𝑚3.𝑆
−𝑟𝐴 = 𝐾𝐶𝐴
𝑛
سرعت معادله یک در دما تابع جمله
1
-
ترمودینامیک نظر از دما به وابستگی
(
آرنیوس نظریه
)
𝑲 = 𝑲𝟎𝒆(−𝑬
𝑹𝑻)
𝑲𝟎
و
E
و ثابت همواره
E
است مثبت همواره
.
فعالیت انرژی با واکنش سرعت ثابت اگر
E
دمای در ،
T1
زمان و
t1
برابر
K1
دمای در و
T2
زمان و
t2
برابر
K2
داریم آرنیوس معادله طبق آنگاه باشد
:
҉
𝑡1
𝑡2
=
𝑘1
𝑘2
= exp
−𝐸
𝑅
1
𝑇1
−
1
𝑇2
→ 𝑘 ∝
1
𝑡
2
-
وابستگی
نظر از دما به
برخوردی تئوری
𝑲 = 𝑻
𝟏
𝟐𝒆(−𝑬
𝑹𝑻)
مول دو واکنش یک سرعت گردد واکنش محصول ایجاد به منجر یکدیگر با شوندهترکیب هایمولکول برخوردهای همه که صورتی در فوق معادله
را کولی
به
داد خواهد دست
.
باشد مقدار این از کمتر خیلی حقیقی سرعت که است طبیعی
.
𝐾 = (
𝑚𝑜𝑙
𝑚3 )1−𝑛
. 𝑆−1
برخورد ضریب
- 8.
8
𝑲 = 𝑻𝒆(−𝑬
𝑹𝑻)
استزیر فرضیات بر مبتنی تئوری این
:
الف
-
تجزیه خودبه خود جسم این سپس و کنندمی ایجاد شودمی نامیده شدهفعال پیچیده که را ناپایداری واسطه ابتدا شوندهترکیب اجسام
مح به و
صوالت
گرددمی تبدیل واکنش
.
ب
-
دارد وجود لحظات تمام در شدهفعال پیچیده و شوندهترکیب اجسام هایغلظت بین تعادلی حالت
.
҉Van 't Hoff equation
است برقرار زیر رابطه یکسان دمای در برگشت و رفت سرعت هایثابت بین ،بگیرید درنظر را روبرو پذیربرگشت واکنش
.
A
𝑘1 = 𝑘10
𝑒
−𝐸1
𝑅𝑇
𝑘2 = 𝑘20
𝑒
−𝐸2
𝑅𝑇
3
-
واسطه حالت تئوری نظر از دما وابستگی
(
گذرا
)
B
𝐾1
𝐾2
𝐾𝐶 = تعادلی ثابت =
𝑘1
𝑘2
=
𝑘10
𝑘20
𝑒
−(𝐸1−𝐸2)
𝑅𝑇
𝑙𝑛𝑘𝑐 = ln
𝑘10
𝑘20
−
∆𝐻𝑅𝑥𝑛
𝑅𝑇
→
𝑑𝑙𝑛𝑘𝑐
𝑑𝑇
=
∆𝐻𝑅𝑥𝑛
𝑅𝑇2
- 9.
9
پیچیده هایواکنش
(
ابتدایی غیر
:)
اندگردیدهتشکیل ابتدایی هایواکنش سلسله یک از انفعاالت و فعل این که کنیممی فرض ،واکنش سرعت یافتن برای هاواکنش این در
اس با و
از تفاده
آوریممی دست به را سرعت معادله پایا حالت تقریب
.
است استوار زیر اصل دو بر پایا حالت تقریب
:
1
-
سازنده که صورتی در
i
ابتدایی واکنش در سازنده آن متغیر هایسرعت مجموع با است برابر آن کلی سرعت کند دخالت مرحله یک از بیش در
.
2
-
سرعت توانمی کم خطای با درنتیجه و نبوده زیاد کوتاه هایزمان در هاآن تغییرات است اندک بسیار واسطه مواد غلظت اینکه به توجه با
ت
غی
هاآن یرات
گرفت نظر در صفر برابر را
.
مثال
1
:
شودمی انجام زیر مکانیزم با روبرو پیچیده واکنش
.
سرعت معادله
A
آورید بدست را
.
A + 2B
مثال
2
:
در واکنش یک سرعت
°C
327
در آن سرعت برابر سه
°C
200
است
.
است؟ مول گرم بر کیلوکالری چند واکنش فعالسازی انرژی
(
براب گازها ثابت
ر
R = 1.98 cal/gmolk
است
.
مثال
3
:
دمای در
°C
2100
مقدار به زیر واکنش طبق بر آب بخار ،اتمسفر یک فشار و
1.18
%
مقدار ،است شده تجزیه
Kp
آورید بدست دما این در را
.
2𝐻2𝑂
C
A A*
𝐾1
𝐾2
A* + 2B C
𝑘3
2𝐻2 + 𝑂2
- 10.