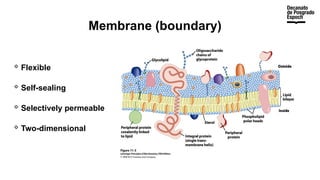
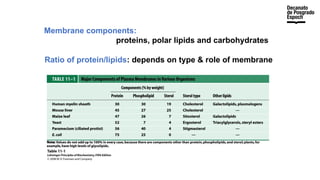
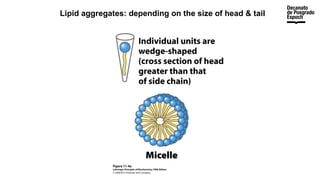
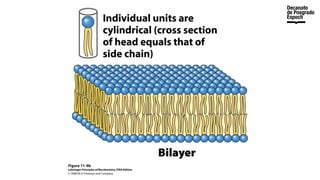
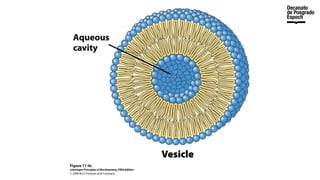
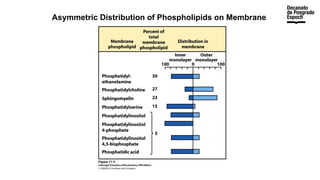
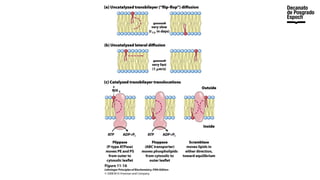
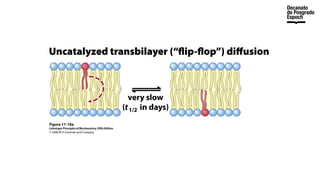
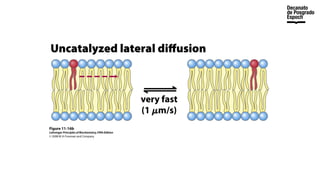
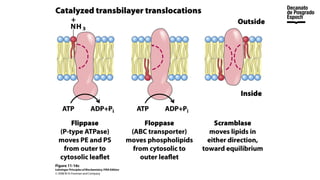
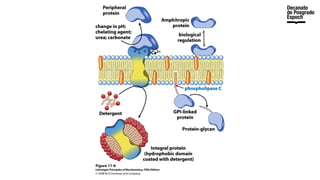
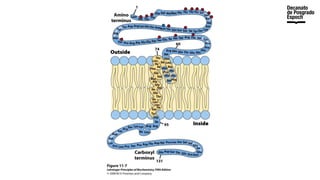
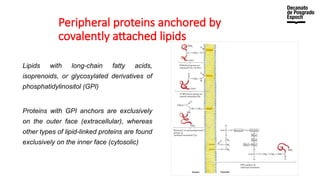
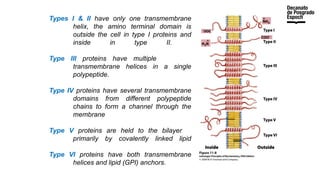
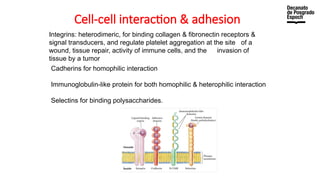
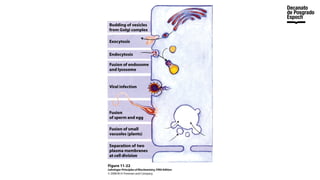
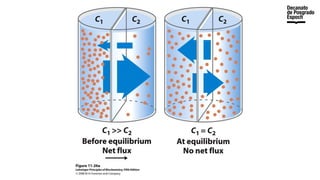
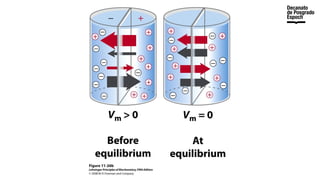
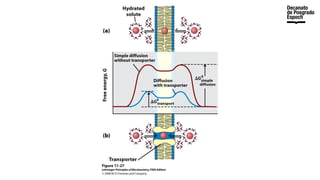
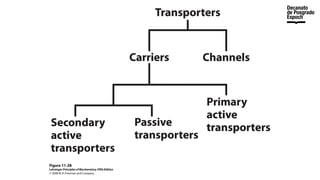
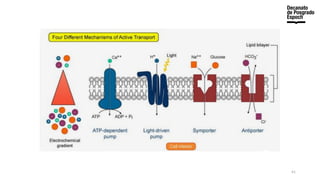
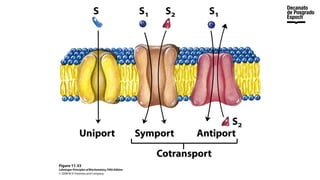
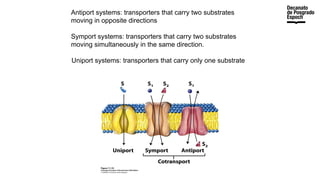
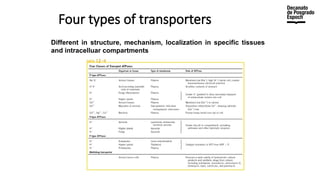
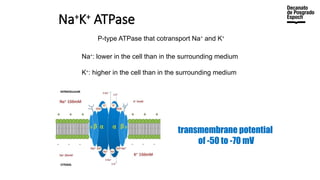
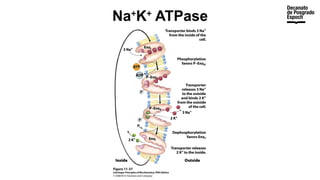
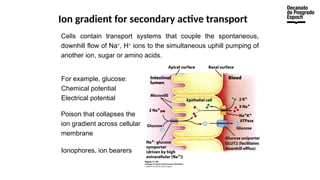
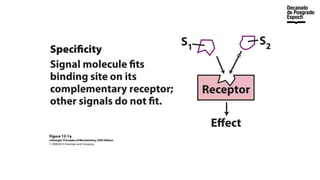
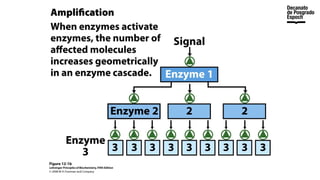
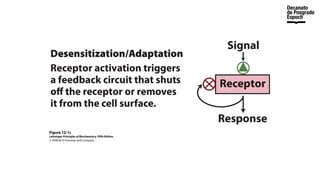
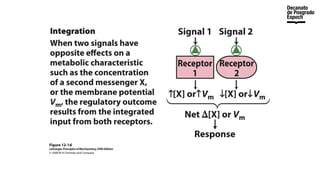
The document provides an overview of advanced inorganic chemistry, focusing on transport processes within biological membranes. It details various types of membrane proteins, their functions, and the mechanisms of passive and active transport, including different transporter types. Additionally, it discusses cell signaling pathways and the characteristics of signal transduction, highlighting specificity, sensitivity, adaptation, and integration.