Additionsmekanismer
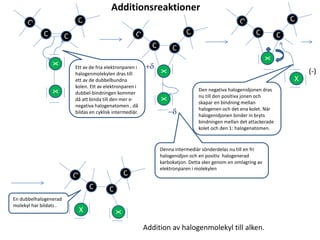
- 1. C C Additionsreaktioner XX C C XX +d -d C C X X (-) C C X X Ett av de fria elektronparen i halogenmolekylen dras till ett av de dubbelbundna kolen. Ett av elektronparen i dubbel-bindningen kommer då att binda till den mer e- negativa halogenatomen , då bildas en cyklisk intermediär. Denna intermediär sönderdelas nu till en fri halogenidjon och en positiv halogenerad karbokatjon. Detta sker genom en omlagring av elektronparen i molekylen Den negativa halogenidjonen dras nu till den positiva jonen och skapar en bindning mellan halogenen och det ena kolet. När halogenidjonen binder in bryts bindningen mellan det attackerade kolet och den 1: halogenatomen. En dubbelhalogenerad molekyl har bildats . Addition av halogenmolekyl till alken.
- 2. Addition av vätehalogenid till osymmetrisk alken. Markovnikovaddition H C C H H H H H H C C H H H H H H C C H H H H H H H Två olika karbokatjoner kan nu teoretiskt bildas men på grund av stabilitetsfaktorer så kommer reaktionen till uteslutande del ske via den sekundära karbokatjonen, i denna kan den positiva laddningen spridas över fler kolatomer än i den primära, vilket gör den stabilare sekundär karbokatjon stabilare än den primära Primär karbokatjon instabilare än den sekundära X H+d -d X (-) C C H H H H H H H C C H H H H H H H >95% av produkterna utgörs av den produkt som bildas via den mer stabila sekundära karbokatjonen. Halogeniden dras till karbokatjonen och en halogenalkan bildas
