Recommended
PDF
PDF
PDF
เรื่อง การหายใจระดับเซลล์ cellular rispiration น้องๆสามารถศึกษาข้อมูลเพิ่มเติ...
PDF
ชีววิทยาเรื่อง การหายใจระดับเซลล์ cellular respiration (t)
PPT
การสลายสารอาหารระดับเซลล์
PDF
PDF
PDF
การสลายสารอาหารระดับเซลล์
PDF
2024 Trend Updates: What Really Works In SEO & Content Marketing
PDF
Storytelling For The Web: Integrate Storytelling in your Design Process
PDF
Artificial Intelligence, Data and Competition – SCHREPEL – June 2024 OECD dis...
PDF
How to Leverage AI to Boost Employee Wellness - Lydia Di Francesco - SocialHR...
PDF
2024 State of Marketing Report – by Hubspot
PDF
Everything You Need To Know About ChatGPT
PDF
Product Design Trends in 2024 | Teenage Engineerings
PDF
How Race, Age and Gender Shape Attitudes Towards Mental Health
PDF
AI Trends in Creative Operations 2024 by Artwork Flow.pdf
PDF
PDF
PEPSICO Presentation to CAGNY Conference Feb 2024
PDF
Content Methodology: A Best Practices Report (Webinar)
PPTX
How to Prepare For a Successful Job Search for 2024
PDF
Social Media Marketing Trends 2024 // The Global Indie Insights
PDF
Trends In Paid Search: Navigating The Digital Landscape In 2024
PDF
5 Public speaking tips from TED - Visualized summary
PDF
ChatGPT and the Future of Work - Clark Boyd
PDF
Getting into the tech field. what next
PDF
Google's Just Not That Into You: Understanding Core Updates & Search Intent
PDF
How to have difficult conversations
More Related Content
PDF
PDF
PDF
เรื่อง การหายใจระดับเซลล์ cellular rispiration น้องๆสามารถศึกษาข้อมูลเพิ่มเติ...
PDF
ชีววิทยาเรื่อง การหายใจระดับเซลล์ cellular respiration (t)
PPT
การสลายสารอาหารระดับเซลล์
PDF
PDF
PDF
การสลายสารอาหารระดับเซลล์
Featured
PDF
2024 Trend Updates: What Really Works In SEO & Content Marketing
PDF
Storytelling For The Web: Integrate Storytelling in your Design Process
PDF
Artificial Intelligence, Data and Competition – SCHREPEL – June 2024 OECD dis...
PDF
How to Leverage AI to Boost Employee Wellness - Lydia Di Francesco - SocialHR...
PDF
2024 State of Marketing Report – by Hubspot
PDF
Everything You Need To Know About ChatGPT
PDF
Product Design Trends in 2024 | Teenage Engineerings
PDF
How Race, Age and Gender Shape Attitudes Towards Mental Health
PDF
AI Trends in Creative Operations 2024 by Artwork Flow.pdf
PDF
PDF
PEPSICO Presentation to CAGNY Conference Feb 2024
PDF
Content Methodology: A Best Practices Report (Webinar)
PPTX
How to Prepare For a Successful Job Search for 2024
PDF
Social Media Marketing Trends 2024 // The Global Indie Insights
PDF
Trends In Paid Search: Navigating The Digital Landscape In 2024
PDF
5 Public speaking tips from TED - Visualized summary
PDF
ChatGPT and the Future of Work - Clark Boyd
PDF
Getting into the tech field. what next
PDF
Google's Just Not That Into You: Understanding Core Updates & Search Intent
PDF
How to have difficult conversations
3. Enzyme Earn.pptx 1. 2. 3. www.company.com
Amino acid and Peptide structure
C
H
CO
NH2
R
C
H
NH
2
COO
H
R
C
H
NH
2
COO
H
R’
C
H
R’
COO
H
N
H
Peptide
bond
Where:
and
Represent two typical amino
4. 5. 6. 7. 8. www.company.com
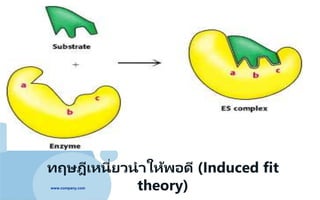
•ทฤษฎีเอนไซม์ยืดหยุ่น (Flexible enzyme) หรือ
ทฤษฏีเหนี่ยวนาให้พอดี (Induced fit)
- โคชแลนด์(Koshland) นักเคมีชาวเยอรมัน เป็ นผู้
เสนอทฤษฎีนี้
- โดยบริเวณเร่งเอนไซม์ไม่จาเป็ นต้องมีลักษณะ
ขนาด รูปร่างเป็ นทรงเรขาคณิตที่คงตัว แต่สามารถ
ยืดหยุ่นได้ด้วยการจัดเรียงของหมู่อัลคิล (R-group)
ของกรดอะมิโนใหม่ และเมื่อถูกชักนาด้วยโมเลกุลของ
สับสเตรท จนกระทั่งบริเวณต่างๆ บนบริเวณเร่งของ
เอนไซม์จับกับสับสเตรทได้ดี
ความจาเพาะเจาะจงของเอนไซม์(ต่อ)
9. 10. 11. www.company.com
ชนิดของเอนไซม์
(1) ออกซิโดรีดักเตส (Oxidoreductase)
เป็ นเอนไซม์ที่ทางานโดยการเกิดปฏิกิริยาออกซิเดชั่น
(Oxidation) หรือรีดักชั่น (Reduction) เช่นดีไฮโดร
จีเนส (Dehydrogenase) ซึ่งทาหน้าที่ดึงไฮโดรเจนออก
จากสารประกอบหนึ่งไปยังสารประกอบหนึ่ง
(2) ทรานสเฟอเรส (Tranferase)
เป็ นเอนไซม์ที่แลกเปลี่ยนฟังก์ชั่นแนลกรุ๊ป
(Functional group) เช่น เมธิลทรานสเฟอ
เรส (Methyltransferase) ทาหน้าที่ย้ายหมู่เมทธิลจาก
สารหนึ่งไปยังสารหนึ่ง
12. 13. www.company.com
ชนิดของเอนไซม์
(5) ไอโซเมอเรส (Isomerase)
เป็ นเอนไซม์ที่ทางานโดยเร่งการเปลี่ยนไอโซเมอร ์
ของสารตั้งต้น เช่นอะลานีน เรซิเมส
(Alanine racemase) เปลี่ยน L-alanine เป็ น D-alanine
(คือจาก L-isomer เป็ น D-isomer นั่นเอง)
(6) ไลเกส (Ligase หรือ Sysnthase หรือ Synthetase)
เป็ นเอนไซม์เร่งการสร้างพันธะระหว่างโมเลกุล 2
โมเลกุล ด้วยการใช้พลังงานการสลายพันธะไพโร
ฟอสเฟตใน ATP เช่น Glutamine synthetase ทาให้
Glutamate และแอมโมเนียสร้างพันธะกันกลายเป็ น
14. 15. 16. 17. 18. www.company.com
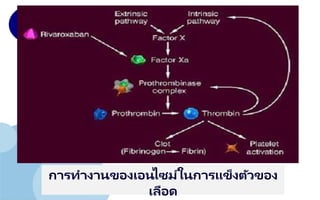
(1) แอคติเวเตอร ์(Activator)
•เมทัลโลเอนไซม์ (Metallo enzyme) คือเอนไซม์ที่มี
โคแฟคเตอร ์เป็ นอิออนของโลหะ
•ตัวอย่างเช่น
การแข็งตัวของเลือด แคลเซียมไอออน ที่เรียกว่า
แฟคเตอร ์ IV ต้องการสาหรับการแอกติเวต ทรอมโบ
ไคเนส (Thrombokinase) แล้วจะเปลี่ยนไปเป็ น โปรท
อมบิน (Prothrombin) และไปเป็ น ทรอมบิน
(Thrombin)
•คือโคแฟคเตอร ์ที่เป็ นไอออนโลหะ เช่น แคลเซียมอิ
ออน (Ca+)
19. 20. 21. www.company.com
คือโคแฟกเตอร ์ที่เป็ นสารอินทรีย์ที่ไม่ใช่โปรตีน โค
เอนไซม์จะช่วยในการทางานของเอนไซม์ โดยทั่วไป
โคเอนไซม์เป็ นอนุพันธ ์ของวิตามินที่ละลายน้าได้
•โคเอนไซม์ทาหน้าที่ในปฏิกิริยาที่มีการโยกย้ายของ
หมู่เคมี อะตอม หรืออิเลคตรอน โดยทาปฏิกิริยากับ
สับสเตรทหรือฟังก์ชันนัลกรุ๊ปจากเอนไซม์ไปยัง
สับสเตรท เช่น NAD, NADP ที่ทาหน้าที่ขนย้าย
ไฮโดรเจน (H+) และโคเอนไซม์เอที่ขนย้ายอะซิติล
กรุ๊ป เป็ นต้น
(2) โคเอนไซม์ (Coenzyme)
22. 23. www.company.com
ไอโซเอนไซม์(Isoenzymes) หรือ ไอโซ
ไซม์
คือ กลุ่มเอ็นไซม์ที่ทาหน้าที่เร่งปฏิกิริยาเดียวกัน
แต่ตัวเอ็นไซม์มีคุณสมบัติทางฟิ สิกส์และเคมีแตกต่าง
กัน
เป็ นเอนไซม์ที่เร่งปฏิกิริยาเดียวกัน มีน้าหนักโมเลกุล
เท่ากัน มีการเรียงตัวของกรดอะมิโนคล้ายคลึงกัน
แต่ การเรียงตัวของกรดอะมิโนต่างกัน ทาให้เมื่อแยก
เ อ นไ ซ ม์ โ ด ย วิ ธี ท า ง อิ เ ล ค โ ต ร โ ฟ รี ซิ ส
(Electrophoresis) แล้วจะทาให้ไอโซไซม์แยกจากกัน
ได้
อีเลคโตรโฟรีซิสสามารถแยกโปรตีนหรือโมเลกุลอื่นที่
24. www.company.com
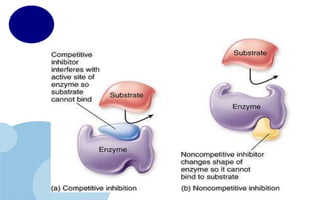
• Competitive Inhibitor สามารถรวมตัวกับ
โมเลกุลของเอ็นไซม์ตรงตาแหน่ง Active site โดย
การแย่งจับกับสับสเตรท
• Non competitive Inhibitor เป็ นตัวยับยั้งที่จับกับ
เอ็นไซม์ หรือ ES-complex ซึ่งจะได้ EI และ ESI ซึ่ง
จะไม่สามารถเปลี่ยนต่อเป็ นผลิตภัณฑ์ได้
• Irreversible Inhibitor เป็ นการยับยั้งแบบ
ย้อนกลับไม่ได้ โดยมีการจับโมเลกุลของเอ็นไซม์ที่
บริเวณ Active site ทาให้เอนไซม์ไม่สามารถ
กลับมาทางานได้ตามปกติอีก ถึงจะมีการเพิ่มความ
ตัวยับยั้งการทางานของเอนไซม์
(Inhibitors)
25. 26. 27. 28. 29. 30. 31.