More Related Content
Similar to дисперс систем 12
Similar to дисперс систем 12 (15)
дисперс систем 12
- 1. Хичээлийн сэдэв: Дисперс систем
Дисперс систем-Энэ нь гетероген систем бөгөөд өчүүхэн жижиг хэсэг бүхий фазаас нэг
бодис үүсэх өөр нэгэн төрлийн фазад хуваарилагдсантай тэнцүү. Дисперс систем нь
дисперсийн фаз ба дисперсийн орчноос тогтоно.
Дисперсийн фаз-Дисперс систем дэхь нэгэн жигд тархсан маш жижиг хэсгийг хэлнэ.
Дисперсийн орчин-Жижиглэгдэн тархсан дисперсийн фазыг уусгаж нэгэн төрлийн бүтэц
үүсгэхийг хэлнэ. Дисперс системийг онцлогоор нь ангилдаг.
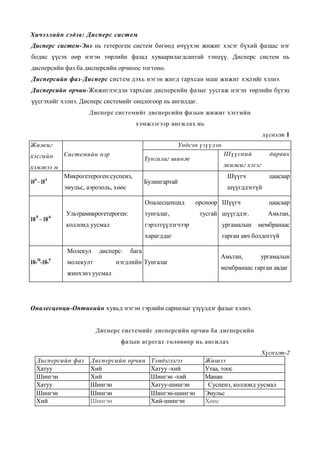
Дисперс системийг дисперсийн фазын жижиг хэсгийн
хэмжээгээр ангилах нь
хүснэгт 1
Жижиг Үндсэн үзүүлэн
хэсгийн Системийн нэр Шүүсний дараах
Тунгалаг шинж
хэмжээ м жижиг хэсэг
Микрогетероген:суспенз, Шүүгч цаасаар
10-6 – 10-4 Булингартай
эмульс, аэрозоль, хөөс шүүгддэггүй
Опалесценцид орсноор Шүүгч цаасаар
Ультрамикрогетероген: тунгалаг, тусгай шүүгддэг. Амьтан,
10-9 – 10-6
коллоид уусмал гэрэлтүүлэгчээр ургамалын мембранаас
харагддаг гарган авч болдоггүй
Молекул дисперс: бага
Амьтан, ургамалын
10-10-10-9 молекулт нэгдлийн Тунгалаг
мембранаас гарган авдаг
жинхэнэ уусмал
Опалесценци-Оптикийн хувьд нэгэн гэрлийн сарнилыг үзүүлдэг фазыг хэлнэ.
Дисперс системийг дисперсийн орчин ба дисперсийн
фазын агрегат төлөвөөр нь ангилах
Хүснэгт-2
Дисперсийн фаз Дисперсийн орчин Тэмдэглэгээ Жишээ
Хатуу Хий Хатуу -хий Утаа, тоос
Шингэн Хий Шингэн -хий Манан
Хатуу Шингэн Хатуу-шингэн Суспенз, коллоид уусмал
Шингэн Шингэн Шингэн-шингэн Эмульс
Хий Шингэн Хий-шингэн Хөөс
- 2. Дисперс системийг дисперсийн фаз дисперсийн
орчны харилцан үйлчлэлээр нь ангилах
Хүснэгт-3
Лиофоб системүүд: тогтворжуулагчтай Лиофиль системүүд гадаргуугийн
(золь) коллиод уусмал, суспенз, эмульс, идэвхит бодистой (ГИБ) коллоид уусмал,
хөөс, аэрозоль өндөр молекулт нэгдлууд (ӨМН)
Дисперсийн фаз ба дисперсийн орчин Дисперсийн фаз ба дисперсийн орчин
хоорондоо сул харилцан үйлчлэлд ордог хоорондоо эрчимтэй харилцан үйлчлэлд
ордог
Гадны энергийн хорогдлоор үүсдэг Өөрөө аяндаа үүсдэг
Энерги шингээх процесс Энерги ялгаруулах процесс
(Эндоргонический процесс) (Экзоргонический процесс)
Термодинамикийн хувьд тогтворгүй Термодинамикийн хувьд тогтвортой
Тогтворжуулагч зайлшгүй хэрэглэдэг Тогтворжуулагч хэрэглэдэггүй
Дисперс системийг механик шинж-бүтцээр нь ангилах
Хүснэгт 4
Чөлөөт дисперс системүүд: Холбоот дисперс системүүд: лиогель,
лиозоль,суспенз, эмульс, аэрозоль цэлцэн, ширхэглэг, энгийн капиляр
(манан, утаа, тоос) системүүд
Дисперсийн фаз нь хөдөлгөөнтэй Дисперсийн фаз нь практикт
улмаар жижиг хэсгүүд нь өөр хөдөлгөөнгүй (тор, карказ) бүтцийг
хоорондоо холбогддоггүй, үүсгэдэг. Дисперсийн орчин нь дотроо
дисперсийн орчинд ижил хэмжээтэй байгууламжтай
жигд тархдаггүй.
Дисперс системийн жишээгээр коллоид уусмал (лиофоб ба лиофиль)-ыг авдаг. Эдгээр
системийн нэгж бүтэц нь мицелууд - микро бүтцүүд бөгөөд дисперсийн фаз, орчин хоѐрын
харилцан үйлчлэлийн дунд үүсдэг. Лиофоб ба лиофиль коллиод уусмалд мицелл бүтэц янз
бүрийн орчин нөхцөлд харилцан үйлчилснээр янз бүрийн шинжтэй болох ба улмаар
тэдгээрийн тогтвортой чанар, оршин байх нөхцлийг бүрдүүлдэг.
Коллоид уусмал гаргах
Коллоид уусмалыг бүдүүн дисперсийн системийн жижиг хэсгүүдийг жижигрүүлэх
(дисперслэх), жинхэнэ уусмсалын жижиг хэсгийг (молекул, атом, ион) нэгдүүлж томсгох
(конденсацлах) гэсэн хоѐр аргаар гарган авна.
Дисперслэх аргад гадаргуугийн хэмжээ ихсэж гадаргуугийн энерги нэмэгдэнэ.
Конденсацлах аргад гадаргуугийн хэмжээ багасаж гадаргуугийн энерги багасна.
Тогтвортой коллоид уусмал гаргахад дараах нөхцлүүд шаардагдана:
- 3. 1. Коллоидын орчин ба фаз харилцан уусахгүй байх
2. Коллоидын дисперслэлтийн зэрэг 10-9 -10-7 м байх
3. Коллоидыг тогтвортой байлгадаг тогтворжуулагч байх зэрэг болно
1-р зураг. Бредигийн аргаар коллоид гаргах "-металл, 2-вольтын нум, 3-уусгагч (хөргөөх)
Дисперслэх арга. Дисперслэлтийг (жижиглэлтийг)
янз бүрийн аргаар явуулдаг:
1. Механикаар бутлах. Механик бутлалтыг шааран
ба коллоид бутлагч дээр хийнэ.
2. Цахилгаанаар бутлах. Цахилгаан вольтын нум үүсгэх
металлуудыг жижиглэн коллоидыг гаргадаг. Үүний
тулд коллоидыг нь гаргах металлаар хоѐр электрод
бэлтгэж хөргөх шингэнд (тогтворжуулагч нэмсэн)
дүрж байрлуулна. (1-р зураг). Дараа нь цахилгаан гүйдэл
өгч вольтын нум үүсгэхийн тулд электродуудыг ойртуулна. Ингэхэд вольтын нумын
температурт металл ууршиж шингэний дотор конденсацлан золь үүсгэнэ. Энэ аргаар, алт, мөнгө,
цагаан алт ба бусад металлуудын золь гаргадаг. Энэ аргыг Бредигийн арга гэж нэрлэдэг. Эмийн
золь гаргах ашигтай хувилбарын нэг нь нүүрстөрөгчийн аллотроп болох фуллеренийг ашиглах
явдал юм. Эмийн бодисуудын оролцоотойгоор бал чулуунаас вольтын нуманд түүнийг
ниилэгжүүлдэг. Үүний дүнд фуллерены золь ардаг. Фуллерены молекулууд дахь хөндийд эмийн
бэлдмэлийн молекулууд дүүргэгдсэн байдаг.
3. Хэт авианы үйлчлэлээр гаргах. Хэт авиан хэлбэлзэл бол өндөр давтамжтай механик
хэлбэлзэл (1 секундэд 20000-100000 тооны хэлбэлзэл) байдаг бөгөөд түүнийг тусгай
генераторын тусламжтайгаар гарган авдаг. Богино хугацаанд (10-4-10-5с), өндөр даралтын
өөрчлөлтөөр шингэн ба хатуу биетүүдийг дисперслэдэг. Ийм аргаар хүхэр, гөлтгөнө, бал
чулуу, металлуудын гидроксидуудын золийг гарган авдаг. Биомембран судлалд биологийн
мембран-липосом гэсэн тусгай загвар гаргахын тулд липидүүдийн усан суспензыг хэт авиагаар
боловсруулан гаргадаг.
4. Пептизацын арга. Энэ арга нь шинээр үүссэн сийрэг тунадас дээр пептизатор хэмээн
нэрлэгдэх электролит бодисыг их биш хэмжээгээр нэмж коллоидын хэсгийн хэмжээ хуртэл
жижиглэхэд үндэслэгддэг. Пептизацыг шингээлтийн ба химийн гэж ангилна. Эхний
тохиолдолд электролит-пептизатор тунадасны хэсгийн гадаргууд шингээгдэнэ. Ингэсний дараа
цэнэгийн үйлчлэлээр тунадсыг задлаж коллоидын хэсгийн хэмжээнд хүртэл жижиглэснээр
коллоид үүснэ. Жишээ нь: төмрийн (III) гидроксидын сийрэг тунадас дээр төмрийн (III)
хлоридыг нэмэхэд төмрийн (III) гидроксидын золь коллоид үүснэ. Хоѐр дахь тохиолдолд
тунадасны гадаргуу дээрхи жижиг хэсгүүдтэй нэмж байгаа бодис урвалд орж пептизаторыг
- 4. үүсгэдэг. Жишээ нь: шинэхэн гаргасан темрийн (III) гидроксидын тунадас дээр давсны
хүчлийн уусмалыг бага хэмжээгээр нэмэхэд тунадас төмрийн (III) гидроксидын коллоид болон
хувирна. Пептизацын процесс биологийн ач холбогдолтой.
Конденсацын арга. Коллоид уусмал гаргах конденсацын аргыг физикийн ба химийн гэж
ангилна. Физикийн үзэгдэлд уул, утаа, манан үүсэх, мөн уусгагчийг солих (ууссан бодисыг
илуу сайн уусгадаг уусгагчаар солих) арга хамаарна. Жишээ нь: хүхэр, канифоли спиртэнд
сайн уусдаг. Харин эдгээр нь усанд муу уусдаг. Тэгвэл эдгээр бодисуудын уусгагч
спиртийг усаар солиход хүхэр, канифолийн гидрозолууд үүснэ.
Химийн конденсацын аргын үндэс нь аль нэг тогтворжуулагчийн оролцоотойгоор муу
уусдаг бодис үүсгэж явагддаг химийн урвалууд (исэлдэх, ангижрах, гидролиз, солилцох)
юм. Жишээ нь: усыг цэвэрлэхэд хэрэглэгддэг темрийн (III) ба хөнгөнцагааны
гидроксидуудын золийг гаргах гидролизын урвалууд:
FеС13 + ЗН2О Fе(ОН)3 + ЗНС1
Энэ золийн тогтворжуулагч нь урвалд үүсэж байгаа темрийн окисихлорид
Fе(ОН)3 + ЗНС1 FеОСL + 2Н2О
Коллоид уусмалыг цэвэрлэх
Коллоид уусмалууд электролитүүдийн хольц ба бусад бага молекулт бодисуудыг
агуулж байдаг. Хольц агуулсан коллоид уусмал тогтвор муутай
Т.Грэм коллоид уусмалыг цэвэрлэхэд диализын
аргыг хэрэглэсэн. Диализын арга нь том
коллоидын хэсгүүдийг нэвтрүүлэхгүй
саатуулдаг. Харин бага молекулт нэгдлийн ион
ба молекулыг нэвтрүүлдэг мембран хэрэглэхэд
үндэслэгдсэн арга юм. Диализыг диализатор
хэмээн нэрлэгдэх багажинд явуулдаг.
Грэмийн диализатор
Цахилгаан диализ гурван хэсгээс (камер) тогтоно.
Дунд хэсэгт коллоид уусмал байх ба энэ хэсгийн
хажуугийн хоѐр хана нь хагас нэвтрүүлэгч
мембранаар хийгдсэн байна. Энэ хэсгийн хоѐр
талын хэсгүүдэд тогтмол гүйдэл үүсгэгчтэй
холбогдсон электродуудыг байрлуулсан байдаг.
Цахилгаан диализын давуу тал нь ионуудын шилжих
хурдыг нэмэгдүүлж хугацааг хэмнэдэг.
Цах.диализ 1 - хагас нэвтрүүлэгч, 2 - коллоид уусмал, 3, 4 - урсгал уусагчтай хэсгүүд (сав)
- 5. “Цахилгаан диализыг эмнэлгийн практикт, эмийн үйлдвэрүүдэд өргөн ашигладаг.
Биологийн шингэнүүдэд бага молекулт нэгдлүүдийг (бодисуудыг) тодорхойлох
явдалд компенсацын диализын (вивидиализ) аргыг хэрэглэдэг.
Хэт нарийн шүүлтүүрийн арга. Дисперсийн фазыг дисперсийн орчноос салгахын тулд
дисперсийн фазын жижиг хэсгийг нэвтрүүлдэггүй тусгайлан бэлтгэсэн нягт шүүлтүүрийг
хэрэглэдэг. Шүүлтийг даралтын дор буюу ваакумыг ашиглан явуулдаг. Хэт нарийн
шүүлтүүрийн аргыг ус, уураг, нуклеин хүчлүүд, ферментүүд, витаминуудыг цэвэрлэхэд болон
микробиологит вирусууд ба бактериофагуудын хэмжээг тодорхойлоход хэрэглэдэг.
Өнөө үед шүүгч-мембран болгож ацетатын эслэг, нитроэслэг, шилэн мяндас зэргийг
хэрэглэж байна. Хэт нарийн шүүлтүүрийн процесс бөөрний үйл ажиллагааны зарчимд
үндэслэгдсэн байдаг. Диализ ба хэт нарийн шүүлтүүрийн хосолсон ажиллагаатай цэвэрлэх
төхөөрөмж нь "хиймэл бөөр" аппарат болдог бөгөөд энэ нь бөөрний дутагдал болох үед
бөөрний ажиллагааг орлогч болдог.
Бүдүүн дисперс системүүд
Бүдүүн дисперс системд суспенз, эмульс, хөөс, нунтаг, аэрозоль ордог. Бүдүүн дисперс
системд дисперс фазын хэмжээ 10-6 -10-4 м байх бөгөөд ультрамикро гетероген
системээс ялгаатай нь коллоид уусмалаас хамаараад микрогетероген систем гэж нэрлэгддэг.
Суспепз-иъ микрогетероген систем бөгөөд дисперсийн орчин пь шингэн, харин
дисперсийн фаз нь 10-6 -10-4 м хатуу байдаг. Суспензын коллоид уусмалаас ялгагдах ялгаа нь
дисперсийн фаз нь том хэмжээтэй байхаас гадна тэдгээрийн шинж чанар нь ялгагдаж байх
хэрэгтэй. Дисперс фазын жижиг хэсэг том байвал Броуны хөдөлгөөнд захирагдахгүй,
улмаар диффүзэд орохгүй мөн системд осмосын даралтыг үзүүлдэггүй.
Суспензийн гэрлийн тусгал: тунгалаг, шулуун гэрэлд тэд коллоид хэсгийн коллоид
уусмалын адил шууд булингартдаг. Суспенз нь тогтворгүй систем юм.
Эмульс-нъ микрогетероген дисперс систем бөгөөд 10-6-10-4 м хэмжээтэй жижиг дусал
бүхий шингэн, мөн холилддоггүй шингэн, бусад шингэнд уусдаггүй шингэн хамаарна.
Эмульс нь седиментацийн хувьд тогтворгүй систем юм.
Аэрозоль-Энэ дисперсийн систем нь 10-7-10-4 м хэмжээтэй жижиг хэсэг бүхий шингэн эсвэл
хатуу дисперсийн фазтай, хий (агаар) бүхий дисперсийн орчинтой систем юм.
Шингэн дисперсийн фазтай аэрозолыг манан, харин хатуу дисперсийн фазтай байвал утаа
гэнэ.
Утааны найрлаганд байх хатуу бодисын жижиг хэсгийн хэмжээ нь 10 -7-10-6 м байна. Харин
10-6-10-4 м хэмжээтэй бол тоос гэнэ. Аэрозолийн шинж чанарыг хийн төлөвтэй дисперс орчны
шинжээр тодорхойлож болно. Коллоид уусмалд байх аэрозолийн шинжийг тэдний гэрэлтэх
оптик шинжээр нь тодорхойлдог. Аэрозоль тогтворгүй систем бөгөөд коагуляцид орсон