Книга В. Г. Костенко рассматривает проблему структуры и функционирования живой клетки через призму органической химии, утверждая, что жизнь не могла возникнуть в результате химической эволюции, а была создана творцом. Автор анализирует взаимодействия между компонентами клетки, подчеркивая сложности клеточной структуры и необходимость учета целостности живого вещества. Работы направлены на решение вопросов, интересующих биологов, медиков, агрономов, а также специалистов по происхождению жизни.


![Предис ло вие
Трудно найти столь же неразрешимую проблему, кото-
рая издавна привлекала и продолжает привлекать внимание
человечества, вызывая острейшие дискуссии, как проблема
возникновения жизни. К вопросу, что такое жизнь и как она
возникла, пытались подойти с двух противоположных по-
зиций: на базе религии — идеализма и на базе материализ-
ма — вначале примитивного, базирующегося на интуиции
мыслителей (Аристотель и др.), а впоследствии прочно опи-
рающегося на научные исследования.
Что касается религии, то ее взгляды веками сохранялись и
сохраняются практически в неизменном виде — признается
роль Творца при возникновении жизни.
Примитивный материализм возникновение жизни сводил
вначале к самозарождению живых существ, а после того как
Пастер [1] доказал несостоятельность этой идеи, стал опи-
раться на идеи эволюционного развития как при возникнове-
нии жизни, так и при ее совершенствовании. Вершиной этих
идей следует признать теорию, созданную в XX в. Опариным
с сотрудниками [2].
Суть этой теории заключается в том, что развитие мате-
рии в целом основывается сначала на эволюции химических
веществ, усложняющихся с образованием сравнительно
крупных молекул, затем идет образование капель «коацерва-
тов», окруженных мембраной, вернее пленкой, напоминаю-
щей мембрану, и после этого эволюция приводит к образо-
ванию живых систем, вновь эволюционирующих к сложным
организмам, венцом которых является человек.
Все эти построения, однако, мало обоснованы, особенно
на первом «химическом» этапе, так как не известен ни один
3
Живая клетка.indb 3 27.10.2009 11:40:03](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-3-320.jpg)
![Предисловие
закон, который направлял бы эволюцию химических веществ
в сторону самопроизвольного образования и накопления
органических соединений, обладающих заранее заданными
свойствами. Ни миллионы, ни миллиарды лет не обеспе-
чили бы появление упорядоченных структур, имеющих все
свойства живых организмов, способных к самовоспроизве-
дению, обладали бы приспосабливаемостью к окружающей
среде, раздражимостью, способностью перемещаться, воз-
буждаться и т. д. Кроме того при отсутствии упорядоченных
структур, которые способны к направленному метаболизму,
процессы предполагаемой химической эволюции неизбежно
должны были бы идти с нарушением фундаментальных зако-
нов термодинамики, в частности ее второго начала.
Не вдаваясь сейчас в детали предполагаемой эволюции,
как химической, так и биологической, попробуем опреде-
лить, что же такое живое вещество. Известное изречение
Энгельса [3]: «Жизнь есть способ существования белковых
тел», — отражало уровень знаний, присущих человечеству
в середине XIX в. Сейчас стало ясно, что определение
жизни как способа существования одного или нескольких
химических соединений практически ничего не проясняет
и не соответствует действительности. Для живой структуры
важны нуклеиновые кислоты, вода, ионы металлов, витами-
ны, гормоны — все сложно перечесть. А если все это есть —
это уже живая структура? Вряд ли сейчас кто-то так думает.
Чтобы понять, что же представляет собой живое вещество,
нужно определить элементарную единицу живого. Несо-
мненно, что такой элементарной единицей в мире живого
является клетка. Естественно, что тогда необходимо понять
принципы построения клеточных структур и их функцио-
нирование, понять характер взаимодействия этих структур с
окружающей средой. Нужно знать, как клетка сохраняет жи-
вое состояние, какие силы удерживают ее в этом состоянии.
Эти знания показывают, какой путь может привести к воз-
никновению живых структур из неживого вещества.
4
Живая клетка.indb 4 27.10.2009 11:40:03](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-4-320.jpg)










![Введение
ют и испускают электромагнитное излучение. Время жизни
атома водорода в возбужденном состоянии порядка 10-8 сек.
Атомы каждого элемента поглощают и испускают свет в со-
ответствии с энергией, которой обладают их электроны. Как
правило, это валентные электроны. Спектр поглощения и ис-
пускания простейшего атома водорода, как и других атомов,
дискретен и состоит из отдельных линий, которые позволяют
судить о строении исследуемых атомов, что стало возмож-
ным в начале XX в. после появления спектральных методов
исследования.
Представления об электроне как частице, движущейся в
атоме по круговым орбитам, согласно ньютоновской механи-
ке, необходимо теперь заменить на квантово-механические
представления. Наряду со свойствами электрона, как части-
цы, согласно этим представлениям, учитываются его волно-
вые свойства. Тогда длина волны λ, соответствующая движе-
нию электрона со скоростью v будет:
Соотношение было введено де-Бройлем и волна назва-
на его именем. Для электрона в атоме ее величина оказы-
вается равной размеру атома (10-8 см). Согласно квантово-
механическим представлениям, электрон в атоме распределен
в пространстве вокруг ядра с некоторой плотностью, образуя
так называемое «электронное облако». В таком случае описа-
ние электрона сводится к использованию волновой функции
Э. Шредингера [27] ψ(x,y,z), являющейся функцией коорди-
нат электрона x,y,z. Тогда электронная плотность определяет-
ся квадратом модуля волновой функции [ψ(x,y,z)]2, которая
дает вероятность нахождения электрона (если мы его рассма-
триваем как частицу) в данной точке с координатами x,y,z.
Полный интеграл по всему пространству:
15
Живая клетка.indb 15 27.10.2009 11:40:03](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-15-320.jpg)

![Введение
товых состояниях, что для сложных атомов приводит к об-
разованию электронных оболочек, заполняющихся строго
определенным количеством электронов. Для электронной
оболочки любые два электрона должны отличаться хотя бы
одним из четырех квантовых чисел: n, l, mι , ms .
Не углубляясь далее в подробности строения атома
(читатели найдут изложение данного вопроса в любом из
учебников по общей химии, например [4], см. также [5, 9]),
остановимся вкратце на способности атомов образовывать
связи друг с другом. Простейшим случаем является молекула
водорода.
Допустим, что имеем два атома водорода, электронная
конфигурация которых:
у первого — n = 1, l = 0, ml = 0 и ms = 1/2;
у второго — n = 1, l = 0, ml = 0 и ms = –1/2.
Тогда при сближении этих атомов может возникнуть дву-
ядерная система (рис. 1).
1 2
3
Рис. 1. S-электронные облака атома водорода (1) и образование дву-
ядерной системы (2, 3). Это простейший тип ковалентной σ-связи.
Легко видеть, что при сближении облаков двух атомов
водорода между двумя ядрами возникает более уплотненная
17
Живая клетка.indb 17 27.10.2009 11:40:03](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-17-320.jpg)



![Введение
Смещение электронных облаков к более электроотрица-
тельному атому (т. е. атому с большим сродством к электро-
ну) приводит к появлению дробных зарядов на связанных
атомах. В этом случае мы имеем дело с полярными σ- или
π-связями.
Если сродство к электрону у связываемых атомов разли-
чается так, что электроны полностью захватывается одним
из атомов (например, натрий теряет электрон, а хлор приоб-
ретает), возникает ионная связь, где атомы удерживаются в
связанном состоянии за счет электростатических (кулонов-
ских) сил:
Na+ Cl-
Наглядно это представлено на рис. 4, приведенном в уже
цитированной работе [4].
1 2 3
Рис. 4. Распределение электронных облаков по различным типам свя-
зей: неполярной ковалентной связи (1); полярной ковалентной связи
(2); ионной или электростатической связи (3) [4].
В перечисленных случаях химические связи образуются
за счет неспаренных электронов внешней оболочки. Однако
у атомов, представляющих интерес с точки зрения построе-
ния биологических структур (N, O, S, Р), имеются так назы-
ваемые неподеленные электронные пары, т. е. электроны, не
участвующие в образовании связи.
21
Живая клетка.indb 21 27.10.2009 11:40:03](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-21-320.jpg)

![Введение
Бутлерова, что черточка «—» между атомами означает ва-
лентную связь между ними, т. е. по современным представ-
лениям они связаны двумя спаренными электронами с анти-
параллельными спинами, образующими общее электронное
облако.
Нельзя не остановиться на пространственном расположе-
нии атомов в органических молекулах. Ранее уже упомина-
лось о том, что четыре σ-связи в атоме углерода в состоянии
sp3–гибридизации направлены по углам правильного тетра-
эдра. И в этом случае перекрывание электронных облаков
σ-связи происходит по линии, связывающей центры двух
атомов. Поворот вокруг этой связи не требует затраты энер-
гии, и два атома углерода, связанные σ-связью, могут свобод-
но поворачиваться вокруг этой связи:
Однако при наличии заместителей у атомов углерода,
вступает в силу взаимодействие между этими заместителями.
Даже в случае, когда этими заместителями являются атомы
водорода (молекула этана), возможно как минимум возник-
новение двух форм:
Заторможенная Заслоненная
Получаем два изомера с разным расположением замести-
телей в молекуле этана. Чтобы не путать эту изомерию с клас-
сической изомерией, принятой в органической химии, Хеуорс
в 1929 г. предложил именовать такие изомеры «конформе-
рами» (цитир. по [7], с. 99). В случае этана взаимодействие
23
Живая клетка.indb 23 27.10.2009 11:40:04](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-23-320.jpg)
![Введение
(отталкивание) между атомами водорода столь ничтожно,
что говорить о преимуществе какой-то из конформаций не
имеет смысла, так как тепловая энергия среды превышает
энергию, необходимую для поворота вокруг σ-связи (в этане
2,8 ккал⋅моль-1 ([7], с. 111).
Для более сложных циклических систем конформацион-
ные переходы имеют более высокий энергетический барьер
и невозбужденные молекулы могут принимать конформа-
цию энергетически более выгодную. Например, циклогексан
может существовать в двух циклических формах: «кресла» и
«ванны» (1 и 2).
1 2
Дв е конф ормации цик логекс ана могу т пер ехо-
дить друг в друга. Энергетический барьер этого перехода
~10 ккал⋅моль- 1. Аналогичная картина имеет место в пира-
нозных циклах (встречаемых в молекулах углеводов):
Здесь возможны две формы «кресла» и шесть форм «ван-
ны». Какая из конформаций окажется энергетически более
выгодной, будет зависеть от заместителей при углеродных
атомах. Особое внимание необходимо обращать на положение
заместителей, находящихся либо в экваториальном (е), либо
аксиальном (а) положении. Хотя переходы между конформа-
циями циклических структур и достигают 5–10 ккал⋅моль-1,
тепловое движение не позволяет выделять конформеры в чи-
стом изолированном виде.
Особо следует подчеркнуть, что к конформерам относятся
такие формы молекул, которые переходят друг в друга толь-
24
Живая клетка.indb 24 27.10.2009 11:40:04](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-24-320.jpg)
![Введение
ко за счет поворота вокруг ординарных σ-связей. Переходы,
связанные с образованием и разрывом тех или иных межмо-
лекулярных связей, относятся не к конформационным, а к
конфигурационным изомерам.
Нельзя не остановиться на вопросах, связанных с симме-
трией и асимметрией молекул. Выше уже упоминалось, что
направленность электронных облаков атомов, а следователь-
но и будущих химических связей строго симметрична. Про-
стейшей симметричной молекулой, имеющей неоценимое
значение для построения живых структур, является молеку-
ла воды. Направленность двух связей кислорода с водородом,
такова, что угол между ними составляет 105°03'. Свободные
же электронные пары, участвующие в образовании водород-
ных связей, расположены так, что все четыре связи направ-
лены по углам тетраэдра и угол между ними имеет величину
около 109,5°. Симметрия молекул воды, естественно, приво-
дит к склонности ее к кристаллизации.
Известно, что симметрия молекул является основой для
симметрии кристаллов [8]. Если теперь обратимся к атому
углерода, то столкнемся также с симметричным расположе-
нием четырех гибридизованных связей в простейшей моле-
куле метана. И здесь связи направлены по углам правильного
тетраэдра с углами между ними 109°28'. Когда вместо водоро-
да по вершинам тетраэдра располагаются другие заместите-
ли, правильный тетраэдр искажается. До тех пор пока в орга-
нической молекуле у атома углерода имеется два одинаковых
заместителя, молекула будет иметь хотя бы один из элемен-
тов симметрии (центр симметрии, плоскость симметрии, ось
симметрии). Атом углерода, у которого все четыре замести-
теля разные, становится полностью асимметричным и воз-
никает так называемая оптическая изомерия, за счет асимме-
тричности молекулы в целом. Оптические изомеры вращают
плоскость поляризованного луча один вправо, другой — вле-
во. С этим явлением мы также столкнемся при построении
структуры живой клетки.
25
Живая клетка.indb 25 27.10.2009 11:40:04](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-25-320.jpg)
![Введение
Несколько иначе выглядит молекула аммиака. Здесь связи
азота с водородом направлены по углам правильного треу-
гольника в основании. Азот находится в вершине пирамиды.
Углы между связями N—H составляют ~108°. Но в молекуле
аммония азот оказывается опять же в центре правильного те-
траэдра. В основе пространственной структуры кислородных
производных фосфора также лежит неправильный тетраэдр
([9], с. 340–342), так как атом фосфора расположен в центре
тетраэдра и связан с атомами кислорода, которые находятся
в различных состояниях. Это касается и атома серы (там же,
с. 362).
Заканчивая предварительное знакомство с основами хи-
мических знаний, которые понадобятся в будущем при из-
ложении строения живой субстанции, необходимо остано-
виться на законах, которые управляют происходящими в ней
химическими превращениями. Сейчас уже можно без всяких
сомнений принять утверждение, что никаких особых зако-
нов, присущих только живому, не существует.
Согласно утверждению физика Блюменфельда ([12],
с. 11–12): «Для полного описания и понимания строения и
функционирования всех существующих биологических си-
стем в принципе достаточно известных нам основных за-
конов физики». В примечании утверждается, что это можно
сказать и о химии. Символом веры Блюменфельда, как он
утверждает, является то, что не нужно формулировать новые
постулаты и вводить мировые постоянные. Что касается фи-
зики, то, естественно, физику виднее. Что касается химии, то
позволим себе с этим не согласиться и в процессе изложения
сформулируем постулаты, которые, по нашему мнению, сде-
лают более понятными принципы построения и функциони-
рования живой клетки, хотя, действительно, никаких «миро-
вых постоянных» на основании наших постулатов вводить не
требуется.
Что касается законов термодинамики, то следует сказать
следующее: первое начало термодинамики о сохранении и
26
Живая клетка.indb 26 27.10.2009 11:40:04](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-26-320.jpg)
![Введение
превращении энергии не может не выполняться, так как речь
идет о выполнении всеобщего закона о сохранении вещества
и энергии, открытого еще в позапрошлом веке М. В. Ломоно-
совым. Выполнение второго начала термодинамики означа-
ет, что некая система не может быть вечным двигателем 1-го
рода, т. е. она не может черпать энергию от тела с более низ-
кой температурой и передавать ее телу с более высокой тем-
пературой. Изменение внутренней энергии системы равно
разности между количеством теплоты, полученной системой
из среды, и количеством работы, произведенной системой
над средой.
Не имея возможности более подробно останавливаться на
вопросах превращения и сохранения энергии как функции
состояния, отсылаем читателя к прекрасным монографиям
Певзнера [10] и Пригожина, Кондепуди [11], в которых эта
проблема изложена достаточно строго и доступно для пони-
мания слабо подготовленного читателя.
Химические реакции всегда сопровождаются либо погло-
щением, либо выделением тепла, и тогда для удобства расче-
тов была введена функция состояния, называемая энтальпи-
ей (Н). В таком случае тепловой эффект химической реакции
(Qр) будет равен:
⋅
Реакции, идущие с выделением тепла, называются экзо-
термическими (ΔН < 0), а с его поглощением — эндотермиче-
скими (ΔН > 0). Согласно закону Лавуазье—Лапласа, тепло-
вые эффекты реакций, протекающих в прямом и обратном
направлениях, равны по величине и противоположны по
знаку. Самопроизвольно могут протекать реакции, идущие
с выделением тепла, т. е. с уменьшением внутренней энергии
системы. Однако на практике мы можем наблюдать и процес-
сы, которые сопровождаются поглощением тепла, правда за
счет его поглощения из внешней среды (например, плавление
льда). Значит, должна существовать еще функция состояния,
которая объясняла бы самопроизвольность протекания это-
27
Живая клетка.indb 27 27.10.2009 11:40:04](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-27-320.jpg)
![Введение
го процесса. Эта функция состояния получила название эн-
тропии. Наиболее просто суть этой функции вытекает из ее
определения как меры неупорядоченности системы.
Химические проблемы удобнее решать, используя опреде-
ление энтропии, данное Больцманом: энтропия системы (S)
пропорциональна логарифму термодинамической вероятно-
сти (W) состояния системы,
где k — постоянная Больцмана (k = 1,38·10-16 эрг·град-1), а тер-
модинамическая вероятность W определяется числом микро-
состояний, которым может осуществляться рассматриваемое
макросостояние.
Важность этого определения неоценима для объясне-
ния построений в живой клетке. Функцию состояния, свя-
зывающую энтальпию и энтропию, ввел Дж. Гиббс (цитир.
по [4], с. 139). В термодинамике ее называют свободной
энергией (G):
или ее изменение:
Согласно термодинамике, в закрытой системе при посто-
янном давлении и температуре самопроизвольный процесс
должен протекать только в сторону уменьшения свободной
энергии системы. Будет ли иметь место такой процесс в суще-
ственном количественном отношении, зависит еще и от его
энергии активации. Как известно, наука, изучающая скорости
и механизмы химических реакций, называется кинетикой,
экспериментальной основой которой является измерение
скоростей химических реакций в зависимости от температу-
ры, давления, природы растворителей, наличия катализато-
ров или ингибиторов и т. д.
Для живых систем следует признать важнейшими фак-
торами температуру и участие в реакциях катализаторов и
28
Живая клетка.indb 28 27.10.2009 11:40:04](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-28-320.jpg)
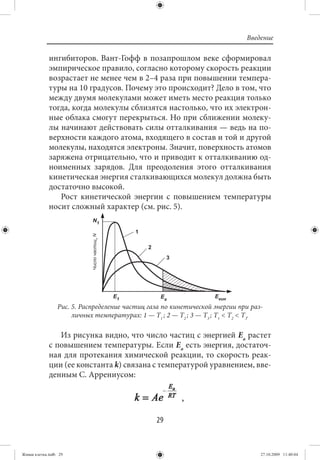
![Введение
где k — константа скорости; R — газовая постоянная; Т —
температура; Еа — энергия активации, ниже которой реакции
не идут; А — постоянная, характеризующая каждую реакцию.
Еще одно существенное замечание — не все столкнове-
ния, энергия которых достигает величины Еа, будут при-
водить к возникновению химического превращения, если
сталкивающиеся молекулы будут развернуты «неудобным»
образом, тогда отсутствует возможность перекрывания соот-
ветствующих электронных облаков. В этом случае неоцени-
мую помощь оказывают вещества, способные образовывать
промежуточный комплекс хотя бы с одной из реагирующих
молекул:
.
Такой процесс именуется катализом, а вещество, образую-
щее промежуточный комплекс и остающееся после реакции в
неизменном виде, называется катализатором. Роль катализа-
тора сводится к снижению энергии активации Еа, что ускоря-
ет ход химической реакции (рис. 6).
Рис. 6. Энергетическая схема реакций: 1 — без катализатора, ей со-
ответствует большая энергия активации Еа ; 2 — реакция в при-
сутствии катализатора — ей соответствует пониженная энергия
активации Еа (кат) [4].
30
Живая клетка.indb 30 27.10.2009 11:40:04](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-30-320.jpg)

![Глава 1
Клетка — элементарная единица живого
Мы уже констатировали, что элементарной единицей жи-
вой субстанции является клетка. Что это означает? Науке в
настоящее время неизвестен ни один живой организм, по-
строенный не из клеток. По-видимому, существовать в зем-
ных условиях внеклеточная форма жизни не смогла бы, так
как такая живая субстанция немедленно была бы поглощена
более приспособленной и более устойчивой клеточной, ныне
существующей, формой жизни ([13], с. 45). Вирусы и бакте-
риофаги вряд ли можно считать живыми, так как вне клеток
они существовать и размножаться не могут.
Иерархия построения материального мира и место клетки
в этой иерархии представлены схемой 1.1. Как видно из схе-
мы, для решения вопросов построения и функционирования
живой клетки необходимо опираться и использовать данные
физики и химии. В то же время нельзя понять, как устроен и
функционирует многоклеточный организм, если мы не знаем
все о живой клетке, т. е. мы имеем дело с многоуровневым по-
строением живой субстанции ([13], с. 18).
Что из этого следует? Если мы сможем понять, как устро-
ена и функционирует живая клетка, будет легче познать за-
кономерности и законы, управляющие поведением живых
организмов. Нельзя не согласиться с утверждением С. Е. Брес-
лера ([14], с. 5): «Клетка не может быть уподоблена сосуду,
в котором попросту перемешаны в растворе все метаболиты
и ферменты — она разделена на множество органелл, защи-
щенных белковыми, часто липопротеиновыми мембранами,
наделенными ферментативной активностью, препятствую-
32
Живая клетка.indb 32 27.10.2009 11:40:04](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-32-320.jpg)
![Клетка — элементарная единица живого
щими свободному проникновению растворенных веществ».
Уже из этого утверждения следует, что клетка представляет
собой структурное образование, наделенное свойствами,
которыми обладает живая субстанция. Естественно, что мы
можем ожидать существования особых законов и закономер-
ностей, присущих живым клеткам, если из них построена эта
субстанция. Однако эти законы не могут нарушать законы
физик и и химиии и противоречить им.
В 1935 г. Э. С. Бауэр [15] впервые попытался, анализируя
поведение живых организмов и структуру некоторых орга-
нов и тканей, вывести эти законы. Учитывая то, что он опере-
дил свое время на десятилетия и что до настоящего времени
никому так и не удалось создать цельную теорию живого, по-
пробуем подробнее остановиться на его взглядах, несмотря
на то, что по мнению некоторых исследователей эти взгляды
не являются общепризнанными.
Общий закон биологии по Бауэру гласит: «Все и только
живые системы никогда не бывают в равновесии и постоянно
исполняют за счет своей свободной энергии работу против
равновесия, требуемого законами физики и химии при суще-
ствующих внешних условиях».
Известно, что равновесие в неживых системах стремится
вернуться к исходному состоянию при существующих внеш-
них условиях и воздействию извне. Живые системы также
стремятся сохранить свое неравновесное состояние при воз-
действии на них извне. Это свойство принадлежит только
живым системам, так как неизвестно ни одной неживой си-
стемы, которая сохраняла бы устойчивость в неравновесном
состоянии (конечно при условии, что эта система обладала
бы и другими признаками живых систем, о чем речь пойдет
ниже).
Далее Бауэр считает, что живые системы выполняют ра-
боту за счет структурной свободной энергии. При этом за-
трачиваемая свободная энергия живой системы расходуется
либо на совершение внешней работы, либо на сопротивле-
33
Живая клетка.indb 33 27.10.2009 11:40:04](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-33-320.jpg)

![Клетка — элементарная единица живого
перечнополосатые мышцы частично теряют поперечную по-
лосатость и переходят в более или менее гомогенизированное
состояние после того, как подвергнутся нагрузке (рис. 7).
1 2 3
Рис. 7. Изменение во времени поперечной исчерченности растянутой
мышцы: 1 — в момент растягивания; 2 — через 2 часа от начала рас-
тягивания; 3 — через 4 часа [15].
Сразу следует обратить внимание на то, что изменения
наблюдаемой исчерченности поперечнополосатой мышцы
носят неспецифический характер. Сходная картина наблю-
дается и при воздействии яда — монойодуксусной кислоты
(рис. 8), при раздражении и просто при отмирании мышцы
(рис. 9).
Следует отметить, что с неспецифичностью мы столкнем-
ся и далее при рассмотрении других примеров. Наблюдая за
изменениями мускульной ткани при ее умирании, Бауэр дела-
ет выводы о форме мицелл ткани и форме молекул этой тка-
ни, считая, что последние обладают продолговатой формой,
соответствующей неравновесному состоянию. По-видимому,
выводы о форме молекул тогда были преждевременными.
Несомненный интерес представляют данные Бауэра о
переходе тканей и клеток из живого состояния к мертвому.
При этом происходит выделение теплоты или излучения, т. е.
клетка, умирая, теряет структурную энергию:
где Ει — обозначает энергию в живом состоянии и Εt— в мертвом;
h — постоянная Планка, ν ─ обозначает частоту колебаний ис-
пускаемых лучей; т. е. энергия выделяется при переходе клеточ-
36
Живая клетка.indb 36 27.10.2009 11:40:05](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-36-320.jpg)
![Клетка — элементарная единица живого
ной системы из неравновесного в равновесное состояние ([16],
с. 107–111).
1 2
Рис. 8. Поперечная исчерченность растянутой мышцы, отравленной
монойодуксусной кислотой: 1 — в момент растягивания; 2 — через
1 час 40 минут после начала растягивания [15].
1 2
Рис. 9. Изменение поперечной исчерченности нормальной мышцы:
1 — до раздражения; 2 — после 15-минутного раздражения [15].
Если теперь перейти к свободной энергии F, то матема-
тическое выражение для изменения (интегрального) этой
функции состояния при переходе из живого неравновесного
в мертвое (равновесное) состояние будет:
,
37
Живая клетка.indb 37 27.10.2009 11:40:05](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-37-320.jpg)
![Клетка — элементарная единица живого
где F' — свободная энергия неживой (равновесной) систе-
мы, F — то же для живой (неравновесной) системы, Х и Х' —
суммарная работа, которая может быть выполнена живой си-
стемой, dx, dx' — работа за минимальный промежуток вре-
мени dt.
Когда живая система не выполняет внешней работы, вся
работа будет направлена на сохранение неравновесного со-
стояния живой системы. Что это означает и за счет каких
структурных факторов выполняется это соотношение, рас-
смотрим позднее.
Был период в изучении жизненных явлений, когда для
их объяснения привлекались представления о «живом бел-
ке». Бауэр убедительно доказывает, что «живой белок» не
существует. Для того чтобы понять эти явления, необходимо
привлекать физические и физико-химические науки. Он пи-
шет: «Итак, если до развития физической химии нельзя было
создать теорию живой материи, то применение этой науки,
в конце концов, доказало, что без углубленного познания
особенностей состояния живой материи непосредственно-
го применения физикохимии также недостаточно для объ-
яснения жизненных явлений». Отсюда следует, что объяс-
нить жизненные явления можно только тогда, когда сможем
понять, каково состояние молекул, из которых построено
живое.
Несмотря на то, что работы Бауэра были незаслуженно за-
быты на долгие годы, периодически можно найти серьезную
интерпретацию его взглядов. Наверное, наиболее глубоко это
осознал Токин [16] через 30 лет после выхода в свет книги Ба-
уэра. Токин не только подробно изложил суть взглядов Бауэ-
ра, но и, по возможности, учел достижения в физике и химии,
происшедшие за этот период времени. В частности, заслу-
живает внимания взгляд Токина на объяснения неравно-
весного состояния в живой системе. Он пишет: «Отсутствие
равновесия в живых системах обусловлено возбужденным
состоянием белковых молекул протоплазмы. Поддержание
38
Живая клетка.indb 38 27.10.2009 11:40:05](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-38-320.jpg)
![Клетка — элементарная единица живого
этого состояния обеспечивается процессом обмена веществ,
столкновениями второго рода между молекулами пищевых
веществ, ведущими к активации последних, а их химическая
энергия, освобождающаяся в реакции, используется для под-
держания активного, возбужденного состояния молекул жи-
вого вещества».
Прошло еще 28 лет. В 1993 г. к 100-летию со дня рождения
Бауэра был выпущен сборник научных трудов, посвященных
современным взглядам на его «Теоретическую биологию».
К сожалению, некоторые авторы оказались озабочены не раз-
витием закона, провозглашенного Бауэром, а поиском взгля-
дов и фактов, якобы противоречащих ему.
Шноль [17] пишет: «Вполне вероятно, что сам Э. С. Бауэр,
дожив до 60-х гг., отказался бы от излишне ригористическо-
го толкования своего принципа, увидев его иллюстрацию в
асимметричном, неравновесном, устойчиво поддерживаемом
распределении ионов в системе клетка—среда».
Во-первых, Бауэр формулирует не принцип, а закон. Сле-
довательно, закон должен либо выполняться, либо нет, но
тогда (в случае невыполнения) это не закон. Очень сомни-
тельно, чтобы Бауэр отказался от сформулированного им за-
кона. Скорее он нашел бы объяснения тем сотням фактов о
распределении ионов в системе клетка—среда.
Далее Шноль «отвергает» положение, что «сущность жиз-
ни» определяется особым физическим состоянием молекул:
белков, нуклеиновых кислот, углеводов, липидов, метаболи-
тов и т. д.
Удивляет категоричность утверждений автора: «особо-
го энергетического состояния молекул нет». Он считает, что
«все эти свойства более или менее выраженные, присущи и
заведомо небиогенным молекулам, структурам, системам».
Не стоит дальше вступать в полемику со Шнолем, тем более,
что заканчивает он свою статью пожеланием, чтобы новые
поколения исследователей обратили свое внимание на твор-
чество Бауэра.
39
Живая клетка.indb 39 27.10.2009 11:40:05](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-39-320.jpg)
![Клетка — элементарная единица живого
Хотелось бы вспомнить ситуацию с периодическим за-
коном, открытым Д. И. Менделеевым. Когда он открыл свой
закон, еще не было даже намека на сложную структуру ато-
ма. И то что периодичность определяется не величиной ато-
марной массы, а электронными орбиталями, квантованными
состояниями электронных облаков, энергетикой валентных
электронов стало известно более чем на полвека позже. Но
закон-то существует без умаления роли и значения, какое ему
придавал Дмитрий Иванович. Это свойство любого закона.
Еще один пример: закон Бойля—Мариотта для идеальных
газов, который гласит, что при постоянной температуре объ-
ем данной массы газа обратно пропорционален давлению, т. е.
pV = const. Мы знаем, что при сжатии или расширении это
соотношение будет неумолимо выполняться и ни у кого не
возникает сомнений, что сжатый газ, после снятия давления,
будет расширяться, а не сжиматься самопроизвольно. Таковы
свойства законов. Таким образом, приняв закон, сформули-
рованный Бауэром, в качестве основного биологического за-
кона, мы должны найти правила построения структур живой
клетки, как элементарной частицы живой субстанции.
Белоусов [18] хотя и критически относится к некото-
рым идеям Бауэра, в конечном счете, заявляет: «Все ска-
занное означает, что внутренний потенциал идей Бауэра о
структурно-конфигурационной неравновесности структур
живых систем отнюдь не исчерпан; более того, мы лишь се-
годня, и то ощупью, учимся его использовать, и видим, что
без него структурообразование в живых системах вряд ли
может быть понято».
Кондрашова [19], рассматривая энергетику рабочего акта
живой системы на примере энергетических состояний мито-
хондрий, считает, что энергетические состояния в них свя-
заны со структурной организацией мембран. Она считает,
что кинетические и структурные процессы в митохондриях
осуществляются благодаря тому, что сама органелла струк-
турно организована как физическое тело, т. е. представления
40
Живая клетка.indb 40 27.10.2009 11:40:05](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-40-320.jpg)
![Клетка — элементарная единица живого
о биохимических системах эволюционируют от растворов к
состоянию кристаллоподобных структур.
Цикл трикарбоновых кислот протекает в едином кон-
вейере, перерабатывающем дикарбоновые кислоты. Этот
конвейер получил название — метаболон. Все реакции цикла
осуществляются единым комплексом ферментов, осущест-
вляющим одновременно и реакции переаминирования. Этот
цикл получил название «быстрого цикла», в отличие от тех
же реакций, протекающих в препаратах, когда ткани повреж-
дены и ферменты перешли в раствор. Показано, что нативное
состояние митохондрий обеспечивает наибольшую скорость
протекающих в них ферментативных реакций.
Нельзя не остановиться на термодинамике живых орга-
низмов в соответствии с взглядами Бауэра. Провозглашая
постоянное сохранение живой системой неравновесного со-
стояния, Бауэр может считаться основоположником новой
области знания, которое в наши дни известно под названием
биологической неравновесной термодинамики, как считает
Аршавский [20].
Общепринятым является утверждение, что второй закон
термодинамики выполняется благодаря тому, что снижение
энтропии при образовании живых структур компенсируется
за счет того, что живые системы, будучи открытыми, увели-
чивают энтропию окружающей среды. Однако Бауэр считал,
что органические молекулы, в особенности молекулы белков,
находятся в ином состоянии, будучи встроенными в структу-
ру живой системы (например, клетки), чем тогда, когда они
находятся в изолированном виде (например, в растворе).
Аршавский пишет: «Данные наших исследований по-
зволили обратить внимание на истинную природу того, что
следует связывать с понятием структурной энергии, за счет
обратимой диссипации которой и осуществляется функция,
специфическая для той или иной клетки. Она не осуществля-
ется, как принято считать, непосредственно за счет энергии
расщепляющегося АТФ. Основная энергия АТФ затрачивает-
41
Живая клетка.indb 41 27.10.2009 11:40:05](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-41-320.jpg)
![Клетка — элементарная единица живого
ся, прежде всего, на создание и поддержание соответствую-
щей структуры, специфической для той или иной клетки».
Не повторяя далее выводов, к которым приходит Аршав-
ский, обсуждая закон, выведенный Бауэром, обратим внима-
ние еще на одно специфическое свойство живого — это асим-
метричность как в его молекулярно-структурном выражении,
так и в функциональном выражении — функция определяет
структуру, но не наоборот. Насколько это правильно, попро-
буем разобраться позднее.
Что можно сказать еще о предложении Бауэра, видевше-
го причину сохранения неравновесного состояния живой
системы в неравновесном «упругом» деформированном со-
стоянии макромолекул белка.
Согласно современным представлениям, молекулы «жи-
вого» функционального белка структурно (конформацион-
но) неравновесны.
Как пишет Блюменфельд [21]: «За счет избыточной
«структурной» свободной энергии этих молекул производит-
ся (обеспечивается) мышечное сокращение, преодолевается
потенциальный барьер в ходе биохимических превращений,
идут энергоакцепторные реакции. Умирание сопровождает-
ся диссипацией структурной энергии белка. Следует иметь в
виду, что это было написано задолго до начала эксперимен-
тальных и теоретических исследований конформационных
изменений биополимеров».
Чизмаджев и Блюменфельд излагают концепцию о кон-
формационной релаксации фермент–субстратных комплек-
сов [22]. На роль связывающих сил в процессах фермен-
тативных превращений молекул впервые указал в 1939 г.
Фейнман [23].
Участие конформационно-неравновесных состояний
ферментов доказано и при биоэнергетических процессах, со-
провождающих синтез АТФ [24].
Если рассматривать клетку как целое, следует остановить-
ся на временной организации клеточной структуры. Наибо-
42
Живая клетка.indb 42 27.10.2009 11:40:05](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-42-320.jpg)
![Клетка — элементарная единица живого
лее полно этот вопрос изучен Гудвином [25]. Он пришел к
следующему выводу (стр. 28): «Крупнейшими достижениями
в этой области является обнаружение часового механизма в
одиночной клетке и получение данных, свидетельствующих
о том, что существование часов или механизма отсчета вре-
мени, как универсального свойства клеточной организации,
является весьма вероятным».
Далее отмечается, что участники построения структуры
живой клетки не могут находиться в стационарном состоя-
нии даже тогда, когда клетка находится в покое, т. е. не растет,
не делится, не дифференцируется. Вещества клетки распада-
ются и вновь синтезируются. Возникает ситуация, когда не-
избежны колебания в системе. Гудвин даже считает, что для
клетки необходимо рассматривать не вообще температуру,
давление и т. д., а так называемые «таландические» (колеба-
тельные) температуру и давление. Даже если это не так, коле-
бательный характер процессов в живой клетке не подлежит
отрицанию [25, 26].
Нельзя не обратить внимания на удивительную упоря-
доченность биологических структур клетки, естественно,
и всей живой субстанции. Именно этот феномен позволил
Шредингеру [27] говорить о живом, как об «апериодиче-
ском кристалле». Если действительно наблюдать за процес-
сами, протекающими в биологических структурах, таких как
клеточное деление, морфогенез и филогенез, можно видеть
пространственную и временную упорядоченность всех про-
цессов. Но степень упорядоченности — это не что иное, как
энтропия системы и структура ее составных частей. Пытаясь
объяснить наблюдаемую упорядоченность, стали говорить
об «антиэнтропийных тенденциях» живой материи. Это,
естественно, не могло не вызывать возражений физиков по-
следующих поколений ([12], с. 19).
Все изложенное позволяет сформулировать первый по-
стулат:
43
Живая клетка.indb 43 27.10.2009 11:40:05](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-43-320.jpg)
![Клетка — элементарная единица живого
Живая клетка является неравновесной, высокострукту-
рированной, чрезвычайно динамичной элементарной едини-
цей живой субстанции. Вне клетки жизни нет.
Что же кроется за несомненной упорядоченностью био-
логических структур? Прежде всего, то, что биологическая
упорядоченность осмысленна. Как пишет Блюменфельд ([12],
с. 27): «Упорядоченность живой материи, информация, в ней
содержащаяся, имеют смысл. Смысл есть понятие телеоло-
гическое, осмысленно то, что имеет цель. Мышечные, нерв-
ные и другие клетки сердца расположены упорядоченно для
того, чтобы сердце могло функционировать так, а не иначе.
Молекулы различных белков и фосфолипидов в мембранах
митохондрий расположены упорядоченно для того, чтобы в
этих мембранах могли с высокой эффективностью протекать
процессы электронного транспорта и аккумуляции энергии».
Посмотрим, как же выглядит клетка при наблюдении ее с
помощью современных электронных микроскопов. На рис. 10
изображена обобщенная животная клетка, а на рис. 11 также
обобщенная растительная клетка ([28], с. 78). Легко видеть,
что это не «кристалл», как мы его представляем, но и не бес-
форменный раствор.
Не ставя перед собой цель рассмотреть функции каждой
органеллы клетки (это не входит в нашу задачу, тем более что
на рисунках указаны их наименования, а функции достаточно
полно изложены в цитируемой работе), обратим внимание на
наиболее упорядоченные органеллы. Прежде всего это ядро
и ядрышко. Здесь же можно ожидать (и это действительно
так) наибольшую кристалличность, поскольку структурные
блоки ядра построены из нуклеиновых кислот, элементарные
звенья которых, благодаря водородным связям, образуют
либо сдвоенные спиральные молекулы ДНК, либо одноните-
вые макромолекулы РНК, участвующие в биосинтезе белка
[12–14, 29–32], хотя согласно Коммонеру, это не единствен-
ный путь биосинтеза [33].
44
Живая клетка.indb 44 27.10.2009 11:40:05](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-44-320.jpg)
![Живая клетка.indb 45
45
Рис. 10. Ультраструктура обобщенной животной клетки, выявляемая при по-
мощи электронного микроскопа [28].
Клетка — элементарная единица живого
27.10.2009 11:40:05](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-45-320.jpg)
![Живая клетка.indb 46
46
Клетка — элементарная единица живого
Рис. 11. Ультраструктура обобщенной растительной клетки, выявляется при помощи
электронного микроскопа [28].
27.10.2009 11:40:05](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-46-320.jpg)
![Клетка — элементарная единица живого
На рис. 12 приведено изображение митохондрии на осно-
вании данных, также полученных с помощью электронного
микроскопа ([37] с. 48, 49).
Обращают на себя внимание факты, полученные Кондра-
шовой [36], по выделению в принятых условиях нативных
митохондрий. В этом случае митохондрии представляют со-
бой смесь одиночных гранул, сильно отличающихся от со-
стояния митохондрий в интактной клетке, где они образуют
либо ассоциаты, либо нитевидные образования. Это установ-
лено как начальными микроскопическими наблюдениями,
так и современной микроскопией с использованием флуо-
ресцирующих красителей, а также реконструкцией серийных
электронно-микроскопических срезов.
Переходы из состояния ассоциатов (агрегатов) в грану-
лы имеют место при переходе клетки из состояния покоя в
состояния возбуждения, а при заболеваниях наблюдается
распад агрегатов на мелкие гранулы. При этом естественно
будет неизбежно меняться структурное состояние и самих
митохондрий, ведущих превращения ди- и трикарбоновых
кислот. При возбуждении, как известно, стимулируется в
митохондриях энергетический метаболизм, являющий-
ся основной функцией этих частиц [35]. Нарушая натив-
ную структуру митохондрий, мы сразу же нарушаем взаи-
модействие переаминирования и дыхания, т. е. здесь, как
и в многочисленных данных, приводимых в других рабо-
тах, четко просматривается связь структуры и функции
в живой клетке.
М. Кальвин [34] приводит предполагаемую и обнаружи-
ваемую с помощью электронного микроскопа структуру мем-
бран хлоропластов растений. На рис. 13 (с. 50) изображена
модель мембраны, состоящей из агрегатов субъединиц. Как
считает Кальвин, такая модель является типичной для мем-
бран митохондрий, эритроцитов, нейронов и других объек-
тов растительного и животного происхождения.
47
Живая клетка.indb 47 27.10.2009 11:40:05](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-47-320.jpg)
![Клетка — элементарная единица живого
1 2
3 4
Рис. 12. Строение митохондрии [37]: 1 — митохондрия в целом на-
поминает наполненный жидкостью сосуд с заходящими внутрь
стенками; 2 — стенка митохондрии состоит из двойной мембра-
ны, причем складки внутренней заходят внутрь, образуя кристы;
3 — Каждая мембрана, по-видимому, состоит из ряда молекул белка
(белые кружки), за которыми располагается двойной слой липидных
молекул (черные кружки с отростками); 4 — переносчики электронов
и ферменты, входящие в дыхательную цепь (черные кружки), стро-
го упорядоченно распределены в мономолекулярном слое белка; «ма-
трикс» имеет жидкую консистенцию.
48
Живая клетка.indb 48 27.10.2009 11:40:05](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-48-320.jpg)
![Клетка — элементарная единица живого
Необходимо остановиться, хотя бы кратко, на строении
мембран клетки. По мере совершенствования и развития ме-
тодов микроскопии, в том числе электронной, к настоящему
времени основные черты строения этих органелл клетки до-
статочно подробно изучены. Уже на приводившихся ранее
рисунках видно, что мембраны образованы липидными мо-
лекулами в виде прежде всего бислойных блоков, в которые
вмонтированы белковые и гликолипидные молекулы, уча-
ствующие в диффузном, как принято называть «активном»,
транспорте органических и неорганических веществ к тем
или иным компартментам клетки.
Еще в позапрошлом веке была высказана идея о том, что
клетка в целом окружена липидной оболочкой. При этом ока-
залось, что липиды спонтанно образуют в воде протяженные
нити, в которых неполярные части липидных молекул обра-
щены внутрь бислоя, образуя как бы жидкую гидрофобную
область. Полярные же группы располагаются на поверх-
ности, образуя гидрофильные слои, которые контактируют
с водой [54, 55].
На рис. 14 (с. 51) изображена структура жидкостно-
мозаичной модели мембраны. Аналогичные представления
развивает Каприэлянц с сотр. [56], считающий, что мембрана
представляет собой двумерную жидкость, компоненты кото-
рой способны к тепловой диффузии. Очень важно оценить
диффузные возможности также белковых компонентов мем-
браны, что связано с динамичностью мембраны и с ее функ-
циональными возможностями, так как дыхательная цепь,
располагающаяся в мембранах, приобретает дополнительную
возможность устойчивого функционирования при переносе
электронов, обеспечивая синтез энергосберегающих соеди-
нений [57].
Говоря о связи между АДФ и конформационными изме-
нениями в субмитохонриальных частицах, Сакс с сотрудни-
ками [58] констатируют, что внутренняя часть митохондри-
альной мембраны меняется с изменением функционального
49
Живая клетка.indb 49 27.10.2009 11:40:05](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-49-320.jpg)
![Клетка — элементарная единица живого
Рис. 13. Структура мембраны хлоропластов ([34], с. 125).
50
Живая клетка.indb 50 27.10.2009 11:40:05](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-50-320.jpg)
![Живая клетка.indb 51
51
Рис. 14. Трехмерное изображение жидкостно-мозаичной модели мембраны [28]. Глико-
протеины и гликолипиды связаны только с наружной поверхностью мембраны.
Клетка — элементарная единица живого
27.10.2009 11:40:05](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-51-320.jpg)
![Клетка — элементарная единица живого
состояния системы окислительного фосфорилирования [59,
60]. Этот факт послужил основой для предположения о
конформационно-конфигурационном механизме преобра-
зования энергии [61]. Это предположение может быть под-
тверждено данными электронной микроскопии, исследо-
ванием светорассеяния и дисперсии оптического вращения
суспензии митохондрий, находящихся в разных метаболиче-
ских состояниях [60].
Важная информация об изменениях в структуре мито-
хондриальных мембран получена при регистрации флуо-
ресценции [52] или сигналов электронного парамагнитного
резонанса [46] ряда специфических соединений, которые ад-
сорбируются на мембранах. Эти методы позволяют судить об
изменении надмолекулярной организации мембран в целом.
Благодаря столь сложному строению мембран осущест-
вляется их участие в регуляции процессов, протекающих
в живой клетке, в том числе в митохондриях.
Интересные результаты были получены Кондрашо-
вой [35, 36] при изучении циклов превращений различных
субстратов: углеводов, липидов белков. Все эти соединения
в митохондриях проходят через универсальную последова-
тельность превращений дикарбоновых кислот. Если мито-
хондрии сохраняют свою нативную структуру, имеет место
взаимодействие переаминирования и дыхания. Это взаимо-
действие утрачивается, если происходит повреждение мито-
хондрий.
В последнее время быстрыми темпами накапливались
экспериментальные факты, свидетельствующие о том, что
фундаментальную роль в регуляции внутриклеточных про-
цессов играют мембраны, разделяющие клетку на изолиро-
ванные отделы, выполняющие специфические функции. При
этом мембранам приписывается роль в создании различных
градиентов Н+ , Na+, Cа++.
Шабадаш [38] отмечает кроме того, что существует тесная
связь между структурными и функциональными изменения-
52
Живая клетка.indb 52 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-52-320.jpg)
![Клетка — элементарная единица живого
ми митохондрий с общеклеточными реакциями, при этом
имеет место ясно выраженная автономность и авторегуля-
торность самих митохондрий.
Наиболее полно и обстоятельно этот вопрос изложен
Скулачевым [39]. Все это было бы прекрасно, если бы не один
вопрос, на который фактически в монографии Скулачева нет
ответа — каков механизм и каким образом управляются мем-
браны, создавая нужные для клетки потенциалы?
Близко к решению этого вопроса на основании экспери-
ментальных данных подошел А. Ленинджер [40], считающий,
что проницаемость мембран и их изменения связаны с кон-
формационными изменениями митохондриальных мембран.
При этом «механохимические» (как он их называет) измене-
ния митохондриальных мембран при поглощении и вытал-
кивании воды митохондриями тесно связаны с образованием
АТФ при окислительном фосфорилировании.
Казалось бы простой процесс — набухание и выталки-
вание воды. В действительности же он носит сложный ха-
рактер и зависит от содержания АТФ, ионов Са++, Мg++,
гормонов, разобщителей дыхания, типа динитрофенола, ти-
роксина и др. Еще дальше в своих исследованиях идет П. Мит-
челл [41], согласно которому не только изменения в обмене
веществ могут вызвать изменения в процессах переноса, но
и перенос в свою очередь влияет на обмен веществ, если про-
цесс переноса ионов и обмен веществ представляют собой
цепь последовательных реакций и изменений.
На примере митохондрий показано [45], что процесс набу-
хания связан с перестройкой конформационного состояния
компонентов, изменением структуры самих митохондрий,
потерей их упорядоченности при участии солей щелочных
металлов и сопровождался гидролизом АТФ. На различных
стадиях набухания обнаруживалось влияние антибиотиков
типа грамицидина D.
В конечном счете, мы так или иначе наблюдаем различные
аспекты одного и того же процесса — направленного обмена
53
Живая клетка.indb 53 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-53-320.jpg)
![Клетка — элементарная единица живого
веществ. Остается найти механизм, управляющий этим про-
цессом.
Нельзя не упомянуть о работе, проведенной А. Б. Рубиным
с сотр. [42], посвященной модификации конформационного
состояния макромолекул и мембранных комплексов из хлоро-
пластов высших растений. Если провести мягкую фиксацию
низкими концентрациями глутарового альдегида, образую-
щего меж- и внутримолекулярные сшивки за счет взаимодей-
ствия с аминогруппами боковых цепей лизина, SH-группами
цистеина, что соответственно приводило к снижению кон-
формационной подвижности мембранных структур, то при
этом наблюдается подавление всех процессов, связанных
с трансформацией энергии.
Ни один процесс, связанный со структурными перестрой-
ками, сохранением структуры, перемещением веществ из
клетки в клетку или из клетки в окружающую среду и в об-
ратном направлении, не обходится без АТФ.
Рубин отмечает, что высокоэффективный направленный
транспорт электронов сопряжен с колебательными и конфор-
мационными изменениями в белковой матрице. Отмечается
также то, что прочность и число водородных связей влияют
на скорость конформационных перестроек в белках, в их ре-
акционных центрах. Это неизбежно меняет скорость пере-
носа электронов. Так или иначе мы сталкиваемся с фактами
взаимного влияния структурных (чаще всего конформаци-
онных и конфигурационных изменений) с функциональной
деятельностью клеток и их органелл.
Микельсааром [43] предложена гипотетическая модель
мембраны, согласно которой основная часть мембраны пред-
ставлена сложными с химической точки зрения сферически-
ми протеиновыми глобулами. Эти белковые частицы имеют
гидрофобный полюс, благодаря которому они агрегируются
через ди-, три- и тетрамеры в бислойную липидную мембра-
ну. Отмечается, что глобулы собраны в тетраэдры с общими
гидрофобными зонами.
54
Живая клетка.indb 54 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-54-320.jpg)
![Клетка — элементарная единица живого
1
2 3
Рис. 15. Различные типы организации мембранных белков [43]:
1 — белок почти полностью погружен в мембрану. Полипептидная
цепь пресекает мембрану несколько раз, образуя α-спиральные колон-
ны; 2 — сравнительно небольшая гидрофобная часть белка погруже-
на в мембрану, пересекая всю ее толщину. Большая (гидрофильная)
часть белка экспонирована в воду; 3 — гидрофобный «якорь» белка
проникает только на расстояние фосфолипидного монослоя.
Изучая процесс переноса электронов в дыхательной
цепи, В. Н. Лузиков, В. А. Сакс [44] наряду с другими авто-
рами установили, что этот процесс сопровождается конфи-
гурационными изменениями митохондральных мембран, что
так и данными, полученными при регистрации светорас-
сеяния и дисперсии оптического вращения суспензии ми-
тохондрий [62], находящихся в разных метаболических со-
стояниях. Ценную информацию об изменениях в структуре
митохондрий дает регистрация флуоресцентных спектров
или сигналов электронного парамагнитного резонанса [46].
55
Живая клетка.indb 55 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-55-320.jpg)
![Клетка — элементарная единица живого
Говоря о важности стерического фактора в общем ком-
плексе факторов, обеспечивающих связь отдельных ком-
понентов дыхательной цепи, Микельсаар отмечает, что те-
траэдрическое расположение компонентов специфической
дыхательной цепи обеспечивает теснейшие контакты между
простетическими группами переносчиков электронов.
Вопрос о функциях и строении мембран прекрасно из-
ложен в монографии С. А. Нейфаха [47] с использованием
экспериментальных данных, накопленных в литературе уже
к концу 60-х гг. прошлого столетия. Обращает на себя вни-
мание подробное изложение принципов построения мем-
бранных структур. Во-первых, мембраны — это трехслой-
ные белково-липидные образования мицелярной природы.
Липидно-протеидные комплексы отделены друг от друга бел-
ком, при этом белковые слои непосредственно соприкасают-
ся друг с другом с образованием электростатических, поля-
ризационных и гидрофобных связей. Если в структуре имеет
место максимальное число связей между белком и липидом,
то такая структура наиболее устойчива.
Нейфах пишет: «Белковый состав мембраны является
основой для данной мембраны. Однако и белковая органи-
зация мембран несет на себе черты, свойственные всем мем-
бранам. Все клеточные мембраны имеют в своем составе си-
стемы, обеспечивающие транспорт веществ через мембрану.
Энзиматическая природа этих систем в настоящее время не
подлежит сомнению».
Мембранный механизм переноса веществ основан на не-
посредственном перемещении тех или иных соединений при
участии ферментов самих мембран при обязательной подаче
энергии. С помощью этого механизма перемещаются незаря-
женные молекулы, а также органические и неорганические
ионы, несущие те или иные заряды. Мембранный транс-
порт является направленным, т. е. вещества перемещаются
в нужном направлении для достижения определенной цели.
В конечном счете происходит направленное перераспределе-
56
Живая клетка.indb 56 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-56-320.jpg)
![Клетка — элементарная единица живого
ние веществ. Это достигается путем «выталкивания» веществ
одними органоидами и поглощение их другими. Оба процес-
са, возможно, направлены на регулирование какого-либо
определенного превращения, например, на нормализацию
уровня АТФ в клетке ([47], стр. 49). Эти акты должны быть
согласованы и совпадать во времени.
Каким же образом органоиды «узнают», следует ли им
выталкивать или поглощать те или иные вещества? Если мы
допустим существование в клетке своеобразной системы
управления, то тогда мы должны признать существование
целой цепи элементов: чувствительный элемент на входе на-
чала связи, исполнительный элемент на выходе, запоминаю-
щее устройство и т. д. Напоминаем, что все эти процессы и
элементы должны обладать свойством авторегуляторности.
Заслуживает внимания представление Нейфаха ([47],
с. 20) о надмолекулярных комплексах. Он пишет: «Надмоле-
кулярная организация — это не приходящее искусственно
полученное состояние, а закономерная категория, характе-
ризующая строение вещества живых организмов. Подобно
молекулам и атомам, надмолекулярные комплексы имеют по-
стоянный размер и состав, их масса характеризуется посто-
янной величиной молекулярного веса, их структура удержи-
вается определенными силами взаимодействия».
Предполагается, что надмолекулярные комплексы обла-
дают энзиматической активностью и ферменты, расположен-
ные в них, представляют собой мультиэнзимные комплексы
([47], с. 27).
В качестве примера приводится состав пируватдегидроге-
назы, куда входят 16 молекул декарбоксилазы (молекулярный
вес 1,8·105 к.e.), 64 молекулы редуктазы — трансацетилазы
(молекулярный вес 1,1·105 к.e.), липоевая кислота (12 ммкМ),
флавин (3 ммк на 1 мг белка). Молекулярный вес комплекса
приблизительно 5 млн единиц.
Фернандес-Морган и Рид с сотр. [48], учитывая совокуп-
ность экспериментальных данных, предложили структуру
57
Живая клетка.indb 57 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-57-320.jpg)
![Клетка — элементарная единица живого
надмолекулярной организации комплекса пируватдегидроге-
назы (рис. 16). С одной стороны, такой комплекс позволяет
плотно упаковывать ферменты, ведущие взаимосвязанные
превращения субстратов, и осуществлять принцип плотной
упаковки органических молекул, о чем речь пойдет ниже.
Аналогичным образом построены и митохондриальные мем-
браны, где локализуется пируватдегидрогеназный комплекс.
В целом белковые, липидные и другие молекулы расположе-
ны в мембранах регулярно и удерживаются несколькими ти-
пами в основном слабых связей, которые придают мембранам
определенную устойчивую конфигурацию.
Рис. 16. Модель надмолекулярной организации пируватдегидрогеназы:
64 протомера редуктазы-трансацетилазы липоевой кислоты образу-
ют центральный тетраэдр, состоящий из маленьких сферических тел;
вокруг нее расположены в виде двух колец (одно над другим) 16 протоме-
ров декарбоксилазы пирувата (большие сферы) и 8 протомеров дегидро-
геназы дигидролипата (средние сферы) [48].
Исследование светорассеяния изолированных митохон-
дрий показало, что структурные блоки остаются неизмен-
ными — они претерпевают обратимые конформационные
превращения-осциляции. Пэкер установил [49], что такого
рода осцилляции имеют место при небольшом изменении со-
става среды. При этом осциллирует как митохондрия в целом
(набухание—сокращение), так и их функциональное состоя-
ние (перенос электронов, окислительное фосфорилирование,
аккумулирование ионов [57, 58,59]).
58
Живая клетка.indb 58 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-58-320.jpg)
![Клетка — элементарная единица живого
Наблюдаемые осцилляции, возникнув, постепенно за-
тухают. Это, как считает Нейфах ([47], с. 61), связано с тем,
что сдвиги в системе под воздействием внешних факторов
(рН, осмотический фактор, ионный состав, кислород, АТФ)
приводят к изменениям всей ферментативной системы, даже
если начинаются изменения с воздействия на один фермент,
т. е. система отвечает кооперативно. Имеет место неспецифи-
ческий ответ системы, аналогичный ответу по Насонову и
Александрову [50]. Но в конечном счете регулирование всей
клеточной системы так или иначе связано со специфически-
ми надмолекулярными комплексами.
Наглядная картина (рис. 17, 18), характеризующая изме-
нения в митохондриях при изменении метаболических со-
стояний, была получена Чансом [53]. Оказалось, что при пе-
реходе из состояния покоя в активное состояние имеет место
критический переход, сопровождающийся глубокими пере-
стройками всей структуры митохондрий, которые переходят
к активному дыханию, благодаря добавлению к среде АДФ —
при этом внутренняя мембрана митохондрий сокращается,
становится более «электронноплотной».
Рис. 17. Электронно-микро-
скопическое изображение пе-
ченочных митохондрий после
15-минутной инкубации в
условиях метаболического со-
стояния [53].
В данном случае видно, что конформационное и конфи-
гурационное превращения дыхательных переносчиков бла-
годаря дальнодействию,быстро распространяется и превра-
щается в сложный механохимический акт, изменяющий всю
структуру митохондрии. И здесь мы наблюдаем взаимосвязь
структуры и функции органелл клетки (см. также [60,62]).
59
Живая клетка.indb 59 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-59-320.jpg)
![Клетка — элементарная единица живого
Рис. 18. Такой же образец митохондрий, как и на рис. 17, фиксиро-
ванный через 35 секунд после того, как были переведены добавле-
нием АДФ из состояния покоя в активное состояние [53]. Видна
глубокая перестройка внутренней структуры — внутренняя мем-
брана резко сокращена, уплотнена, матрикс конденсирован, слился
с гребнями (Х 50000).
Заканчивая изложение известных экспериментальных
фактов, характеризующих организацию и функционирова-
ние живых клеток и составляющих их блоков, надмолеку-
лярных образований и органелл, остановимся еще на одной
органелле — лизосоме, которая обнаруживается с помощью
электронного микроскопа в животных клетках (см. рис. 19).
Наиболее обстоятельно описание лизосомы приведено в
работах де Дюва [63]. По его представлениям, лизосомы вы-
глядят как крошечные мешочки, содержащие ферменты, спо-
собные «переваривать» вещества или частицы, попадающие
внутрь мешочков. По аналогии со сложными организмами
роль лизосом сводится к расщеплению полимерных молекул
и мономеров и включению их в обменные процессы, осущест-
вляемые другими органеллами клетки, т. е. лизосомы являют-
ся своего рода пищеварительным трактом клетки. Лизосомы
наделены специфической мембраной, на которую ферменты,
содержащиеся в лизосомальной жидкости, не действуют.
Если мембрана будет разрушена, то ферменты лизосом в со-
стоянии переварить всю клетку. Знаменательно, что лизосо-
мы особенно многочисленны в таких клетках, как макрофаги
60
Живая клетка.indb 60 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-60-320.jpg)
![Клетка — элементарная единица живого
и лейкоциты, которые предназначены для переваривания по-
сторонних включений. Схема поэтапного функционирова-
ния лизосомы и градация лизосом представлены на рис. 19.
В подписи к рисунку приведено описание процесса «пере-
варивания», как это представляется де Дюву ([63], с. 212–213).
Некоторые клетки способны выделять ферменты лизосом
наружу, что приводит к разрушению соседних структур. На-
пример клетки, способные разрушать костную ткань (остео-
класты), вместе с клетками, образующими костную ткань,
ведут перестройку костной ткани. Даже в процессе оплодо-
творения предполагается участие лизосом в разрушении не-
которых структур, окружающих яйцеклетку и в конце концов
способствующих перестройке внутриобменных процессов в
яйцеклетке, обеспечивая развитие и дифференцировку.
Кроме того у многоклеточных организмов возможны по-
вреждение и гибель клетки под действием лизосом, что по-
зволяет организму избавляться от мертвых клеток. В общем
и целом, лизосомы клеткам необходимы, чтобы поддержи-
вать устойчивое функционирование в здоровом состоянии
и участвовать в удалении мешающих компонентов при па-
тологических процессах. Вполне возможно, что для защиты
от лизосомальных ферментов в клетках имеется система,
состоящая из убихитина-протеосомы, защищающая клетку
от гибели [64, 65]. Возвращаясь к вопросу о равновесности-
неравновесности живого состояния, видимо, следует при-
знать, что лизосома, в отличие от других органелл, находится
в равновесном состоянии, по крайней мере, ее жидкая часть.
Пора сформулировать второй постулат, характеризую-
щий живое состояние клетки:
Структурные блоки (надмолекулярные образования) об-
ладают многофункциональностью за счет входящих в их со-
став специфических катализаторов — ферментов. Каждый
из блоков может выполнять две-три и возможно более функ-
ций, структурно связанных между собой настолько тесно,
61
Живая клетка.indb 61 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-61-320.jpg)
![Живая клетка.indb 62
62
Клетка — элементарная единица живого
Рис. 19. Типы лизосом и их функционирование [63].
Лизосомы различным образом участвуют во внутриклеточном переваривании. Следует различать четыре
вида лизосом: «запасающие гранулы, пищеварительные вакуоли, остаточные тельца и аутотрофирующие
вакуоли». Запасающая гранула — это исходная форма лизосомы, содержащиеся в ней ферменты образуются,
видимо, в рибосомах, связанных с эндоплазматической сетью. Когда клетка заглатывает вещества, обра-
зуется фагосома. Запасающая гранула или другая лизосома сливается с фагосомой, образуя пищеваритель-
ную вакуоль. Продукты переваривания диффундируют через мембрану в клетку. Пищеварительная вакуоль
продолжает функционировать, постепенно накапливая неперевариваемые вещества, пока не превратится в
остаточное тельце, которое исчезает при слиянии с клеточной мембраной.
27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-62-320.jpg)
![Клетка — элементарная единица живого
что любое воздействие из внешней среды приводит к неспец-
ифическому ответу клетки в целом.
Итак, мы столкнулись с ситуацией, когда специфические
процессы в живых клетках так или иначе связаны с неспеци-
фическим ответом клетки на повреждающие воздействия.
Остановимся теперь на нашей работе, проведенной в кон-
це 1960-х и начале 1970-х гг. [66, 67], посвященной изучению
поведения эритроцитов мышей под воздействием специфи-
ческих повреждающих воздействий, в качестве каковых были
выбраны повреждающие действия ионов ртути и кадмия, а
также йодуксусной кислоты.
Было решено фиксировать изменения в эритроцитах по
нескольким направлениям. Известно, что в присутствии
двухвалентных ионов ртути осмотическая резистентность
эритроцитов снижается [68, 69]. Причиной гемолиза являет-
ся, видимо, связывание ионами ртути SН-групп клеток [70,
71]. В то же время показано, что под действием гемолитиков
лизису предшествуют изменения формы эритроцитов типа
диск-сфера [72]. Уже тогда было показано, что изменения
формы эритроцитов связаны с содержанием АТФ (аденозин-
трифосфорной кислоты), точнее с ресинтезом и распадом
этого соединения [74, 75]. Одновременно следует заметить,
что от уровня АТФ зависит сродство гемоглобина эритроци-
тов к кислороду, т. е. функциональная активность эритроци-
тов [76].
Учитывая то, что низкие концентрации ионов двухва-
лентной ртути ингибируют гликолитический распад глюко-
зы [77, 78], было целесообразно как можно более полно ис-
следовать воздействие ионов ртути на эритроциты. Это было
осуществлено нами, хотя не было возможности произвести
измерение содержания АТФ при действии этого яда. Так
как самым близким по положению в периодической системе
Д. И. Менделеева является кадмий, можно было сопоставить
действие ионов ртути и кадмия на эритроциты. Мы восполь-
63
Живая клетка.indb 63 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-63-320.jpg)
![Клетка — элементарная единица живого
зовались методикой, предложенной Накао с сотр. [74], что-
бы перевести морфологические изменения эритроцитов на
количественную основу. Суть методики заключается в том,
что каждой форме, наблюдаемой на микрофотографиях в
фазово-контрастном микроскопе, придается определенное
численное значение (рис. 20).
1,0 0,8 0,6
0,4 0,2 0,0
Рис. 20. Микрозарисовки эритроцитов мышей в процессе их превра-
щений «диск—сфера» [66]. Цифры внизу — принятые коэффициен-
ты для расчета морфологического индекса. Первый ряд — вид сверху;
второй — вид сбоку.
Не вдаваясь далее в подробности экспериментов, рассмо-
трим полученные результаты. На рис. 21 представлены дан-
ные по изучению влияния ионов ртути и кадмия на выход
гемоглобина из эритроцитов в изотонической среде. Прежде
всего видно, что эритроциты, не подвергавшиеся дополни-
тельным повреждающим воздействиям (хранение на холоде,
центрифугирование), значительно более чувствительны к ио-
нам ртути, чем к ионам кадмия.
64
Живая клетка.indb 64 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-64-320.jpg)
![Клетка — элементарная единица живого
Пороговая концентрация для ионов ртути составляла
примерно 5·10-5 М, хотя в зависимости от исходного состоя-
ния эритроцитов эта концентрация существенно менялась.
Ионы кадмия вызывали аналогичный эффект при концен-
трации в 100 раз большей.
Рис. 21. Кривые изменений морфологического индекса (1), гемолиза (2 и
3) и оседания эритроцитов (4) под действием ртути (а) и кадмия (б) в
течение 1 часа [67]. По оси абсцисс — концентрация (в М) ртути (а) и
кадмия (б); По оси ординат — изменения (в %) морфологического индекса
(1); количество гемоглобина, вышедшего из эритроцитов (2); количество
эритроцитов, полностью потерявших гемоглобин (3), и оседание эритро-
цитов (4). Гемоглобин определяли спектрофотометрически.
Наблюдаемые различия видимо объясняются различиями
физических и химических свойств этих двух элементов. Хотя
оба элемента заключают вставные декады 5-го и 6-го перио-
дов таблицы Менделеева и имеют завершенные d и s элек-
тронные слои, соответственно, по ряду свойств достаточно
они близки между собой. Однако имеются и различия в их
поведении.
В данном случае наиболее существенным является то,
что в соединениях связь Εl—Нg менее лабильна, чем Εl—Сd
(в качестве El чаще всего выступает атом серы). Различно
также поведение ионов ртути и кадмия в водных растворах.
Так, с помощью спектров комбинационного рассеяния света
было показано [80], что аквакатион ртути слабее взаимодей-
ствует с ионами гидроксония, чем аквакатион кадмия.
65
Живая клетка.indb 65 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-65-320.jpg)
![Клетка — элементарная единица живого
Помимо количественных отличий в действии ионов этих
двух металлов, следует обратить внимание на то, что процесс
гемолиза вообще протекает по-разному. Так, если в присут-
ствии ионов кадмия под микроскопом видны обрывки стро-
мы, бесформенные скопления оболочек эритроцитов, иногда
даже «разламывающиеся» эритроциты, то в присутствии ио-
нов ртути тени эритроцитов оставались сферическими, без
видимых (под обычном микроскопом) нарушений их целост-
ности.
Эти наблюдения позволяют прийти к выводу, что под дей-
ствием ионов ртути в мембранах, сохраняющихся в целом,
поры, через которые гемоглобин выходит в окружающую
среду, расширяются, тогда как под действием ионов кадмия
мембраны эритроцитов становятся, по-видимому, жесткими
и легко разрушаются, что и сопровождается выходом гемо-
глобина.
Причиной расширения пор в мембранах под действием
ионов ртути, возможно, является активация гидролаз, имею-
щихся в эритроцитах. Основанием для такого предположе-
ния служит то, что двухвалентная ртуть активирует некото-
рые лизосомальные гидролазы [81]. При этом оптимальный
эффект достигается при концентрации ионов ртути 3·10-5 М,
что по порядку величины совпадает с гемолитическими поро-
говыми концентрациями, найденными в нашей работе. Кро-
ме этого, активацию гидролаз предотвращают такие соеди-
нения, как метатион, β-меркатоэтаноламин, α-цистеин, т. е.
те же соединения, которые снижают гемолиз под действием
ионов ртути, что подтверждается и нашими наблюдениями.
Выше мы уже отмечали, что форма эритроцитов зависит
от ресинтеза и распада АТФ [78]. Таким образом активация
фосфатаз, а значит и распад АТФ неизбежно приведут к сни-
жению содержания этого соединения и к изменению формы
эритроцитов из дискоидных в сферические. Отсутствие ла-
тентного периода (см.рис. 21) при действии ионов ртути в
пороговых концентрациях является дополнительным под-
66
Живая клетка.indb 66 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-66-320.jpg)
![Клетка — элементарная единица живого
тверждением того, что в данном случае ионы ртути влияют
либо на ресинтез АТФ, либо на распад этого макроэрга [76].
Увеличение степени гемолиза под действием низких кон-
центраций ионов ртути (10-6–10-5 М) на эритроциты, мор-
фологический индекс которых снижен под действием таких
неспецифических воздействий, как центрифугирование или
хранение на холоде, можно объяснить тем, что названные
факторы сами по себе меняют проницаемость мембран эри-
троцитов. Уже давно было показано [82], что трехкратное
центрифугирование приводит к потере около 15% внутриэ-
ритроцетарного калия. Не исключено, что действие ионов
ртути в низких концентрациях обусловлено в первую очередь
замедлением синтеза АТФ, так как в данном случае изменение
формы эритроцитов и их гемолиз протекает с определенным
латентным периодом (1–2 часа).
Чем вызвано столь подробное ознакомление с изучением
поведения эритроцитов? Дело в том, что эритроцит являет-
ся идеальной экспериментальной моделью для изучения по-
вреждающих воздействий на живую клетку. Во-первых, он со-
храняет свое живое состояние, свою структуру и форму, свой
метаболический обмен, функциональное состояние длитель-
ное время при соблюдении определенных внешних условиях,
что нетрудно реализовать. Известно, что кровь для перелива-
ния может храниться не один десяток дней при оптимальных
условиях хранения. По-видимому, не последнюю роль в под-
держании уровня АТФ, также как и других пуриновых произ-
водных, в эритроцитах человека играют процессы не только
синтеза, но и ресинтеза.
Путь метаболизма, в том числе ресинтеза и катаболизма,
подробнейшим образом исследован польскими учеными в
самое последнее время [83]. К сожалению, авторы не связы-
вали процесс метаболизма эритроцитов с их формой, отра-
жающей общее состояние клеток (в данном случае эритроци-
тов). Какие выводы можно сделать из наших экспериментов и
литературных данных?
67
Живая клетка.indb 67 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-67-320.jpg)
![Клетка — элементарная единица живого
1. Сохранение формы (дискоидной) живых эритроцитов
зависит в первую очередь от метаболизма клеток, от синтеза,
ресинтеза АТФ, значит, от концентрации этого соединения.
2. Повреждающие специфические воздействия (дей-
ствие ядов) и неспецифические (центрифугирование, хране-
ние на холоду) ведут к переходу эритроцитов из дискоидных
в сферические.
3. Изменение формы «диск—сфера» через промежуточ-
ные «искаженные» кренированные формы сопровождается
выходом гемоглобина из эритроцитов, т. е. повреждающие
воздействия нарушают одновременно и проницаемость мем-
бран клеток и форму клеток. При этом ртуть и кадмий дей-
ствуют неодинаково. Сферические эритроциты лишены ге-
моглобина. Они равновесны и мертвы.
В последнее время появились работы [84, 85] по иссле-
дованию деформируемости эритроцитов путем фильтрации
их через никелевые сита с величиной пор 4,59 мкм. Наблю-
дается снижение деформируемости (увеличение жесткости
мембран эритроцитов) при воздействии на клетки карбонил-
содержащих соединений (DL-глицеральдегида, глиоксаля,
гликольальдегида, 3-дезоксиглюкозона и D-глюкозы). Наи-
больший эффект — при воздействии первых двух соедине-
ний. Эти же соединения наиболее интенсивно реагируют с
гемоглобином. Авторы делают вывод, что снижение дефор-
мируемости вызывается взаимодействием карбонилсодержа-
щих соединений с белками, т. е. и в этом случае имеет место
неспецифический ответ клетки на воздействие окружающей
среды. Обнаруженные факты интересны с медицинской точ-
ки зрения, так как снижение деформируемости наблюдается
при патологических состояниях, например при диабете.
Методами спиновых зондов и сканирующей электронной
микроскопии рядом авторов [86] изучалось влияние синте-
тических антиоксидантов и биорегуляторов — производных
5-гидроксибензимидизола (5-ГБИ) на структуру мембран
эритроцитов и морфологию эритроцитов. Анализируя спек-
68
Живая клетка.indb 68 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-68-320.jpg)
![Клетка — элементарная единица живого
тры ЭПР и электронные микрофотографии, авторы уста-
новили, что производные, содержащие боковые заместите-
ли, различающиеся по гидрофобным свойствам, способны
оказывать концентрационно-зависимое модифицирующее
действие на структурную организацию плазматической
мембраны эритроцитов и одновременно менять их форму.
В интервале концентраций 10-7–10-3 М (обратите внимание на
действующие концентрации ионов ртути и кадмия) все из-
ученные соединения проявляют эхиноцитогенное действие
(так авторы называют кренирующее действие соединений).
Наиболее четко последний эффект наблюдается у соедине-
ния, содержащего в качестве боковых заместителей в поло-
жении 2 и 5 бензильную и этоксигруппу соответственно.
Рис. 22. Электронные микрофотографии эритроцитов крови крыс в
присутствии 2-бензил-5-гидроксибензимидазола в концентра-
ции 1⋅10 -3 М [86]. Увеличение умножить на 1000 и умножить на 3000
для левой и правой частей снимка соответственно.
Результаты проведенных авторами экспериментов свиде-
тельствуют о том, что при проникновении в эритроцитарную
мембрану наиболее гидрофобных производных 5ГБИ, струк-
тура мембраны модифицируется, а это приводит к еще более
интенсивному проникновению этого соединения во внутри-
мембранное пространство. Это позволило предположить,
что такое проникновение приводило к изменению морфоло-
гии эритроцитов.
На рис. 22 представлены эритроциты после воздействия
на них 5-гидрокси-2-бензилимидазола в концентрации
69
Живая клетка.indb 69 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-69-320.jpg)
![Клетка — элементарная единица живого
1⋅10-3 М. Четко просматриваются эритроциты, форма кото-
рых ничем не отличается от наблюдавшихся нами крениро-
ванных эритроцитов под действием тяжелых металлов. Не
вдаваясь далее в механизм сохранения и изменения формы
эритроцитов, отметим еще раз неспецифичность процесса
перехода их от дискоидных к кренированным формам.
Обсуждая свойства, структуру и функционирование жи-
вых клеток, нельзя не остановиться еще на одном их свойст-
ве — непрерывном движении внутреннего содержимого
клетки. Сказать лучше, чем Франк и Астахова ([87], с. 19),
вряд ли возможно: «Клетки беспрерывно меняют очертания,
структуру на разных уровнях своей организации. Иногда
подвижность клеток производит впечатление непрерывно-
го кипения. Протоплазма движется, резко меняя скорость,
и даже приостанавливается при раздражении. Маленькие
митохондрии, видимые в обычном микроскопе в виде зер-
нышек или палочек, проделывают змееобразные движения и
меняют объем. Изменяет свой объем и ядро — оно пульсиру-
ет, то сжимаясь, то расширяясь». Обстоятельно этот вопрос
рассмотрен в монографии Камии [88]∗. Прежде всего автор
проводит следующую классификацию типов движения:
Колебательные движения, этот тип движения наименее
упорядочен, хотя и наиболее распространен. Встречаются
у других авторов и другие наименования: «скользящее дви-
жение», «отклоняющееся движение», «беспорядочное дви-
жение». При этом типе движения протоплазмы некоторые
частицы находятся в покое, некоторые скользят по направле-
нию к центру клетки, другие — к периферии. Движение имеет
неустойчивый и случайный характер. Однако это движение
не настолько беспорядочно, как броуновское движение, и в
его основе лежат совершенно различные причины — броу-
новское движение обусловлено тепловым колебанием моле-
∗ Ссылки на оригинальные работы по этому вопросу читатель найдет
в цитируемой монографии.
70
Живая клетка.indb 70 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-70-320.jpg)
![Клетка — элементарная единица живого
кул, тогда как колебательное движение протоплазмы вызы-
вается энергией, освобождающейся в процессе метаболизма.
Частички при этом скользят в 2 раза дальше, чем при броу-
новском движении, хотя совершенно ясно, что вязкость про-
топлазмы выше, чем вязкость любого раствора.
Циркуляционное движение характерно для клеток,
имеющих протоплазматические тяжи, пересекающие цен-
тральную вакуоль. Кюстер (цитир. по [88], с. 14), изучая цир-
куляционное движение, описал поведение гранул, которые
находятся либо внутри, либо на поверхности протоплазма-
тического слоя, прилегающего к клеточной стенке, а также
в тяжах, пересекающих вакуоль. Например, диаметр зерен
крахмала, движущихся по протоплазматическим тяжам, в
противоположном направлении может быть больше диаме-
тра тяжей, тогда при столкновении либо одно зерно начинает
двигаться назад, либо оно «уступает дорогу» другому. Мел-
кие гранулы «микросомы» разных размеров, даже находясь
в непосредственной близости друг от друга, движутся с раз-
ной скоростью и в разных направлениях, что свидетельству-
ет о большой сложности движения протоплазмы. Частицы,
движущиеся с разной скоростью, при встрече продолжают
двигаться каждая со своей скоростью. При циркуляционном
движении и тяжи, пересекающие вакуоль, также непрерывно
изменяют свой вид — они могут перемещаться, разделяться
на несколько более тонких тяжей, сливаться, исчезать или
возникать заново. Движение протоплазмы в пристенном
слое клеточной мембраны также меняется. Можно с уверен-
ностью сказать, что циркуляционное движение протоплазмы
не повторяется на протяжении жизни клетки. Направление
движения не остается постоянным в течение длительного
времени, через некоторое время оно меняется на обратное,
т. е. движение носит периодический характер.
Ротационное движение — протоплазма движется только
по периферии клетки. При ротационном движении, в отли-
чие от циркуляционного, очертания протоплазмы остаются
71
Живая клетка.indb 71 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-71-320.jpg)
![Клетка — элементарная единица живого
неизменными благодаря тому, что движение носит более или
менее постоянный упорядоченный характер.
Фонтанирующее движение — промежуточный тип дви-
жения между циркуляционным и ротационным движением.
В этом случае протоплазма в толстом центральном тяже дви-
жется к вершине или основанию клетки, а пристенный слой
движется в обратном направлении.
Движение протоплазмы по определенным направле-
ниям — в слое протоплазмы, прилегающем к клеточной
стенке, наблюдаются часто длинные и узкие бороздки, вдоль
которых движутся протоплазма и хлоропласты. Эти направ-
ляющие бороздки изолированы друг от друга зонами непод-
вижной протоплазмы и образуют на протоплазматическом
геле полосатость. Наблюдаются и другие типы движений в
отдельных особых клетках. Типы движения не являются раз
и навсегда постоянными. Они изменяются, переходят друг в
друга и т. д. На рис. 23 показаны примеры различных типов
движения протоплазмы.
Чем же обусловлено движение протоплазмы? Какие силы
вызывают движение и его поддерживают? Ответить на эти
вопросы пытались в течение 100 лет, наконец Зейцфрицем
был сделан обзор всех теорий, которые он разделил на 11 ка-
тегорий (цитир. по [88], с. 259) в зависимости от причин, ко-
торыми пытались объяснить этот феномен:
4) поверхностное натяжение;
5) оводнение;
6) осмос;
7) обратимый переход золь-гель;
8) миелиновые процессы;
9) коацервация;
10) самостоятельное движение частиц;
11) кинетическая энергия;
12) действие магнитных сил;
13) действие электрических сил;
14) сократимость.
72
Живая клетка.indb 72 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-72-320.jpg)
![Клетка — элементарная единица живого
Рис. 23. В пыльцевых зернах и молодых пыльцевых трубках Lilium
annatum обнаруживается колебательное, циркуляционное и рота-
ционное движение протоплазмы [88]. Вблизи кончика (к) растущей
пыльцевой трубки движение протоплазмы имеет характер обратно
фонтанирующего движения: 1 — колебательное движение; 2 — цирку-
ляционное движение; 3, 4 — ротационное движение.
Одни теории были отброшены временем и новыми факта-
ми, а другие показывают направление, в котором необходимо
двигаться, но ни одна из теорий не смогла зарекомендовать
себя достаточно обоснованной и общепринятой. Камия [88]
считает, что для объяснения движения протоплазмы должны
быть известны как динамическая «организация протоплаз-
матической системы», так и «природа энергии», обеспечи-
вающей это движение.
Что можно сказать по этому поводу? Во-первых, мы уже
могли убедиться, что построение и функционирование клет-
ки столь сложно и многообразно, что ожидать создания некой
единой теории, объясняющей все стороны этого феномена,
маловероятно. Необходимо шаг за шагом пытаться вникнуть
в суть этих процессов и, по возможности, объяснить хотя бы
некоторые вопросы.
По-видимому, нам не обойтись без привлечения некото-
рых моделей, взятых из неживой природы. Нужно только до-
говориться, чтобы, привлекая ту или иную модель для объ-
яснения какого-либо явления, обнаруживаемого в живой
73
Живая клетка.indb 73 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-73-320.jpg)


![Клетка — элементарная единица живого
глубже заглянуть в суть биологических процессов. Электрон-
ная микроскопия, спектрофотометрия, флуоресцентная и
люминесцентная микроскопия, ультрацентрифугирование,
газовая и жидкостная хроматография, автоматические сек-
венсоры для синтеза и изучения белковых молекул и другие
методы исследования создали предпосылки для возникнове-
ния новой отрасли науки — «молекулярной биологии». Не-
смотря на неудачное название (на уровне молекул биологии
нет), были достигнуты столь выдающиеся результаты, что
возникло ощущение, что осталось совсем немного и все про-
блемы живого будут решены.
Это позволило Г. М. Франку [87] заявить, что дверь к
познанию живого уже открылась, и еще немного усилий —
и дверь распахнется во всю ширь. Но факты накапливались, а
создание общей теории живого отодвигалось и отодвигается
все дальше и дальше. Отвечая на одни вопросы, ученые стал-
кивались с другими вопросами, еще более сложными и запу-
танными. Естественно, что решение на любых проблем, свя-
занных с расшифровкой механизмов жизненных процессов,
может быть найдено только на базе физических и химических
законов. Как ведут себя молекулы в живой клетке? Каким за-
кономерностям подчиняются? Как построена динамическая
структура живой клетки? Вот те вопросы, ответы на кото-
рые мы попытаемся получить на базе химических знаний.
Базируясь на дискуссиях, длящихся не одно столетие, и на
фактах, полученных к настоящему времени, можно сформу-
лировать третий постулат, характеризующий живое состоя-
ние клетки :
В живой клетке нет и не может быть никаких элемен-
тов, соединений, надмолекулярных образований, построен-
ных или созданных только для обеспечения живого состояния
и не подчиняющихся общим законам физики и химии. Любая
молекула или ассоциаты молекул в живой клетке находятся
76
Живая клетка.indb 76 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-76-320.jpg)
![Клетка — элементарная единица живого
в состоянии, которое определяется их физико-химическими
свойствами и свойствами окружающих их соседей.
Нашей задачей далее будет выяснение путей, которые
приводят к возникновению особых биологических законов
и закономерностей. При этом основным будет объяснение и
обоснование закона Бауэра.
Решая эту задачу, можно идти двумя путями — первый
путь тот, которым идет молекулярная биология, выясняя
роль молекул и их образований, стараясь все процессы све-
сти к молекулярному уровню.
Наверное, лучше всего это сделано в монографии Грина и
Гольдбергера [89]. И хотя авторы считают: что «Единица жи-
вого — клетка. Она содержит все необходимое для сохране-
ния жизни и обеспечения ее непрерывности», далее они отхо-
дят от этого утверждения и рассматривают вначале вопросы,
связанные с пригодностью атомов для выполнения жизненно
важных функций, а затем подробно и обстоятельно излагают
свойства и функционирование всех известных биохимикам
молекул и макромолекул.
Не отрицая важности этих знаний, нам кажется целе-
сообразным рассмотреть второй путь, который будет бази-
роваться на общих принципах строения молекул с исполь-
зованием качественных квантово-механических подходов и
обнаружения на этой основе общих принципов построения
динамической структуры клетки и ее органелл.
На чем основан такой подход? Прежде всего на том, что
химические основы жизненных процессов одни и те же для
всех клеток, несмотря на их разнообразие, — морфологиче-
ские и функциональные. Типы молекул также одни и те же во
всем живом мире.
В последующих главах данной работы попытаемся объяс-
нить, как на основе химических знаний можно понять тече-
ние механизмов, обеспечивающих живое состояние клетки.
77
Живая клетка.indb 77 27.10.2009 11:40:06](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-77-320.jpg)




![Белок и его состояние в живой клетке
Тогда из остатков аминокислот образуется длинная цепь,
именуемая полипептидной. Как же она поведет себя? Мы
уже констатировали, что в пептидной связи имеет место n,π-
сопряжение. Л. Полинг [90] использовал этот принцип, как
считает Бреслер [14], при построении модели полипептида.
Второй принцип, использованный Полингом для этой же
цели, — эквивалентность всех аминокислотных остатков.
1 2
Рис. 24. Вторичная структура белка [34]: 1 — беспорядочно сверну-
тый клубок; 2 — α-спираль.
Наконец, третий принцип — это необходимость возник-
новения не менее двух водородных связей на каждую пептид-
ную группировку. Базируясь на этих трех принципах, Полинг
и Кори построили α-спиральную структуру, которая может
84
Живая клетка.indb 84 27.10.2009 11:40:07](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-84-320.jpg)
![Белок и его состояние в живой клетке
образоваться самопроизвольно, если полипептидная цепь
линейна (см. рис. 24). Линейные полипептидные цепи могут
давать также складчатые структуры, когда цепи вытянуты в
одну линию, и водородные связи образуются между двумя
цепочками.
Рис. 25. Вторичная структура белка: Рис. 26. Модельное изображе-
β-структура [34]. ние β-структуры полипеп-
тидной цепи ([13] с. 193).
Полинг назвал такие образования β-структурами
(рис. 25). В этом случае, как и в первом, мы имеем самопроиз-
вольное возникновение кристаллоподобной внутримолеку-
лярной структуры.
Модельное изображение β-структуры представлено на
рис. 26. И если последовательность аминокислот в полипеп-
тидной цепи носит название первичной структуры белка,
то укладка этих цепей в определенные кристаллоподобные
образования названа вторичной структурой белка. Пример
первичной структуры белковых молекул приведен на рис. 27.
Так как образование α- и β-структур идет с понижением
свободной энергии, весь процесс будет носить самопроиз-
вольный характер, т. е. молекула будет принимать эти формы
без вмешательства извне. В данном случае мы сталкиваемся
с очень интересным явлением: с одной стороны, у белковой
(полипептидной) молекулы имеется стремление (самопро-
извольное) закристаллизоваться (внутримолекулярный кри-
сталл), с другой стороны имеются для этого препятствия: в
85
Живая клетка.indb 85 27.10.2009 11:40:07](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-85-320.jpg)
![Белок и его состояние в живой клетке
полипептидную цепь часто встроены остатки пролина и ок-
сипролина (формулы 2.19, 2.20), что нарушает регулярность.
Из-за пятичленных колец этих аминокислот цепь вынужде-
на поворачиваться почти на 130°, что несовместимо с ходом
спиральной цепи. Это неизбежно сказывается на степени
регулярности в белковой структуре. Не менее существенно
образование дисульфидных связей за счет наличия в поли-
пептидной цепи цистеина. Дисульфидные связи мешают сво-
бодному развертыванию и спирализации белковой цепочки.
Наконец не менее важное препятствие для кристаллизации
представляют боковые группы аминокислот. Но здесь уже не-
обходимо учитывать их характер.
Рис. 27. Первичная структура лизоцима [14].
Группировки таких аминокислот, как аланин, валин, лей-
цин и изолейцин (2.2−2.5), будут стремиться сгруппировать-
ся и уйти из водного окружения так же, как это происходит
при смешивании, например, гексана и воды. По этой причине
возникающие силы получили название гидрофобных взаи-
модействий. Аспарагиновая и глутаминовая кислоты (2.6,
2.7) могут приобретать отрицательный заряд за счет карбо-
ксильной группы и вступать в электростатическое взаимо-
действие с лизином и аргинином (2.10, 2.11), в боковой груп-
пировке которых имеются амино- и имино-группы.
86
Живая клетка.indb 86 27.10.2009 11:40:07](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-86-320.jpg)

![Белок и его состояние в живой клетке
Рис. 29. Структура молекулы
миоглобина [34]. Видно несколь-
ко прямых отрезков α-спирали,
соединенных короткими участ-
ками неспиральной цепочки.
Заштрихованный участок вну-
три молекулы — группа гема с
атомом железа в центре.
Наиболее обстоятельно вопросы образования третичной
структуры белка изложены в работах Лифшица с сотр. [91,
92]. Попробуем немного подробнее познакомиться с теори-
ей, развитой в их работах: «Основой любой биологической
структуры являются чрезвычайно длинные молекулярные
цепи биополимеров, звенья которых скреплены сильными
валентными связями. Помимо связей существуют, однако,
и другие силы «бокового» или объемного взаимодействия
между звеньями цепи, сблизившимися в результате ее изгиба.
Они определяют возникающее фазовое состояние системы.
В отсутствие объемного взаимодействия свободная цепь, в
результате флуктуаций изгиба, сворачивается в рыхлый клу-
бок. Дополнительные силы притяжения приводят при неко-
торых критических значениях температуры и других пара-
метров среды к «схлопыванию» рыхлого клубка в плотную
глобулу. Такие глобулярные состояния являются по существу
состояниями частичного равновесия, где первичная структу-
ра цепи и связи между ее звеньями зафиксированы и образу-
ют «линейную память» в системе. Равновесие реализуется по
отношению к дополнительным силам взаимодействия с огра-
ничениями, накладываемыми «линейной памятью».
И далее: «Прежде всего заметим, что цепочка может иметь
множество совершенно различных пространственных укла-
88
Живая клетка.indb 88 27.10.2009 11:40:07](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-88-320.jpg)
![Белок и его состояние в живой клетке
док (конформаций), отвечающих одному и тому же значе-
нию «энергии» Е. Эта энергия включает в себя как энергию
цепи, так и энтропию за счет тепловых колебаний или других
деформаций, не изменяющих общего характера третичной
структуры». Все приведенные рассуждения и теории базиру-
ются в основном на фактах, полученных при исследовании
синтетических полипептидов и сравнительно небольших
белковых молекул.
В данном случае «пространственные укладки» сопрово-
ждаются не только «конформационными» перестройками, их
сопровождают конфигурационные изменения. Нужно иметь
в виду, что «конформационные» или «конфигурационные»
перестройки в чистом виде при построении живых структур
встречаются не часто.
Рассмотрим подробнее состояние белковой молекулы
в водном растворе. Первые попытки обосновать ее состояние
были предприняты еще в 1940-е гг. Бреслером и Талмудом [93,
94]. Решающее значение, по их представлениям, при сворачи-
вании белковой глобулы принадлежит боковым радикалам
аминокислот. В зависимости от их характера, они либо будут
стремиться уйти из водного окружения (неполярные радика-
лы), либо остаться в водном окружении (полярные радика-
лы). При этом в целом глобула будет стремиться к минимуму
свободной энергии. Ситуация будет следующая:
1. При большом количестве неполярных группировок
белковая молекула будет «схлопываться» в глобулу с образо-
ванием гидрофобного «ядра». Уменьшение свободной энер-
гии происходит по двум причинам: во-первых, алкильные
радикалы, группируясь, получают дополнительные степени
свободы и энтропия молекулы увеличивается; во-вторых,
полярные группы, оставаясь на поверхности, образуют водо-
родные связи с молекулами воды, что приводит к увеличению
энтальпии. При этом возникающие водородные связи пре-
пятствуют структурированию воды с образованием льдопо-
добной структуры с пониженной энтропией.
89
Живая клетка.indb 89 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-89-320.jpg)
![Белок и его состояние в живой клетке
2. При очень малом количестве гидрофобных боковых
цепей, естественно, преобладающими будут гидрофильные
группировки, белковая молекула будет терять способность
к сворачиванию в глобулу. Например, фиброин шелка, в со-
став которого входит 43,8% глицина (гликокола) и 26,4% ала-
нина (самый короткий радикал), вообще не образует глобул:
его полипептидная цепь остается развернутой и вытянутой в
форме нити.
При образовании белковой глобулы ее растворимость
в воде и ее минимальная свободная энергия коррелируют
между собой. При разворачивании белковой глобулы изме-
нение свободной энергии не может быть большим, так как
изменение энтальпии не будет значительным из-за простого
перераспределения водородных связей между водой и ги-
дроксилами полипептидной цепи. В то же время изменение
энтропии может достигать значительной величины, так как
будет иметь место упорядочивание молекул воды неполяр-
ными радикалами. При переходе от глобулярного состояния
к развернутому, т. е. при денатурации, свободная энергия
возрастает, проходя через максимум. Естественно, это при-
водит к ухудшению растворимости соответствующего белка,
агрегации белковых молекул и выпадению их в виде осадка.
Если бы живая клетка представляла собой раствор макро-
молекул в воде, проблема состояния белка в клетке решалась
бы просто и однозначно. Однако клетка структурно и функ-
ционально отличается от водного раствора, являясь органи-
зованной системой [14]. Исходя из общепринятого предполо-
жения, что свойства живых систем зависят от белков, стали
уделять внимание свойствам, прежде всего, белковых моле-
кул, их способности свертываться в компактные глобулы и их
развертыванию, т. е. денатурации.
Было известно, что живые системы отвечают на повреж-
дающие воздействия окружающей среды неспецифическим
образом. Чтобы объяснить, что же происходит с белком при
этих воздействиях, в 1930–60-е гг. были всесторонне иссле-
90
Живая клетка.indb 90 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-90-320.jpg)
![Белок и его состояние в живой клетке
дованы денатурационные свойства белков при различных
повреждающих воздействиях. Наиболее обстоятельно и мно-
гогранно этот феномен исследован Насоновым с сотр. [50]
в 1940-е гг.
Естественно, возникал вопрос, играет ли существенную
роль процесс денатурации белков в нативных структурах жи-
вой клетки. Развернутая целиком белковая глобула неизбеж-
но должна была терять функциональную специфику, т. е. во-
обще терять свои каталитические свойства. А так как именно
эти свойства имеют решающее значение для жизнедеятель-
ности клетки, ставилось под сомнение значение денатураци-
онных процессов в обеспечении регулируемого обмена (ме-
таболизма) в живой клетке. Как никто другой это понимал
Насонов ([50], с. 196), когда он, заканчивая изложение экс-
периментальных фактов о значении денатурирационных из-
менений белков под действием повреждающих воздействий
на живую клетку, писал: «Вырабатывая наши представления
о состоянии белков в живой клетке, мы широко использова-
ли сведения о поведении относительно стойких неклеточных
белков in vitro. Однако в результате дальнейшего анализа мы
вынуждены были прийти к выводу о том, что прижизненное
состояние клеточных белков отличается особым качествен-
ным своеобразием. Это качественное отличие необходимо
всегда учитывать, дабы с осторожностью применять к белкам
живой протоплазмы те сведения, которые дает нам исследо-
вание белков вне этой системы». Об осторожности перенесе-
ния выводов, сделанных на основании изучения очищенных
препаратов белков, и объяснения их свойств в живой клетке
предупреждал еще в 1928 г. Лепешкин [95].
Напрашивалось предложение — относить к денатурации
белковых макромолекул не только полное развертывание по-
липептидной цепи, но и любое изменение нативной структу-
ры белка. Это конечно мало приемлемо, так как не позволяло
бы ставить граничные условия процесса денатурации. Посте-
пенно термин «денатурация» заменили термином «конфор-
91
Живая клетка.indb 91 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-91-320.jpg)
![Белок и его состояние в живой клетке
мационные изменения». К глубокому сожалению, при этой
замене произошло слияние понятий «конфигурационных» и
«конформационных» изменений и взаимодействий, что с на-
шей точки зрения неправильно, так как не позволяет разгра-
ничивать эти два процесса, о чем мы упоминали ранее.
По этой причине мы попытаемся эти два процесса в даль-
нейшем по возможности разграничивать, хотя это бывает не
всегда возможно, особенно имея в виду, что любое развер-
тывание белковой глобулы будет включать повороты вокруг
σ-связей полипептидной цепи и боковых групп аминокислот-
ных остатков (конформационные изменения), сопровождаю-
щиеся разрывом одних и образованием других водородных,
дисперсионных, ионных, гидрофобных связей и взаимодей-
ствий (конфигурационные изменения и взаимодействия).
Обозначать все эти изменения исходной (нативной)
структуры одним словом «конформационные», если и воз-
можно, то только тогда, когда имеем дело с белками. В случае
других классов органических соединений это бывает недо-
пустимо, особенно когда речь идет о «малых», мономерных
молекулах, с чем нам предстоит еще столкнуться. Продемон-
стрировать к чему приводит игнорирование различий между
понятиями «конфигурация» и «конформация», можно на
примере руководства по биофизике, рекомендуемого в каче-
стве учебного пособия для студентов вузов ([96], т. 2, с. 47):
«Гош-конформации (гош(+) и гош(-)), поворот на +120° от-
носительно транс-конформации сравнительно мало превы-
шают по энергии транс-конформацию (на 2–3 КДж/моль),
но эти состояния разделяет энергетический барьер высотой
~ 12–17 КДж/моль. Если углеводородные цепи в полностью
транс-конфигурации представляют собой линейные струк-
туры, то появление одиночной гош-конформации в цепи
приводит к искривлению пространственной конфигурации
цепи на угол ~120°. В плотно упакованных мембранных си-
стемах с полностью транс-конформацией углеводородных
цепей это искривление порождает серьезные стерические за-
92
Живая клетка.indb 92 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-92-320.jpg)
![Белок и его состояние в живой клетке
труднения, делающие невозможным появление одиночных
гош-конформаций».
Можно ли из этой фразы понять, о чем идет речь: об из-
менении «конфигурации» цепи или об изменении «конфор-
мации»? Такого рода путаницу можно встретить и в работах
других авторов.
Неспецифическая реакция клеток на повреждающие воз-
действия неизбежно будет сопровождаться изменениями и
специфических систем клеток. Продемонстрировать такого
рода процессы можно на примере работ Тейпеля и Кошланда
[98] по денатурации и ренатурации ряда ферментов: фумара-
зы, энолазы, альдолазы, глицеральдегидфосфатдегидрогена-
зы, лактатдегидрогеназы и маликдегидрогеназы∗.
Рис. 30. Флуоресцентный эмиссионный спектр нативной ( ) де-
натурированной ( ) и ренатурированной ( ) фумаразы (1),
энолазы (2) и альдолазы (3) [98].
Перечисленные ферменты денатурировали под воздей-
ствием 8 М гуанидингидрохлорида, а затем ренатурировали
in vitro и исследовали кинетику ренатурированных фермен-
тов. Кроме того, проводили спектрофотометрические иссле-
∗ Использование названий белков-ферментов без расшифровки их
действия объясняется тем, что такая расшифровка увела бы изложение в
область классической биохимии. Это не входит в нашу задачу, сформули-
рованную в самом начале работы. Объяснения и расшифровки действий
белков-ферментов читатель найдет в руководствах по биохимии [99, 100].
93
Живая клетка.indb 93 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-93-320.jpg)
![Белок и его состояние в живой клетке
дования нативных денатурированных и ренатурированных
белков. На рис. 30 представлены соответствующие спектры
фумаразы альдолазы и энолазы. Как видно, эти три фермента
достаточно хорошо восстанавливают свою структуру, о чем
свидетельствуют совпадения их флуоресцентных эмиссион-
ных спектров поглощения.
Общая картина развертывания и свертывания белковых
молекул представлена на рис. 31.
Развернутая
цепь
Промежуточное
состояние
Окончательное
состояние
Неактивный Неактивный Активный Активный
агрегат
Рис. 31. Схематическое представление о развертывании и свертыва-
нии белков in vitro [98].
В тех случаях, когда образуется агрегат (ΙΙΙb) активность
теряется. Свернутые ренатурированные состояния могут
быть как активными (ΙΙΙс и ΙΙΙd), так и неактивными (ΙΙΙа).
Какие общие выводы можно сделать из этих результатов?
Белковые глобулы свертываются через неактивные состоя-
ния ΙΙа, ΙΙb, ΙΙс, которые регистрируются путем измерения
оптической активности и флуоресценции. Этот процесс про-
текает быстро и заканчивается за 1 минуту. Конформацион-
94
Живая клетка.indb 94 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-94-320.jpg)
![Белок и его состояние в живой клетке
ные изменения, которые ведут к восстановлению активности,
протекают медленнее и заканчиваются за 75 минут.
Скорость образования неактивного агрегата определить
легко, а скорость образования неактивной регенерированной
глобулы вообще не определялась. Принятые условия окру-
жающей среды: концентрация специфических метаболитов,
ионная сила и концентрация белка, среда для ренатурации,
наличие субстратов и кофакторов.
Наибольший выход активного фермента наблюдали, ког-
да с самого начала ренатурацию осуществляли в присутствии
субстрата или кофакторов.
Если же субстрат добавляли после начала сворачивания
глобулы белка, то уровень ускорения реактивации наблю-
дали для фумаразы, альдолазы и энолазы. Влияния же этих
факторов на процесс ренатурации глицеральдегидрофосфат-
дегидрогеназы или лактатдегидрогеназы не обнаруживалось.
Авторы считают, что влияние окружающей среды in vitro и in
vivo совпадают. Процессы развертывания и свертывания бел-
ковых глобул, видимо, по их мнению, играют существенную
роль в процессах авторегуляции живых систем.
Кошланд еще в 1964 г. [101] предложил схему образова-
ния фермент-субстратного комплекса, который формируется
путем присоединения субстрата к белковой молекуле. Прав-
да при этом белковая молекула должна обладать некоторой
жесткостью, так как активный центр фермента должен со-
хранять свою структуру в процессе функционирования. При
этом нужно иметь в виду, что в построении структуры актив-
ного центра участвуют не только близлежащие группировки,
но и далеко расположенные аминокислотные остатки поли-
пептидной цепи, между которыми преобладают силы притя-
жения, а не силы отталкивания. Выше мы уже отмечали, что в
растворе полипептидная цепь сворачивается в глобулу.
Однако наличие растворителя неизбежно приведет к на-
буханию глобулы и превращению ее в рыхлый клубок, как
считает Птицин [102], чему способствует понижение энер-
95
Живая клетка.indb 95 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-95-320.jpg)
![Белок и его состояние в живой клетке
гии на 100–200 ккал/моль для полипептида с молекулярным
весом ~ 10000–20000 к.е. Если глобула развертывается, т. е.
денатурируется под действием повышенной температуры в
кислой среде или в присутствии гуанидинхлорида, она пере-
ходит в состояние, которое Финкельштейн и Птицин [107],
а так же Гильманшин с сотр. [108] рассматривают в качестве
промежуточного, отличного как от нативного, так и от дена-
турированного состояния. Это было ими показано на приме-
ре α-лактальбумина коровы и человека при использовании
кругового дихроизма в ближайшей УФ («ароматической») и
дальней («пептидной») области спектра. Следует отметить,
что этот белок связывает ионы Са++, удаление которого де-
стабилизирует молекулу [109]. Эти факты еще раз подтверж-
дают тезис о том, что белковая молекула может переходить из
одного состояния в другое, и эти состояния поддерживаются
многими факторами.
Решая вопрос о природе сил, стабилизирующих белковую
глобулу, мы неизбежно сталкиваемся с необходимостью от-
вета на вопрос, когда и как формируется белковая глобула.
Возможны два варианта: по первому из них последователь-
ность аминокислот в полипептидной цепи предопределяет
пространственную структуру белка; альтернативой этому яв-
ляется предположение, что структура глобулы закодирована
в информационной рибонуклеиновой кислоте и сворачивает-
ся, удаляясь с рибосомы в строго фиксированном состоянии.
В данном случае речь идет о котрасляционном сворачивании
белковой молекулы [111, 112].
Ответ может быть получен при исследовании процесса
денатурации с последующей ренатурацией. Если справедлив
второй вариант сворачивания, то нельзя надеяться после де-
натурации вернуть молекулу белка в исходное нативное со-
стояние. Приведенные выше результаты исследования Тейпе-
ля и Кошланда о ренатурации ряда ферментативных белков,
свидетельствуют в пользу того, что в растворе белки находят-
ся в термодинамически устойчивом состоянии, т. е. обладают
96
Живая клетка.indb 96 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-96-320.jpg)
![Белок и его состояние в живой клетке
минимумом свободной энергии для данного растворителя
и температуры.
Однако если обратиться к данным, полученным в тече-
ние нескольких последних десятилетий, то во многих случаях
имеет место и необратимая денатурация при тепловых воз-
действиях. Денатурация под действием денатурирующих хи-
мических веществ (мочевины, кислот или щелочей, изменяю-
щих рН среды) обратима в гораздо большей степени. Даже в
тех случаях, когда при денатурации рвутся водородные, ион-
ные, полярные и даже дисульфидные S–S связи, возможна ре-
натурация [113, 114].
Это позволило Птицину заключить, что денатурация гло-
булярных белков, не осложненная вторичными побочными
реакциями, представляет собой конформационный переход
(на самом деле, конформационно-конфигурационный пере-
ход, ККП) в истинно термодинамическом смысле этого слова,
и пространственная структура нативной белковой молеку-
лы соответствует минимуму ее свободной энергии. Следует
оговорить, что под «нативной» структурой в данном случае
подразумевается белковая глобула в растворе, сохраняющая
свою функциональную (главным образом ферментатив-
ную) активность.
Обстоятельно вопрос сворачивания белковых молекул в
соответствующие структуры (чаще всего глобулы) рассмо-
трен Кузнецовой, Форже и Туроверовым [104]. Если после-
довательность аминокислот в полипептидной цепи закодиро-
вана в последовательности четырех азотистых оснований в
цепи нуклеиновых кислот, то сворачивание белковой молеку-
лы в глобулу определяется уже последовательностью амино-
кислот в самой полипептидной цепи (см. рис. 32 на цветной
вклейке с. 183).
Это было впервые продемонстрировано в работах Ан-
финсена [105] и подтверждено другими авторами [106, 107].
Не повторяя далее всех нюансов, связанных с фолдингом
белковой молекулы, которые читатель найдет в цитирован-
97
Живая клетка.indb 97 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-97-320.jpg)
![Белок и его состояние в живой клетке
ных работах, отметим правоту авторов исследования [104],
считающих, что «мерой стабильности структуры белка яв-
ляется свободная энергия F = H – TS, которая определяется
его энтальпией Н, т. е. энергией взаимодействия различных
групп белковой молекулы, и его энтропией S = R lnN (где
R — молярная газовая постоянная, Т — абсолютная темпе-
ратура), являющейся мерой числа конформаций N, которы-
ми данное состояние белка может быть реализовано». Эта
формула практически идентична формуле Больцмана, упо-
мянутой нами во введении, если принять, что число кон-
формаций N совпадает с вероятностью микросостояний W.
Приводимая авторами схема, характеризующая энергетиче-
скую поверхность при переходе белковой молекулы (рис. 33
на цветной вклейке с. 183) из полностью развернутого в на-
тивное состояние, проходя через промежуточное состояние,
по-видимому, будет представлять интерес и тогда, когда мы
подойдем к построению качественной модели клетки. Про-
должая обсуждение свойств белка в водных растворах, со-
гласно представлениям, развитым Шерагой с сотр. [116–119],
изменение термодинамических параметров при образовании
белковой глобулы составляет:
ΔF от –0,2 до –1,5 ккал/моль;
ΔН от + 0,3 до + 1,8 ккал/моль;
ΔS от + 1,7 до + 11,0 ккал/моль·град.
Таким образом, выигрыш свободной энергии вполне до-
статочен, чтобы стабилизировать нативную структуру бел-
ковой глобулы. Гидрофобные взаимодействия с повышением
температуры до 50–60°С вначале усиливаются, а затем осла-
бевают.
Наличие в белковой глобуле других связей (главным об-
разом, водородных) приводит к тому, что нативная белковая
глобула может существовать в определенном интервале тем-
ператур с ограничениями как сверху, так и снизу. Этот вывод
подтверждается данными Фосса и Шелмана [120], изучавши-
ми влияние температуры на водные растворы рибонуклеазы
98
Живая клетка.indb 98 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-98-320.jpg)
![Белок и его состояние в живой клетке
в присутствии мочевины. Они установили наличие темпера-
турного максимума. Выше и ниже максимума денатурирую-
щая способность мочевины возрастает (рис. 34).
Рис. 34. Температурные зависи-
мости доли нативных молекул
рибонуклеазы в водных раство-
рах при различных концентра-
циях мочевины [120].
Не менее убедительны данные Фасмана с сотр. [121], из-
учавших поведение высокомолекулярных (молекулярный
вес 60000–125000 к.е.) полимеров L–тирозина и сополимеров
L–тирозина и L–глутаминовой кислоты. Устойчивость по-
липептидов монотонно убывает с ростом температуры, про-
ходит через минимум, а затем начинает возрастать. Авторы
объясняют этот эффект наложением влияния водородных
связей, ослабляющихся с ростом температуры, и гидрофоб-
ных связей, усиливающихся с ростом температуры. Все изло-
женное позволяет прийти к выводу, что белковая молекула
принимает КК-структуру, в наибольшей степени отвечающей
минимуму свободной энергии, когда в молекуле скомпенси-
рованы все возможные связи между атомами и их группиров-
ками.
Несмотря на однозначность сворачивания белковой или
синтетической полипептидной цепи таким образом, чтобы
обеспечивать Fмин, синтетические белки не всегда удается
99
Живая клетка.indb 99 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-99-320.jpg)
![Белок и его состояние в живой клетке
получить в таком виде, когда обеспечены функциональные
свойства на уровне натуральных белков [126]. При этом сра-
зу нужно отметить, что приобретение полипептидной цепью,
синтезированной in vitro, специфических функциональных
свойств зависит от умения экспериментатора и имеет место
лишь при удачном выборе благоприятных условий в экспери-
менте (умело и тщательно подобранные методики, различные
физические и химические факторы). В противном случае вос-
произвести известное заранее свойство нативного белка, т. е.
его КК-структуру, невозможно.
В настоящее время вряд ли можно найти более актуаль-
ную задачу, чем проблема связи функциональных свойств
белка с их динамическим КК–структурным состоянием. Ма-
жуль с сотр. [127] считают, что для функционирования белка
необходима способность молекулы сохранять, несмотря на
тепловые флуктуации, среднестатическое трехмерное распо-
ложение атомов. При этом нужно учитывать, что существуют
флуктуации элементов структуры белковой глобулы.
Следует подчеркнуть, что важнейшим свойством белко-
вых макромолекул является их способность претерпевать
КК–перестройки при взаимодействии и связывании лиган-
дов, кофакторов, изменении ионного состава среды, диэ-
лектрических свойств растворителя, действии температуры,
давлении, света, всемирного тяготения, радиационного фона
и т. д.
Обсуждавшийся ранее денатурационный переход под
воздействием перечисленных факторов не может рассматри-
ваться как функциональный фактор, так как полное неупо-
рядоченное разворачивание белковой глобулы ведет к потере
функциональной активности, хотя возможны промежуточ-
ные состояния неполного развертывания с частичным сохра-
нением той или иной функции белка. В цитируемой работе
[127] исследовано поведение щелочной фосфатазы Escherichia
coli под действием хаотропных агентов (мочевина 2–12 М
и гуанидингидрохлорид 0,3–6 М).
100
Живая клетка.indb 100 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-100-320.jpg)
![Белок и его состояние в живой клетке
При исследованиях, связанных с поведением белковых
молекул, для их развертывания в растворах очень широко ис-
пользуют мочевину и гуанин:
2.21. Мочевина 2.22. Гуанин
Почему эти два соединения, в зависимости от концентра-
ции, обладают способностью менять структуру белковой мо-
лекулы, вплоть до ее полного развертывания? Обратившись
к структурным формулам, можно видеть, что наличие поляр-
ных N−H связей позволяют этим соединениям конкуриро-
вать с водородными связями, стабилизирующими белковую
глобулу, а наличие n,π-сопряженных группировок (по дан-
ным рентгеноструктурного анализа молекула мочевины ко-
планарна [128]) дополнительно увеличивают взаимодействие
молекулы белка с этими соединениями за счет образования
комплексов с переносом заряда (см. разд. 2.10).
Изменения наблюдали, используя собственную (фосфа-
тазную) флуоресценцию и триптофановую фосфоресценцию
при комнатной температуре. Результаты люминесцентного
анализа сравнивали с результатами измерений функциональ-
ной активности белка. На рис. 35 представлено изображение
молекулы фосфатазы, построенной на основании данных
рентгеноструктурного анализа. На фрагменте изображен ак-
тивный центр фермента. Следует сразу обратить внимание на
то, что структура активного центра стабилизируется ионами
цинка и магния.
Пермяков [129] выделяет кальцийсвязывающие белки в
особый класс белков, число которых достигает нескольких
сотен. Используя метод генной инженерии, исследованы
кальцийсвязывающие белки с наивысшим сродством к каль-
101
Живая клетка.indb 101 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-101-320.jpg)
![Белок и его состояние в живой клетке
цию: парвальбумин [137], кальмодулин, тропонин С, каль-
биндин, рековерин, α-лактальбумин [138] и др., для которых
известна трехмерная структура, определяемая методом рент-
геноструктурного анализа для кристаллического состояния
белков и методом ЯМР для их растворов.
Рис. 35. Фрагмент структуры ще-
лочной фосфатазы Escherichia coli
с выделенным триптофанилом:
Trp–109 [127]. На фрагменте по-
казаны локализованные в области
активного центра фермента ка-
тионы цинка и магния.
Рассмотрим строение одного из этих белков кальмоду-
лина, универсального Са2+-зависимого активатора активно-
сти целого ряда ферментов (фосфодиэстеразы циклических
нуклеотидов, аденилаткиназы легких цепей миозина и др.).
Молекула кальмодулина и некоторых других кальцийсвязы-
вающих белков выглядит как гантель (см. рис. 36 на цветной
вклейке с. 184): две глобулярные части, содержащие по две
Са2+-связывающие «руки», соединены длинной восьмивинто-
вой спиралью [129]. Все четыре центра связывают как ионы
Са2+, так и ионы Mg2+.
Изменение КК–структуры кальцийсвязывающих белков,
когда происходит включение кальция в молекулу белка, мож-
но продемонстрировать также на примере рековерина [130]
(см. рис. 37 на цветной вклейке с. 184). Можно легко видеть,
что молекула рековерина при использовании как простран-
ственной модели, так и ленточной модели резко меняет свое
внутреннее и внешнее состояние. Несмотря на то, что при
изучении кальцийсвязывающих белков остается нерешен-
ным ряд вопросов, используя методику белковой инженерии
102
Живая клетка.indb 102 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-102-320.jpg)
![Белок и его состояние в живой клетке
(исследование мутантных форм белков), можно надеяться на
решение ряда проблем в ближайшем будущем.
Схема структурных и функциональных преобразований
белка, учитывающая возможность перехода глобулы в частич-
но свернутые состояния как функционально активные, так
и функционально неактивные, представлена на рис. 38 [127].
Рис. 38. Схема структурных и функциональных преобразований
белка [127].
Чтобы осуществить все эти переходы, молекула белка
должна обладать не только достаточной жесткостью, но и
103
Живая клетка.indb 103 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-103-320.jpg)
![Белок и его состояние в живой клетке
значительной подвижностью, т. е. она должна флуктуиро-
вать в определенных пределах. Действительно, совсем не-
давно опубликована работа [123], в которой констатируются
возможные равновесные флуктуации молекул миоглобина
и лизоцима. При этом проведено количественное изучение
пространственно временных характеристик специфических
белковых движений с использованием метода рэлеевского
рассеяния месбауэровского излучения. Обнаружены суще-
ственные различия во временной корреляции и в амплиту-
дах движений для этих белков при их нативном состоянии.
Эта разница в пространственно-временных характеристиках
белковых движений обусловлена отличием в структурной ор-
ганизации этих белков.
Внутримолекулярная динамика белков, входящих в состав
биологических мембран и клеток, подробно исследованы Ма-
жулем с сотр. [133] методом триптофановой фосфоресцен-
ции при комнатной температуре. Зарегистрированы сдви-
ги броуновской динамики структуры белка при изменении
рН среды, ионной силы и температуры раствора при связы-
вании субстратов, аллостерических активаторов и ингибито-
ров, ограниченном протеолизе, термоинактивации, ассоциа-
ции и рефолдинге.
Авторы предложили фосфоресцентный метод исследова-
ний миллисекундной динамики структуры белков в составе
биологических мембран. При этом внутримолекулярная ди-
намика имеет место, когда на клетки действуют биологически
активные соединения, физиологически умеренные факторы
и окислительный стресс. Изменяется динамика также при он-
кологических и аутоимунных заболеваниях. Можно конста-
тировать, что в последнее время интерес к внутримолекуляр-
ной динамике белковых молекул постоянно нарастает, что,
естественно, сказывается на числе публикуемых работ, по-
священных этому вопросу [123–125, 185, 187]. Шноль с сотр.,
рассматривая конформационные колебания молекул белка
(КК-колебания), отмечали, что при переходах макромолекул
104
Живая клетка.indb 104 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-104-320.jpg)
![Белок и его состояние в живой клетке
от одного состояния к другому имеет место синхронизация
этих переходов в макрообъеме. При этом конформационные
колебания сопровождаются колебаниями функциональны-
ми, т. е. изменениями ферментативной активности [122].
Мак-Каммон с сотр. [185], используя кристаллографи-
ческий метод, исследовали панкреатический ингибитор
трипсина и сумели обнаружить изменения молекулы через
3,2·10–6 сек. Теория динамики КК-переходов в белках наибо-
лее полно и обстоятельно изложена в обзоре Шайтана [209],
который, отмечая уникальные динамические свойства белка,
считает, что это отличает его от любых твердых и жидких тел.
Рубин ([96], с. 296–297) приводит данные о временных ха-
рактеристиках отдельных видов движения белковых молекул
(табл. 2.1).
Таблица 2.1
Виды движения белковых молекул и их временные
характеристики [96]
Первичные события в фотосинтезе и зрении 10-13–10-12 сек
Локальная динамика:
– атомов и малых групп 10-12–10-11 сек
– боковых цепей и сегментов полипеп-
тидных цепей 10-11–10-7 сек
Релаксация участков полипептидной цепи ~ 10-9 cек
Движения доменов и субъединиц 10-8–10-5 сек
Реакция переноса протона ионизируемых
10-9–10-7 сек
групп
Развертывание участков α-спирали 10-8–10-6 сек
Высвобождение связанных молекул лигандов 10-6–10-3 сек
Кинетика сворачивания-разворачивания 10-4–10-2 сек
Обмен прочно связанных ионов Са 10-3–10-2 сек
Все это свидетельствует о том, что сейчас уже невозмож-
ны никакие построения, объясняющие жизненные явления
без учета роли динамики КК-состояний белковых молекул.
105
Живая клетка.indb 105 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-105-320.jpg)
![Белок и его состояние в живой клетке
Впервые указание о том, что белок существует не в одном
статичном состоянии, а в виде группы структурных форм,
способных к непрерывным взаимопревращениям, появилось
в конце 1950-х гг. [134] на основании исследования законо-
мерностей дейтерообмена.
В 1966 г. Перутц с сотр. [135], анализируя данные рентге-
ноструктурного анализа конформаций гемоглобина и мио-
глобина, обратили внимание на высокую плотность упаков-
ки макромолекул, что препятствует диффузии лигандов к
железу гема. Авторы предположили, что доступ лигандов к
месту связывания может осуществляться лишь при условии
флуктуаций структуры белка. Несколько позже [123, 133]
методами измерения степени поляризации и спектров трип-
тофановой флуоресценции получены прямые эксперимен-
тальные доказательства существования в белке структурных
флуктуаций с наносекундными временами.
При исследовании ряда глобулярных белков была обна-
ружена универсальная способность макромолекул находить-
ся в нескольких функционально активных КК-состояниях,
различающихся по степени диффузионной подвижности
аминокислотных радикалов и обратимо кооперативно пере-
ходящих друг в друга в интервале температур от 0 до 35°С.
В процессе нагревания в узком, характерном для каждого
индивидуального белка, температурном интервале наблюда-
лось скачкообразное внутримолекулярное движение (ВМД),
в наибольшей степени проявляющееся на периферии глобул.
Как считают Мажуль с сотр. [133], к настоящему вре-
мени накоплено значительное количество эксперимен-
тальных данных, свидетельствующих о том, что в ма-
кромолекуле белка хотя и имеет место плотная упаковка
полипетидной цепи, осуществляются различные по мас-
штабу и времени движения: атомов и атомных групп
(10-10–10-14 сек), вращение боковых цепей вокруг одинарных
σ-связей (10-8–10-11 сек), «перескоки» между фиксированными
положениями колец аминокислотных остатков, в том числе
106
Живая клетка.indb 106 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-106-320.jpg)
![Белок и его состояние в живой клетке
триптофанилов (10-2–10-5 сек). Амплитуды этих движений со-
ставляют от 10-3 до 1 нм.
2.2. О с труктуре гемоглобина и других
белков в рас творе
По-видимому, есть смысл подробно познакомиться со
структурой и поведением одного какого-либо белка, чтобы
понаблюдать в какой мере выполняются теоретические рас-
четы и предположения, а также экспериментальные наблюде-
ния над различными белками, находящимися, главным обра-
зом, в растворе, и в конечном счете понять, что же происходит
с белковой молекулой, когда она находится в живой клетке.
По целому ряду причин наиболее удобным для этого белком
является гемоглобин. Уже в 1965 г. Перутц и Кендрью [150,
151] на основании данных, полученных с помощью рентгено-
структурного анализа, построили полную пространственную
модель гемоглобина, где точность определения межатомных
расстояний составляет 1–2 Å. Это позволило провести ана-
лиз распределения всех остатков аминокислот и их возмож-
ных функций [150].
Неполярные аминокислоты: глицин, аланин, валин, лей-
цин, фенилаланин, цистеин, метионин, триптофан и тирозин
расположены внутри глобулы гемоглобина. Последние две
аминокислоты достаточно гидрофобны, чтобы занять место
среди действительно неполярных аминокислот, тем более что
эти две слабо полярные аминокислоты могут образовывать
водородные связи, которые дополнительно стабилизируют
белковую глобулу. Аналогично действует водородная связь,
образуемая остатком треонина. Два остатка полярного гисти-
дина тоже находятся внутри глобулы, но они связаны с гемом
четырьмя связями.
Если неполярная боковая группа не находится внутри
глобулы, то она либо маскируется в складках полипептидной
107
Живая клетка.indb 107 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-107-320.jpg)

![Белок и его состояние в живой клетке
Чтобы приблизиться к пониманию возможного состоя-
ния гемоглобина в клетке (эритроците) в 1967 г. нами [152]
было начато исследование термической устойчивости гемо-
глобина белых мышей, контрольных и облученных γ-лучами
в дозе 900–1400 рад. С целью получения гемоглобина эритро-
циты подвергали гемолизу в 0,01 М фосфатном буфере. Опре-
деление термостабильности О2-гемоглобина, очищенного на
колонке с карбометилцеллюлозой методом ступенчатой элю-
ции показало, что результаты опытов зависят от длительно-
сти хранения гемоглобина (всегда на холоду) и температур-
ного режима обработки при его получении.
Оказалось, что с течением времени термостабильность ге-
моглобина интактных животных возрастает, тогда как термо-
стабильность гемоглобина облученных животных меняется
незначительно, что устраняет различия в поведении подо-
пытных и контрольных проб (рис. 39).
— термоустойчивость гемоглобина итантных
(контрольных) животных
— термоустойчивость гемоглобина облученных
животных
Рис. 39. Изменение термоустойчивости гемоглобина при хране-
нии [153]. По оси абсцисс отложено время хранения раствора гемо-
глобина в сутках; по оси ординат — процент денатурированного ге-
моглобина после нагревания 0,01% его раствора в 0,01 М фосфатном
буфере рН 6,8 при 54–55°С в течение 30 минут).
Это методическое затруднение удалось преодолеть путем
быстрой сорбции гемоглобина на карбоксиметилцеллюлозе
с последующей десорбцией фосфатным буфером. Хотя такая
109
Живая клетка.indb 109 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-109-320.jpg)
![Белок и его состояние в живой клетке
обработка понижала стабильность белка к тепловому воздей-
ствию, опыты показали, что после очистки различия между
термостабильностью гемоглобина облученных и контроль-
ных мышей сохраняются. Следовательно эффект не мог быть
результатом появления в облученном организме веществ, ко-
торые образуют комплексы с гемоглобином и изменяют его
денатурационную стабильность.
Естественно, необходимо было выяснить, что же проис-
ходит с молекулой гемоглобина при упомянутых повреждаю-
щих воздействиях. Эту задачу пытались решить, используя
ионообменную хроматографию на карбоксиметилцеллюлозе
более устойчивого СО–Нb. При хроматографии белков на
ионитах целлюлозы, решающей стадией является элюция, за-
висящая прежде всего от сорбирующей способности ионита
и от структурного состояния белка.
В литературе уже тогда было известно [155], что гемогло-
бин неоднороден и состоит из нескольких фракций. Основ-
ной из них является Нb–А0. Чтобы исключить наложение
фракций при элюции было решено проверить влияние тем-
пературы на элюцию Нb–А0, выделенного предварительно.
На рис. 40 представлены результаты этого исследования.
Рис. 40. Влияние температуры на элюцию Нb–А0 из колонки с карбокси-
метилцеллюлозой [155]: 1 — при постоянной температуре (14°С); 2 —
при изменении температуры в точке а — от 14 до 11°С, в точке b — от
11 до 14°С; 3 — градиент рН.
110
Живая клетка.indb 110 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-110-320.jpg)
![Белок и его состояние в живой клетке
Изменение температуры элюирующего раствора всего на
3,0°С вызывало резкий скачок в количестве белка, выходяще-
го из колонки. Столь сильная зависимость процесса элюции
от температуры натолкнула на мысль, что можно проводить
хроматографию на карбоксиметилцеллюлозе гемоглобина в
градиенте температуры, что и было осуществлено (рис. 41),
на примере нативного Нb и гемоглобина, подвергнутого ча-
стичной денатурации.
Рис. 41. Хроматограммы Нb–А0 на карбоксиметилцеллюлозе [155]:
1 — Нb, полученный по методу Драбкина [156]; 2 — Нb, подвергнутый
нагреванию до 52°С в течение 20 мин; 3 — градиент температуры.
Известно, что с повышением температуры величина сорб-
ции меняется как для обычных сорбентов [158], так и для
синтетических ионитов [159, 161]. Однако следует заметить,
что сорбция ионитами с повышением температуры изменя-
ется плавно [160]. Поэтому трудно допустить, что возраста-
ние температуры всего на 4°С может обусловить такое умень-
шение сорбирующей способности КМ-целлюлозы, что из
колонки выходит 80–90% сорбированного Нb–СО. Остается
предположить, что наблюдаемое явление обусловлено изме-
нением КК-состояния глобиновой части молекулы, в резуль-
тате чего меняется изоэлектрическая точка данного белка и
он выходит из колонки. Основанием для такого предполо-
жения служил тот факт, что при денатурации белка можно
111
Живая клетка.indb 111 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-111-320.jpg)
![Белок и его состояние в живой клетке
наблюдать значительный сдвиг его изоэлектрической точки
[135], что вызывается, видимо, перераспределением поляр-
ных групп на поверхности белковой глобулы [51, 163]. Из-
вестно, что КК–переходы в белках возможны и при физио-
логических температурах [164−166].
Используя означенный выше метод хроматографии, мы
решили выяснить: отличаются ли КК-переходы гемоглобина
in vitro и in vivo [126]. Хроматографируя Нb–СО, выделенный
из эритроцитов облученных животных, обнаружили, что ге-
терогенность белка (рис. 42) нарастает за счет значительного
увеличения Нb–А1∗.
Рис. 42. Хроматограммы Нb–СО [154]: интактных (конт-
рольных) животных; облученных животных.
Иная картина наблюдается при денатурирующих воздей-
ствиях in vitro (рис. 43–45) как на Нb–СО интактных, так и
Нb–СО облученных животных. Естественно, что неупорядо-
ченное развертывание белковой глобулы зависит также и от
характера денатурирующего воздействия.
∗ Обнаруженный на первых хроматограммах пик Нb—А1 [154]
0
является, видимо, артефактом, так как в последующих экспери-
ментах данный компонент обнаруживался не всегда. Возможно
это результат неизбежных температурных флуктуаций в термоста-
те колонок. К этим флуктуациям особенно чувствителен процесс
элюции Нb—СО, когда достигается максимум концентрации Нb
в элюирующем растворе.
112
Живая клетка.indb 112 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-112-320.jpg)
![Белок и его состояние в живой клетке
При воздействии пропанола происходит глубокая пере-
стройка глобулы (рис. 43). Изоэлектрическая точка развер-
нутой глобулы резко изменяется и элюция развернутого
Нb–СО осуществляется при значениях рН, значительно от-
личающихся от нативного Нb–А0.
Рис. 43. Хроматограмма Нb: до ( ) и после ( ) денатурации
пропанолом (условия см. в работе [154]).
Рис. 44. Хроматограммы гемоглобина интактных животных:
до ( ) и после ( ) нагревания. Нагревали Нb–О2 при 55°С
20 мин, после чего переводили его в СО–производное. В колонку вводили
45 мг белка (условия хроматографирования в работе [154]).
При тепловом (55°С) воздействии происходит быстрее все-
го частичное развертывание или перераспределение боковых
групп аминокислот на поверхности глобулы за счет поворота
113
Живая клетка.indb 113 27.10.2009 11:40:08](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-113-320.jpg)
![Белок и его состояние в живой клетке
вокруг σ-связи полипептидной цепи. Поэтому выход из колон-
ки вновь образовавшегося компонента Нb–Аx (см. рис. 44, 45)
незначительно отличается от исходного Нb–А0. При этом ха-
рактер изменений при нагревании гемоглобинов из эритроци-
тов интактных и облученных животных, по-видимому, сходен.
Рис. 45. Хроматограммы гемоглобина облученных животных: до
и после нагревания до 55°С в течение: 0 мин — ( ), 20 мин —
( ); 60 мин — ( ). Условия те же, что и на рис. 40 [154].
Какие же выводы можно сделать из экспериментальных
фактов, характеризующих состояния молекулы гемоглобина
в эритроците (живой клетке):
а) КК-состояние молекул гемоглобина строго детермини-
ровано до тех пор, пока сохраняется целостная живая струк-
тура эритроцита;
б) даже такое жесткое воздействие на живой эритроцит,
как летальная доза облучения в 1 400 рад, не приводит к из-
менению КК-состояния глобулы Нb–А0;
в) попадая в буферный раствор, молекула гемоглобина
вначале стабилизируется, а затем при жестких повреждаю-
щих воздействиях развертывается и, видимо, теряет свои
функциональные свойства;
г) мягкие повреждающие воздействия, не очень сильно
отличающиеся от физиологических (повышение температу-
ры до 55°С), могут приводить к перераспределению остатков
аминокислот на поверхности глобулы либо за счет частично-
114
Живая клетка.indb 114 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-114-320.jpg)
![Белок и его состояние в живой клетке
го развертывания полипептидной цепи, либо за счет выхода
на поверхность остатков, спрятанных внутри глобулы (пово-
роты вокруг σ-связей полипептидной цепи).
Приходится еще раз констатировать, что, несмотря на
огромный арсенал методов исследования, получить количе-
ственные характеристики, связанные со структурой и функ-
цией белков в живой клетке чрезвычайно сложно, чаще все-
го невозможно. Так или иначе, приходится экстраполировать
данные, полученные для белков в растворе на состояние бел-
ка в клетке. Прежде всего, необходимо выяснить за счет каких
сил и взаимодействий осуществляется построение органелл
клетки с включением в них вышеперечисленных соедине-
ний и последующим построением функционирующих белков
(чаще всего белков-ферментов). По-видимому, пойдет речь
об ассоциации или агрегации (кристаллизации в том числе).
Основой этих процессов является, прежде всего, белок—
белок взаимодействие [149].
Самым простым подходом для решения этой проблемы
является изучение поведения белка в растворе при увеличе-
нии его концентрации.
Оказалось, что белок, в отличие от других классов орга-
нических соединений, не остается безучастным к любым из-
менениям окружающей среды и меняет свое структурное КК-
состояние в зависимости от изменений параметров среды.
В то же время хорошо известно, что структурная перестрой-
ка молекулы белка приводит к изменению ее функциональ-
ной активности. Попробуем рассмотреть ряд примеров, под-
тверждающих приведенные предположения.
Так, у ряда ферментов при изменении температуры в
диапазоне 0–30°С наблюдались скачкообразные изменения
физико-химических параметров [168, 169], естественно свя-
занных с изменениями структуры белка. Это неизбежно от-
ражается на ферментативной активности изучаемых белков.
В лаборатории биофизики АН БССР для некоторых белков
было показано существование таких переходов при исполь-
115
Живая клетка.indb 115 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-115-320.jpg)
![Белок и его состояние в живой клетке
зовании люминесцентного [167, 170] и фотохемилюминес-
центного методов [171].
Авторы предприняли попытку выявить возможные свя-
зи наблюдаемых перестроек белка с функциональной актив-
ностью интактной клетки. Исследуя клетки мерцательного
эпителия пищевода лягушки, на кривой зависимости спек-
тра флуоресценции от температуры λmax = ƒ( t ) четко про-
сматривается ступенька (рис. 46), свидетельствующая о том,
что внутри клеток белки способны существовать в дискретно
различающихся температурных формах с обратимым коопе-
ративным переходом между ними.
Рис. 46. Зависимость двигательной активности (1) и положения мак-
симума спектров белковой флуоресценции (2) клеток мерцательного
эпителия пищевода лягушки от температуры [165].
При этом авторы считают, что степень кооперативности
белков в клетке более высокая, чем в растворе. Обращает
на себя внимание тот факт, что сдвиги в спектрах флуорес-
ценции внутриклеточных белков не сопровождаются изме-
нениями в степени поляризации их флуоресценции, как это
имеет место, если белки находятся в растворе. Это означает,
что внутри клетки имеют место контакты типа белок—белок
или белок—липид, изменяющие КК-состояние внутрикле-
точных белков. В то же время наблюдались в этой же области
температур резкие изменения энергии активации внутри-
клеточных ферментов, что приводит к изменению их дви-
116
Живая клетка.indb 116 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-116-320.jpg)
![Белок и его состояние в живой клетке
гательной активности (речь идет о клетках мерцательного
эпителия).
Аналогичную картину наблюдали Масси с сотр. [168] при
изучении температурной зависимости конформационного
состояния аминоацилоксидазы и одновременное изменение
ее ферментативной активности. Оказалось, что температур-
ные сдвиги сопровождались сдвигами функциональной ак-
тивности данного белка. При этом менялись также и другие
физико-химические параметры: константы седиментации,
спектры в ультрафиолетовой и видимой областях, ход кри-
вых Аррениуса.
Существует точка зрения, что белок (фермент) может су-
ществовать в двух стабильных конформационных формах,
каталитическая активность которых резко различается. Пе-
реход одной формы в другую происходит при определенной
температуре, характерной для каждого индивидуального
белка. Авторы приводят величины критической температуры
для 17 индивидуальных белков-ферментов (табл. 2.2).
Мы снова стакиваемся с возможностями белковой моле-
кулы принимать множественные КК-состояния, обладаю-
щие различной функциональной активностью. Так фермент
аденилатциклаза существует в виде 8 изоферментных форм.
Одна из них активирует, как считают авторы, перенос ионов
Са++ через мембраны [189], функции остальных пока неиз-
вестны. Интересные данные получены еще в 1971 г. Четрве-
риковой [175], изучавшей креатинкиназную активность в
растворе фермента. Было обнаружено, что имеют место ко-
лебания активности, причем распределение величин актив-
ности отличается от нормального (распределение Гаусса).
Характер распределения указывает на наличие двух—че-
тырех состояний фермента, различающихся величиной ка-
талитической активности. Добавление субстратов реакции
(АТФ, АДФ, креатин фосфат) и цистеина к раствору фермен-
та уменьшает амплитуду ферментативной активности. Еще
раньше этот же эффект наблюдал Шноль [176].
117
Живая клетка.indb 117 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-117-320.jpg)
![Белок и его состояние в живой клетке
Таблица 2.2
Величины критической температуры для
белков-ферментов[168].
Критическая
Фермент температура,
град С
1 Инвертаза 0
2 Трипсин 0
3 Панкреатическая лигаза 0
4 Уреаза +SO2= 22
5 β-Амилаза 20
6 Амилаза слюны 24
7 Восстановленная цитохромоксидаза 25
8 Фумараза (в зависимости от рН) 17–27
9 Миозинаденозинтрифосфатаза 16
10 Цитрат-конденсирующий фермент 20
11 Альдолаза 21
12 Липоилдегидрогеназа 22
13 Фосфорилаза b 13
14 Фосфорилаза a 31
15 Рибонуклеаза (в зависимости от рН) 63
16 Химотрипсиноген (в зависимости от рН) 44
17 Химотрипсин (в зависимости от рН) 34
Шайтан и Рубин [189], изучив особенности эффекта
Мессбауэра в белках, считают, что наблюдаемая темпера-
турная зависимость, связанная с вероятностью поглощения
γ-квантов без их отдачи, ƒ'(Т), не может быть объяснена ни
в рамках модели твердого тела, ни за счет уширения диффу-
118
Живая клетка.indb 118 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-118-320.jpg)
![Белок и его состояние в живой клетке
зионного спектра, что характерно для жидкости. Они счита-
ют, что резкое падение фактора ƒ'(Т) в ограниченной области
температур можно объяснить особенностями, характерными
для конформационной подвижности белков. Этот феномен
можно отнести к свойствам белковых молекул принимать
участие в построении более сложных систем. Отсюда вытека-
ет, что создаются предпосылки для увеличения вероятности
возникновения множественных микросостояний по Боль-
цману—Планку [190], т. е. возрастанию энтропии. Просьба к
читателям запомнить эту интерпретацию, так как к ней мы
будем возвращаться и далее. Сейчас только следует обратить
внимание на то, что множественность микросостояний ста-
вит подчас непреодолимые препятствия на пути создания
математических моделей, отражающих количественную сто-
рону процессов, протекающих в живой клетке.
В 60-е гг. прошлого столетия Моно и Джакоб [172] обоб-
щили имеющиеся к тому времени данные о связи физиоло-
гической активности белков с воздействием на белковую
молекулу специфических метаболитов, не являющихся ни
реагентами, ни продуктами реакции. Объяснение этим фак-
там было дано с привлечением воззрений о воздействии тех
или иных веществ на белковую молекулу, изменяющих ее
конформационное состояние∗.
Возникла следующая терминология, объясняющая пове-
дение белковой молекулы, имеющей, по крайней мере, два
участка, ответственных за физиологическую активность:
один участок — это активный центр, ответственный за саму
ферментативную реакцию; второй участок в другой части
белковой глобулы реагирует с неким веществом, что ведет к
изменению КК-состояния белковой молекулы и, естественно,
оказывает влияние на ее активный центр. Этот участок по-
лучил название аллостеричекого центра. Явление в целом
∗ Еще раз напоминаем, что когда имеем дело с белком, в клетке не мо-
жет быть ни чисто «конформационных», ни чисто «конфигурационных»
изменений. Можно говорить только о «КК-изменениях».
119
Живая клетка.indb 119 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-119-320.jpg)
![Белок и его состояние в живой клетке
обозначено как аллостерия, являющаяся отражением коопе-
ративности белковой системы. Вещество, комплементарное
к аллостеричекому центру, получило название аллостери-
чекий эффектор, который связывается с белковой молеку-
лой специфично и обратимо. Образование комплекса белок
(фермент)—аллостерический эффектор не активирует саму
реакцию, лишь вызывает дискретные обратимые изменения
молекулярной структуры, что в свою очередь модифицирует
активный центр и изменяет один или несколько кинетиче-
ских параметров, характеризующих биологическую актив-
ность белка.
Важность аллостерии белка для функционирования жи-
вых систем в 1980-е гг. подчеркивал Волькенштейн [173], счи-
тая, что необходимо исследовать природу взаимодействия
различных факторов, в том числе химических, с белковой мо-
лекулой, которая при этом меняет свое структурное состоя-
ние.
Большую ценность имеют работы по изучению взаимо-
зависимости структурного и функционального поведения
белков, как в индивидуальном виде, так и при включении мо-
лекулы белка в надмолекулярные комплексы с участием дру-
гих соединений. Например, при изучении строения активно-
го центра химотрипсина [200, 201] оказалось, что активный
центр фермента расположен в самой глубокой впадине на по-
верхности, ограниченной аппроксимирующей сферой с ради-
усом 2 нм. Объем впадины, рассчитанный по методу Монте-
Карло, составляет почти 2 нм3. Размер и форма (пересечение
аппроксимирующей и дополнительной сфер) позволяет вхо-
дить внутрь активного центра достаточно крупным (более
1 нм3) фрагментам молекул-субстратов. На дне впадины про-
исходят реакции расщепления, осуществляемые молекулой
химотрипсина.
Костецкий [201] на основании литературных данных счи-
тает, что активные центры большинства ферментов также
располагаются внутри крупных впадин на поверхности бел-
120
Живая клетка.indb 120 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-120-320.jpg)
![Белок и его состояние в живой клетке
ка. Этот феномен имел место в 83% случаев из 67 изученных
ферментов.
Далее мы увидим, что поверхность белков изрезана оби-
лием всевозможных впадин. Включение молекул небелко-
вых соединений в ту или иную впадину неизбежно будет
приводить к изменению КК-состояния молекулы белка. В
этом, видимо, заключается объяснение аллостерии белков-
ферментов.
Что происходит с молекулой белка при ее функциониро-
вании, можно рассмотреть на примере простейших молекул,
например, нейрокинина А и В [178]. Оба нейропептида со-
держат по 10 аминокислотных остатков в линейной последо-
вательности:
Нейрокинин А: Гис1-Лиз2-Тир3-Асп4-Сер5-Фен6-Вал7-Гли8-Лей9-Мет10
Нейрокинин В: Асп1-Мет2-Гис3-Асп4-Фен5-Фен6-Вал7-Гли8-Лей9-Мет10
Эти два структурно сходных нейропептида относятся к
семейству тахикининов, выполняющих различные физио-
логические функции. Используя теоретический конформа-
ционный анализ, авторы цитируемой работы определили
стабильные конформационные состояния биологически ак-
тивных молекул. На рис. 47 представлена атомная расчетная
модель молекулы нейрокинина А.
Рис. 47. Атомная расчетная модель нейрокинина А [178].
Следует обратить внимание на неограниченные возмож-
ности изменения углов, т. е. поворотов вокруг σ-связей. Одна-
ко низкой свободной энергией будут обладать лишь неболь-
121
Живая клетка.indb 121 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-121-320.jpg)
![Белок и его состояние в живой клетке
шое число изомеров. Предположительно могут существовать
два низкоэнергетических изомера. На рис. 48 представлены
оба изомера нейрокинина А. Начиная от С-конца (с конце-
вой карбоксильной группой метионина), предсказывается
α-спиральный участок полипептидной цепи, стабилизирую-
щий всю структуру.
Рис. 48. Два низкоэнергетических конформера нейрокинина А [178].
Полученные авторами теоретические предсказания под-
тверждаются результатами структурного исследования этого
же соединения методами ЯМР-спектроскопии [179]. Теорети-
чески подтверждены также данные, полученные при исполь-
зовании и других спектральных методов [179, 180]. Молекула
нейрокинина А может принимать то или иное КК-состояние
в зависимости от окружения, в которое она попадает.
Переходя от столь простой молекулы к более сложным
молекулам белков-ферментов, мы неизбежно столкнемся
с ситуацией, когда при одной и той же последовательности
аминокислот могут существовать множественные формы
белковых глобул, получившие названия «изоферментов»
(изозимов), введенных впервые Маркетом и Моллером в
1959 г. [181]. Позже выяснилось, что множественность форм
присуща не только ферментам, но чуть ли не всем (скорее все-
го, всем — прим. автора) функциональным и регуляторным
белкам [182]. Кроме того, нами уже отмечалось, что белки-
122
Живая клетка.indb 122 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-122-320.jpg)
![Белок и его состояние в живой клетке
ферменты входят в состав мультимолекулярных комплексов.
Множественные формы неизбежны либо при изменении
структуры за счет КК-изомерии, либо последовательности
аминокислот в полипептидной цепи, что, естественно, будет
связано с генетическим кодированием в соответствующей
клетке.
Пришлось вводить понятие типов и подтипов среди субъ-
единиц, которые могут кодироваться одним или несколь-
кими генами. Подтипы субъединиц назвали изоформами.
В конечном счете возникает сложная картина, где субъеди-
ницы входят в состав олигомерных комплексов, либо в виде
КК-изомеров с одной и той же последовательностью амино-
кислот, либо различных полипептидов, выполняющих одну и
ту же функцию. Столь сложная картина молекулярной струк-
туры белка ставит перед исследователями необходимость пе-
ресмотра традиционных общепринятых представлений, уже
базирующихся на осмыслении и описании внутриклеточных
процессов, протекающих в живой клетке.
Нельзя не согласиться с Драбкиным и Кривым [182],
утверждающими, что выяснение функциональной специали-
зации разных молекулярных форм одного и того же белка
стало одной из самых актуальных проблем клеточной био-
логии. Однако, решая эту проблему, обычно идут по пути
подробного изучения все более и более глубокого проникно-
вения в глубинное строение белковых глобул и олигомерных
структур, что необходимо, но недостаточно, чтобы понять,
как же строится и функционирует живая клетка.
Авторы процитированной работы прекрасно справились
с такого рода задачей по выяснению структуры трех бел-
ков: никотинового холинорецептора, ацетил холинэстеразы
и Na+, k+ -АТФазы. Однако они не смогли отрешиться от об-
щепринятых подходов, связанных с поиском ответов на по-
ставленные ими же вопросы о функциональной значимости
освещенных в литературе данных о структуре упомянутых
белков-ферментов. Намеченные пути решения этой задачи
123
Живая клетка.indb 123 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-123-320.jpg)
![Белок и его состояние в живой клетке
опять ведут к поиску новых данных об участии этих индиви-
дуальных белков в каких-либо функциях, которые прольют
свет на понимание функционального значения разнообразия
молекулярных форм одного и того же белка. Придется сно-
ва и возможно еще не один раз утверждать, что пока мы не
научимся экстраполировать свойства индивидуальных бел-
ков на их участие в построении целостной структуры живой
клетки, мы не продвинемся ни на шаг в понимании специфи-
ки живого состояния.
Работу индийских ученых [183], подробно исследовавших
актинсвязывающий белок НР-36, можно считать пионерской
работой, на примере которой есть возможность проследить,
по какому пути должны проводиться исследования струк-
туры белковых молекул, участвующих в построении живой
клетки, хотя аналогичные попытки решения этой пробле-
мы предпринимались и ранее [184–188]. Наиболее интерес-
ным в цитируемой статье [183] является то, что изучалась
подвижность радикалов индивидуальных аминокислот, ро-
тационная и трансляционная подвижность молекул воды,
динамика водородных связей между радикалами амино-
кислот и молекулами воды вблизи спиральных участков 1,
2, 3 (рис. 49). При этом обнаружена существенная разница
в поведении молекул воды вблизи спирали 3 по сравнению с
1 и 2 спиралями.
Рис. 49. Наложение 12 траек-
торий молекулярных движений,
зафиксированных с интервалом
200 псек [183].
124
Живая клетка.indb 124 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-124-320.jpg)
![Белок и его состояние в живой клетке
1 2 3 4
Рис. 50. Моментальный снимок нескольких характерных конфигура-
ций белка в растворе: 1 — при постоянной температуре и давлении;
2 — через 1 нсек; 3 — через 2 нсек; 4 — через 3,5 нсек [183].
Из рис. 49 и 50 видно, что наибольшей гибкостью облада-
ют концевые участки полипептидной цепи. В конечном счете
наблюдаемая гибкость белковой молекулы обеспечивается
как структурой самой цепи, так молекулами воды, окружаю-
щими белок.
Сейчас остановимся еще на одном свойстве белка. Выше
мы уже констатировали, что благодаря регулярному чере-
дованию аминокислотных остатков в полипептидной цепи
имеется реальная склонность белковой молекулы к об-
разованию кристаллических структур типа α–спиралей
и β–структур, что доказано экспериментально. Кроме того
было отмечено, что эта регулярность нарушается, когда
в цепи появляются остатки пролина или оксипролина, пово-
рачивающих цепь на 120°. Так или иначе мы можем ожидать,
что белок будет склонен к кристаллизации. Действительно,
уже в 1946 г. Драбкин [156] получил кристаллы гемоглобинов
разных видов животных. Кристаллизация гемоглобина имела
место в различных условиях, в частности независимо от ха-
рактера солей, присутствующих в растворе, и их концентра-
ции, что свидетельствует о собственном стремлении белка к
кристаллизации, т. е. к самоорганизации. Обсуждаемый фе-
номен освещен физиком Тарасевичем [157] совсем недавно,
хотя целенаправленные работы в этом направлении начали
вестись медиками больше десяти лет назад. Оказалось, что на-
блюдать самоорганизацию белков проще всего, дегидратируя
125
Живая клетка.indb 125 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-125-320.jpg)
![Белок и его состояние в живой клетке
биологические жидкости. Этот метод оказался запатентован
в 40 странах мира. Не вдаваясь в подробности описываемого
явления, что достаточно обстоятельно сделано в цитируемой
работе, подчеркнем только подмеченную автором тенденцию
белка к кристаллизации: «При высоких концентрациях белка
наблюдается появление спиральных структур, появление ко-
торых может быть объяснено на основании теории жидких
кристаллов». Наверное, можно беспрекословно соглашаться
с автором в том, что в целом вопрос далек от окончательно-
го решения, но стремление к кристаллизации белка можно
принять как рабочую гипотезу. Однако не нужно думать, что
это стремление несет в себе только положительные черты.
Известно, что кристаллизация гемоглобина в эритроците ве-
дет к тяжелейшему заболеванию — серповидно-клеточной
анемии. Позже мы вернемся к вопросу о переходах белковых
молекул в кристаллическое состояние и положительную и от-
рицательную роль этих состояний.
2.3. Ассоциация белковых молекул
Теперь следует остановиться на процессе создания струк-
тур клетки с участием белковых молекул. Необходимо по-
нять, что будет происходить с белковыми молекулами при их
взаимодействии друг с другом или с полимерными и моно-
мерными молекулами других классов: нуклеиновыми кисло-
тами, липидами, сахарами, витаминами, гормонами, модифи-
каторами, эффекторами, ионами металлов, водой и т. д. [173,
174]. Без этих знаний мы не сможем понять и объяснить по-
строение, функционирование, самопроизводство, дифферен-
цировку, возбудимость и раздражимость живых клеток.
Уже в 1963 г. Ратчель [167] попытался обобщить посвя-
щенную этому вопросу информацию, накопленную к этому
времени в литературе. Построение уровней более высоких,
чем четвертичная структура белка, естественно, начинается с
ассоциации (агрегации, кристаллизации), сопровождающих-
126
Живая клетка.indb 126 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-126-320.jpg)
![Белок и его состояние в живой клетке
ся диссоциацией белковых комплексов. Для изучения этих
процессов могут быть использованы все основные физико-
химические методы, которыми располагала уже в то время
биологическая химия и биофизика: ультрацентрифугиро-
вание, хроматография, электрофорез, электронная микро-
скопия, поляризация, флуоресценция и люминесценция,
осмодинамические исследования, светорассеяние, иммуно-
химические методы, рентгенография. К настоящему времени
появились и другие методы исследования, но они будут упо-
мянуты при изложении экспериментальных фактов.
Мы рассмотрели свертывание полипептидной (белковой)
цепи в водном растворе, когда цепь принимает те или иные
конфигурации, стремясь к минимуму свободной энергии.
При этом используется способность цепи к конформацион-
ным изменениям. Однако даже простейшие белки, как пра-
вило, вступают между собой во взаимодействие и образуют
агрегаты, состоящие из двух и более субъединиц. Число этих
субъединиц каждого белка (фермента) величина строго по-
стоянная. Этот уровень структуры получил название четвер-
тичной структуры белка [139].
Возникающие при ассоциации образования обладают
достаточно большими размерами, их иногда удается обна-
ружить с помощью электронной микроскопии. Четкие изо-
бражения получены для глутамат-дегидрогеназы [143] и
РНК-полимеразы [149]. Надежное изображение с помощью
электронного микроскопа можно получить лишь для круп-
ных частиц с молекулярным весом более 200 000 к.е. Более
мелкие частицы можно исследовать с помощью рентгено-
структурного анализа, который позволяет фиксировать мел-
кие детали строения объекта. К сожалению, последний метод
малодоступен, поэтому приходится прибегать к комбиниро-
ванному методу с использованием седиментации, светорас-
сеяния, поляризации, люминесценции.
Таким образом удается изучать процесс агрегации−деза-
грегации (ассоциации–диссоциации), определять размеры
127
Живая клетка.indb 127 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-127-320.jpg)
![Белок и его состояние в живой клетке
частиц и их компонентов, а также количество субъединиц
в олигомере и характер сил, удерживающих четвертичную
структуру. Однозначно можно сказать, что в процессе связы-
вания белковых молекул друг с другом участвуют ковалент-
ные (слабые S–S связи) или легко разрушаемые ионные связи.
Основная же роль принадлежит водородным, гидрофобным
и дисперсионным связям, т. е. стабилизация четвертичной
структуры осуществляется теми же силами, что и при свер-
тывании полипептидной цепи в белковую глобулу.
Изучая диссоциацию–ассоциацию белковых молекул под
воздействием тех или иных химических реагентов, или фи-
зических факторов, таких как температура, рН и т. д., можно
судить о характере, свойствах и прочности связывания субъ-
единиц в соответствующем агрегате. Нужно только иметь
в виду, что строгие выводы сделаны быть не могут, так как,
вызывая диссоциацию агрегата, мы неизбежно будем вы-
зывать изменения в структуре самих белковых молекул (на-
пример, изменения степени спиральности), хотя возможны
случаи сохранения нативности молекул, как в случае лактат-
дегидрогеназы, диссоциирующей под воздействием доде-
цилсульфоната натрия [142]. Эта неопределенность снижает
ценность выводов о характере сил, стабилизирующих чет-
вертичную структуру белка.
В соответствии с представлениями, излагавшимися ранее
для белковых глобул, способность к ассоциации коррелирует
с высоким содержанием гидрофобных остатков аминокислот.
Зная количество гидрофобных и гидрофильных остатков,
можно рассчитать, сколько гидрофобных остатков «спрячет-
ся» в ядре, а сколько останется на поверхности вместе с ги-
дрофильными остатками.
Поляновский [139] предлагает рассчитывать показатель,
характеризующий соотношение между этими двумя величи-
нами:
В таблице 2.3 приведен данный показатель и молекуляр-
ные веса субъединиц и ассоциированных форм. Рассматри-
128
Живая клетка.indb 128 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-128-320.jpg)
![Белок и его состояние в живой клетке
вая это соотношение (обозначим его через А), легко видеть,
что при А > 1 образуются прочные ассоциированные струк-
туры, тогда как при А < 1 субъединицы белка остаются в мо-
номерном состоянии.
Таблица 2.3
Соотношение А и способность белков
к ассоциации [139, с. 40]
Молекулярный
вес Число
Белок ассоции- А субъеди-
субъеди-
рованной ниц
ницы
формы
1. Сальмин 4 000 — 0,113 1
Цитохром С* сердца
2. 12 400 — 0,655 1
быка
3. Рибонуклеаза быка * 13 700 — 0,62 1
Лизоцим селезенки
4. 15 000 — 1,08 1
собаки*
5. Миоглобин быка 17 000 — 0,87 1
6. Гемоглобин быка 17 000 68 000 1,12 4
70 000
Лактатдегидрогеназа
7. 34 000 и 1,26 2и4
сердца крысы
130 000
Лактатдегидрогеназа
8. 36 500 146 000 1,3 4
В. Subtilis
n × 6 000,
2 или
9. Инсулин быка 6 000 где n 2 1,56
3
или 3
Примечание.
* Отмеченные белки ассоциируют либо при высоких концентрациях,
либо при высокой концентрации и определенном значении рН.
129
Живая клетка.indb 129 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-129-320.jpg)
![Белок и его состояние в живой клетке
Так или иначе имеется общая тенденция к образованию
ассоциированных структур у белков с высоким содержанием
гидрофобных аминокислотных остатков.
В то же время известны случаи, когда даже при значитель-
ной величине А (у инсулина 1,56) ассоциация имеет место
только в кислой среде, а у лизоцима — в щелочной. Объяс-
няется это тем, что в инсулине среди гидрофильных остат-
ков превалируют карбоксилсодержащие остатки, а в лизо-
циме — основные аминокислотные остатки. И если они за-
ряжены, то имеет место электростатическое отталкивание
белковых глобул. В результате, в инсулине в кислой среде дис-
социация будет подавлена, так же как в лизоциме, но уже в
щелочной среде.
Несколько неожиданными оказались результаты по из-
учению изменений энтальпии и энтропии при ассоциации
белковых глобул друг с другом. Оказалось, что выигрыш в
свободной энергии (ее уменьшение) обусловлен, в основном,
изменением энтропии (табл. 2.4).
Таблица 2.4
Изменение энтальпии и энтропии при ассоциации
белковых молекул
Δ Н, Δ S, Литерату-
Наименование белка
ккал/моль энтр. ед. ра
Инсулин (мономер–димер) +6,7 ± 1,5 +14 ± 6 [117, 118]
Инсулин (димер–тример) +8,4 ± 0,3 +17 ± 2 [117, 118]
Белок вируса табачной мо-
заики (ассоциат образуется +190,0 +682,0 [116]
обратимо при рН 6,5)
[119, 146,
Комплекс гаптен–антитело ‒ 0,8 ± 2,6 +22 ± 9
148]
[120, 121,
Комплекс антиген–антитело 0 ± 0,2 +20 ± 8
147, 148]
130
Живая клетка.indb 130 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-130-320.jpg)
![Белок и его состояние в живой клетке
Действительно, если ассоциируют две белковые молеку-
лы, то часть их группировок получает дополнительные воз-
можности для перемещения, благодаря гидрофобному взаи-
модействию. Кроме того освобождается часть молекул воды,
находящихся в связанном состоянии за счет водородных свя-
зей с полярными радикалами, расположенными на поверхно-
сти белковых глобул.
Что же касается структуры и роли воды в живой клетке,
то об этом пойдет речь в специальной главе, посвященной
этому вопросу. Так или иначе белок в клетке будет принимать
структуру, способствующую включению его в более сложные
образования (агрегаты). При этом, нравится это нам или нет,
но процесс образования агрегатов должен протекать спон-
танно, т. е. должна осуществляться самосборка внутрикле-
точных образований.
Наиболее обстоятельно этот вопрос еще в 1970 г. обоб-
щил Поглазов [174]. Он пишет: «В работах Сведберга и его
школы с большой четкостью и на многих примерах показа-
но, что молекулы белка обладают способностью к спонтан-
ному взаимодействию и могут существовать в виде больших
стабильных агрегатов. Работы, выполненные в 1920–1930 гг.
этой группой, явились отправной точкой для всех последую-
щих исследований агрегационных взаимодействий белковых
молекул, как между собой, так и с другими органическими
высокомолекулярными соединениями. Вполне естественно,
что проблема сборки биологических структур является более
широкой, чем просто белок—белок взаимодействие. Агрега-
ция включает в себя упорядоченные ассоциации белка с ну-
клеиновыми кислотами, липидами, углеводами и т. д. Более
того, уже сейчас становится ясным, что сюда же относятся во-
просы агрегации чистых липидов, углеводов и других соеди-
нений». И далее: «Самосборка представляет собой стройный
процесс агрегации, который часто приводит к образованию
правильных кристаллических упаковок. Вследствие этого
самосборку часто рассматривают как простой процесс кри-
131
Живая клетка.indb 131 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-131-320.jpg)
![Белок и его состояние в живой клетке
сталлизации и применяют уже имеющийся арсенал средств
для ее изучения».
Из приведенных взглядов Поглазова можно отметить
прежде всего утверждение о спонтанном характере взаимо-
действия белка и других компонентов, входящих в состав
клетки. При этом самосборка осуществляется и определяется
строением веществ, участвующих в данном процессе.
Особенно наглядно проявляется самосборка на примере
образования и исчезновения в структуре клетки микротру-
бочек. Не вдаваясь в детали функциональной значимости
микротрубочек, что достаточно подробно изложил Поглазов,
исходя из фактов, имеющихся на тот период ([174], с. 105–
107), рассмотрим структурные аспекты построения микро-
трубочек. Уже в самом начале исследования микротрубочек
была предложена модель, которая в дальнейшем сохраня-
лась, не считая некоторых уточнений. Согласно этой модели,
микротрубочка представляет собой цилиндр, образованный
прямыми белковыми тяжами, которые в свою очередь состо-
ят из более низкомолекулярных субъединиц. Число белковых
тяжей, входящих в состав стенки микротрубочки, равно 13.
Вдоль оси микротрубочки, кроме чередования глобулярных
субъединиц, имеются дополнительные периоды, которые
были исследованы Гримстоуном и Клугом [191] с помощью
электронной микроскопии и оптической дифракции. Авто-
ры пришли к выводу, что дополнительная периодичность
возникает за счет возникновения связей между соседними
белковыми тяжами и зигзагообразно расположенными субъ-
единицами (рис. 51). Предполагается, что микротрубочки су-
ществуют в двух формах А и В, в основе одной из них лежат
прямые тяжи, а другая имеет спиральную укладку.
Интересные данные получены Тилни и Портером [192], из-
учавшими микротрубочки микроорганизма Actinosphaerium
nuceoflium. В состав этого микроорганизма входит большое
число аксоподий. Скелетной основой этих аксоподий явля-
ются многочисленные микротрубочки. Понижение темпера-
132
Живая клетка.indb 132 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-132-320.jpg)
![Белок и его состояние в живой клетке
туры среды до 4°С приводит к исчезновению аксоподий и к
одновременному исчезновению микротрубочек. Электронно-
микроскопическое исследование показало, что вместо них
появляются более короткие цилиндрические фрагменты,
обладающие четко выраженной периодичной исчерченно-
стью. По мнению авторов, короткие фрагменты возникают
в результате спирализации белковых тяжей микротрубочек.
При восстановлении комнатной температуры аксоподии
и микротрубочки возвращаются в нормальное состояние.
Стоит вспомнить данные, изложенные выше, об измене-
нии структуры самих белков при аналогичном изменении
температуры.
1 2
Рис. 51. Структура поверхностного слоя микротрубочек [174]:
1 — продольное расположение тяжей в микротрубочке (штриховыми
линиями показаны более слабые связи); 2 — возможное перераспределе-
ние субъединиц в зигзагообразную линию.
Микротрубочки обнаруживаются и в цитоплазме в виде
дискретных образований, объединенных попарно. От одной
из микротрубочек каждой пары отходят отростки, получив-
шие названия «ручек», возникающих в результате линейной
агрегации белка дайнина, который обладает АТФ-азной ак-
тивностью. Вспомните о митохондриях, которые предназна-
чены для синтеза АТФ. Полимеризация дайнина и прикре-
пление ручек к микротрубочке также происходит спонтанно
(самосборка).
133
Живая клетка.indb 133 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-133-320.jpg)
![Белок и его состояние в живой клетке
Микротрубочки обнаружили и выделили из митотиче-
ского аппарата и других органелл. Это позволило изучить
поведение белка микротрубочек in vitro. Диссоциация белка
микротрубочек и последующая его агрегация путем измене-
ния окружающей среды, в которой находится белок, приво-
дит к образованию трубок диаметром 200–300 Å. Эти трубки
внешне ничем не отличались от исходных микротрубочек.
Реконструированные трубочки были спарены бок о бок, что
свидетельствует о способности белка самопроизвольно укла-
дываться в определенные структуры, являющиеся уже ор-
ганеллами клетки с заданной формой и соответствующими
функциями.
Оказалось, что микротрубочки, располагающиеся глав-
ным образом вблизи ядра, образуют систему волокон, по ко-
торым могут перемещаться различные пузырьки и другие ор-
ганеллы, ограниченные мембраной. Следует особо отметить
лабильность микротрубочек, образуемых особым белком ту-
булином. Этот белок обладает крайней чувствительностью к
различным препаратам. Так, например, тубулин легко связы-
вается с антимитотическим препаратом колхицином, струк-
тура которого приведена ниже (2.23).
2.23. Колхицин
Алкалоид колхицин использовался еще древними егип-
тянами в качестве лечебного средства ([245], т. 3, с. 303). Его
действие обусловлено прочностью связывания колхицина с
молекулами тубулина, что приводит к приостановке деления
134
Живая клетка.indb 134 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-134-320.jpg)
![Белок и его состояние в живой клетке
клеток. Другое вещество — таксол наоборот прочно связыва-
ется уже с микротрубочками и заставляет тубулин включать-
ся в состав самих микротрубочек, активируя их образование
и ускоряя процесс деления клеток. Легко видеть, что струк-
тура колхицина изобилует π,π- и n,π-сопряженными систе-
мами (их роль будет обсуждаться позднее). Но так или иначе
на процесс самосборки клеточных органелл можно влиять с
помощью химических соединений.
Самопроизвольное образование некоторых структур
констатировали несколько авторов [193, 194], получивших
электронные микрофотографии белка гемоцианина, выде-
ленного из моллюсков и улиток (беспозвоночные животные).
На рис. 52 представлены результаты экспериментов по изуче-
нию поведения гемоцианинов при изменении кислотности
среды. Макромолекула гемоцианина (медьсодержащий белок
с молекулярным весом, варьирующим от вида к виду от не-
скольких сот тысяч до нескольких миллионов) представляет
собой два цилиндра, сложенных в стопку с помощью внеш-
них и внутренних колец.
1 2 3
Рис. 52. Электронные микрофотографии белка гемоцианина Helix po-
matix [193, 194]: 1 — при рН 6,8; 2 — при рН 8,2; 3 — после доведения
рН до 7,0.
Изоэлектрическая точка гемоцианина улитки Helise
pomatia соответствует 5,0. При рН 6,8 (рис. 52, 1) еще четко
просматривается исходная структура гемоциана. При даль-
нейшем подщелачивании до рН 8,2 происходит диссоциация
на более мелкие субъединицы, и структурированность исче-
135
Живая клетка.indb 135 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-135-320.jpg)
![Белок и его состояние в живой клетке
зает (рис. 52, 2). Возвращение к исходной кислотности приво-
дит к восстановлению структуры (рис. 52, 3). При этом четко
видно, что структура исходного и реконструированного бел-
ков одинакова.
Экспериментальные результаты и теоретические рас-
четы, выполненные Диаз-Морено с сотр. [195], также сви-
детельствуют о самопроизвольном образовании белковых
комплексов. Было исследовано образование комплекса меж-
ду пластоцианином и цитохромом f. Интерпретируя хими-
ческие сдвиги, вызываемые железом гема и амидами ядра
пластоцианина, определяли ориентацию пластоцианина по
отношению к цитохрому f. При этом достигнуто разрешение
1,3 Å. Показано, что гидрофобная часть молекулы, окружаю-
щая тирозин в цитохроме f, «поглощает» гидрофобную часть
пластоцианина. Имеет место комплементарность зарядов на
оболочках цитохрома f и пластоцианина, что определяет на-
правленность присоединения одного белка к другому.
В то же время аналогичный комплекс, образуемый бел-
ками растения Phonmidium, отличается от вышеописанного.
Это означает, что электростатические и гидрофобные взаи-
модействия по-разному сбалансированы у названных живых
организмов. На рис. 53 (см. цветную вклейку с. 185) изображе-
на форма комплекса, о котором идет речь. Сразу же обраща-
ем внимание на сложную пространственную конфигурацию
образовавшегося комплекса, что, естественно, определяет,
какие компоненты и в каком месте смогут присоединяться,
образуя все более и более сложные образования. Кроме того
возникающий комплекс не стабилен: он распадается через
10 миллисекунд.
Если поворачивать рассматриваемое молекулярное об-
разование вокруг вертикальной оси на 90°, то можно видеть
комплекс со всех сторон. Следует обратить внимание на то,
что рельеф его поверхности очень сложен. Сходную карти-
ну можно наблюдать, если обратиться к современным дан-
ным [196], демонстрирующим структуру актина.
136
Живая клетка.indb 136 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-136-320.jpg)
![Белок и его состояние в живой клетке
На рис. 54 (см. цветную вклейку с. 186) изображена про-
странственная структура молекулы актина. Полипептидные
цепи изображены в виде ленты, а молекулы АТФ, ион Са++ и
остатки триптофана и тирозина, обеспечивающие его флуо-
ресцентные свойства, представлены сферическими моделями
разного цвета.
На рис. 55 (см. цветную вклейку с. 186) представлен об-
щий вид молекулы актина и его вид при повороте на 180°
вокруг вертикальной оси. Кроме изрезанности поверхности
актина можно наблюдать распределение отрицательных и по-
ложительных зарядов по этой поверхности, что, несомненно,
чрезвычайно важно при осуществлении процесса взаимодей-
ствия молекул друг с другом и с мономерными молекулами
различных соединений, в том числе воды. Подробности экс-
перимента и выводы о характере упаковки вокруг триптофа-
новых остатков читатель найдет в статье [213]. Данные факты
необходимо запомнить, чтобы в дальнейшем при рассмотре-
нии целостной структуры живой клетки нагляднее представ-
лять направление процесса укладки и присоединения к мо-
лекулам белка других молекул, участвующих в образовании
живой структуры.
Ассоциация белковых молекул, по-видимому, тоже будет
приводить к образованию плотно упакованных структур.
Не забывая взглядов Шредингера [27] о том, что биологиче-
ские структуры представляют собой апериодические кри-
сталлы (чаще всего смешанные), отметим, что построение
клеточных структур с участием белков происходит, наиболее
вероятно, по принципам плотной упаковки, когда выступ
одной молекулы входит в углубление другой, как это было по-
стулировано Китайгородским [198, 199]. К этому вопросу мы
еще вернемся при построении модели клетки.
Познакомимся теперь с более низкомолекулярными со-
единениями, которые, попадая в клетку, взаимодействуют с
высокомолекулярными веществами, главным образом с бел-
ками. При этом будем отмечать, каким образом, в соответ-
137
Живая клетка.indb 137 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-137-320.jpg)
![Белок и его состояние в живой клетке
ствии со своей структурой эти вещества могут взаимодей-
ствовать с белковыми молекулами. Начнем это рассмотрение
с витаминов.
2.4. Витамины
2.4.1. Витамины группы С (аскорбиновая кислота)
В химическом отношении витамины представляют очень
пеструю группу органических веществ, существенно отли-
чающихся друг от друга как по своей структуре, так и по хи-
мическим и физиологическим свойствам. Объединение этих
веществ в одну группу произведено лишь по той причине, что
они крайне необходимы животным организмам. Последние
не могут их синтезировать, эти вещества должны поступать
с пищей. Следует особо подчеркнуть, что количество необ-
ходимых витаминов по сравнению с основными веществами
пищи незначительно. Так на 600 г сухого вещества пищи при-
ходится 0,1–0,2 г витаминов вместе взятых ([100], с. 186).
Основная роль витаминов заключается в их участии в по-
строении структур белков-ферментов, т. е. они присоединя-
ются к белковой молекуле в соответствии с особенностями
структуры как белка, так и присоединяющегося витамина с
образованием комплекса, обладающего уже определенными
физиологическими свойствами. Число известных к настоя-
щему времени витаминов уже давно превышает три десят-
ка. Отсутствие или недостаток витаминов в пище приводит
к нарушению нормального функционирования клеток и
вследствие этого к патологическим нарушениям в целостном
животном организме. При этом характер нарушений будет
зависеть от соответствующего витамина. Следует обратить
внимание на то, что нарушения будут иметь место как при
недостатке витаминов, так и при их избытке.
Попробуем понять, какие свойства специфических струк-
тур витаминов делают их необходимыми для функциони-
рования живых клеток. Последовательность рассмотрения
138
Живая клетка.indb 138 27.10.2009 11:40:09](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-138-320.jpg)



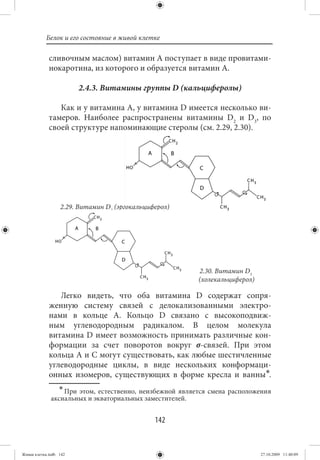








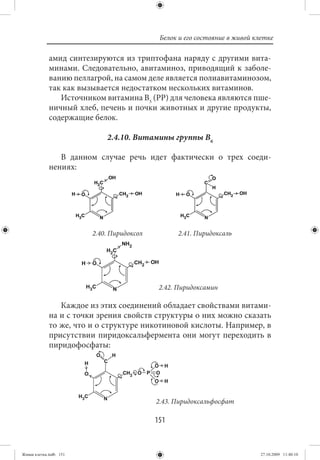



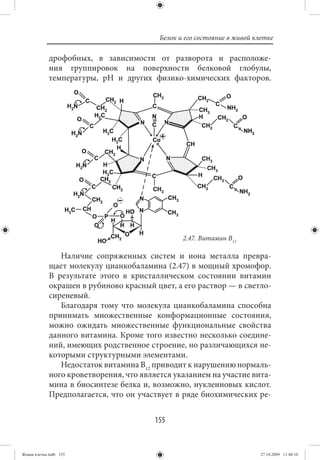



![Белок и его состояние в живой клетке
лостерических регуляторов в процессе функционирования
ферментативных систем.
Перейдем теперь к рассмотрению другой группы соедине-
ний, являющихся также кофакторами, — к гормонам.
2.5. Гормоны
Вещества, влияющие на белки клеток и тем самым уча-
ствующие в регуляции ферментативных процессов, но не по-
ступающие извне, а образующиеся внутри живого организ-
ма, именуются гормонами.
Низкоорганизованные живые организмы и растения вы-
рабатывают особые вещества — регуляторы. У высших жи-
вотных и человека имеются специализированные органы
(железы внутренней секреции), синтезирующие необходи-
мые соединения, поступающие непосредственно в кровь, ко-
торая доставляет эти вещества к клеткам. Деятельность этих
органов регулируется в свою очередь центральной нервной
системой. Все это достаточно полно изложено в обширном
руководстве Фердмана [207], мы же, как и в случае витами-
нов, обратим внимание на химическое строение гормонов,
чтобы понять, каков механизм участия их в построении
структур клетки.
Если следовать уже принятому для классификации ви-
таминов принципу последовательности ознакомления со
строением веществ в соответствии с количеством элементов,
участвующих в построении их молекул, то тогда необходимо
начать с соединений, в составе которых содержатся три эле-
мента: водород, углерод и кислород.
2.5.1. Половые и кортикостероидные гормоны
Эта группа гормонов вырабатывается либо корковым
слоем надпочечников, либо половыми железами. Удаление
159
Живая клетка.indb 159 27.10.2009 11:40:10](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-159-320.jpg)
![Белок и его состояние в живой клетке
надпочечников ведет к достаточно быстрой гибели живот-
ных, если не вводить в их организм шесть гормонов, образуе-
мых этими железами. Рассмотрим строение этих веществ на
примере кортикострерона, классическая формула которого
([207], с. 146) представлена ниже:
2.51. Кортикостерон
Если учитывать стереохимию молекулы, согласно Клейну
([208], с. 162), молекула кортикостерола будет иметь вид:
1 2
2.52. Кортикостерон (1 − стереоформула I; 2 − стереоформула II)
Известно, что каждый шестичленный цикл может иметь
конформацию кресла или ванны. Их переходы друг в друга
будут сопровождаться изменением валентных углов и рас-
положением экваториальных и аксиальных заместителей,
что связано с возникновением напряжения и в связи с этим
изменениями свободной структурной энергии молекулы.
В качестве примера посмотрим, как будет выглядеть молеку-
160
Живая клетка.indb 160 27.10.2009 11:40:10](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-160-320.jpg)

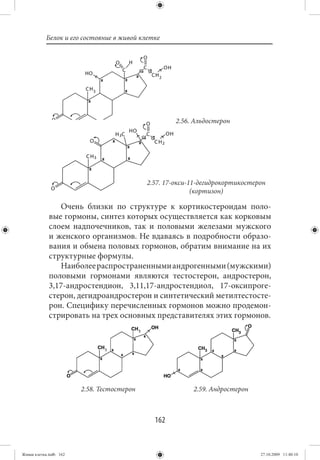

![Белок и его состояние в живой клетке
2.64. Эстриол
Все три вещества относятся к эстрогенным гормонам и
образуются главным образом в яичниках и плаценте, хотя
эстрон был выделен и из мочи жеребцов.
Характерным для структуры всех эстрогенов является на-
личие в их молекулах ароматической сопряженной группи-
ровки в кольце А. Следует отметить и еще одну особенность
структуры эстрогенов: если на концах молекул андрогенов
были в основном отрицательные диполи, то у эстрогенов —
концы венчаются положительно заряженными водородными
атомами. В целом молекулы всех трех групп гидрофобны, но
в вицинальном положении имеются две OH-группы. Имен-
но эти особенности и определяют направленность присоеди-
нения молекул гормонов к молекулам белков, будь то их по-
верхность или та или иная «пустота» в глобуле белка.
Благодаря подвижности полипептидных цепей (о чем
мы уже многократно упоминали), «пустота» может возни-
кать в гидрофобной полости глобулы, куда немедленно бу-
дет устремляться гидрофобная молекула обсуждаемых групп
соединений. Естественно, что такой процесс будет сопрово-
ждаться изменением функциональных свойств соответству-
ющих белков.
Подробное описание биохимии этих групп гормонов чи-
татель найдет в уже цитированной работе Фердмана [207]
или Филлиповича [100]. Согласно данным, приведенным в
последнем руководстве, благодаря гидрофобному характеру
групп гормонов, они легко внедряются в липидные бислои
мембраны, что сказывается на их проницаемости, а, следо-
вательно, ведет к разносторонним изменениям в обмене ве-
164
Живая клетка.indb 164 27.10.2009 11:40:10](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-164-320.jpg)

![Белок и его состояние в живой клетке
В целом же молекулы этих веществ весьма и весьма ре-
акционноспособны. Например, в молекулах имеется амин-
ный азот и они могут образовывать соли с АТФ. Последние
найдены в окончаниях нервных волокон. Все три вещества
(2.65−2.67) оказывают мощное воздействие на сосудистую
систему организма и повышают уровень обмена углеводов в
организме.
Приведенные в цитированной работе [100] превращения
адреналина, его гомологов и их производных осуществляют-
ся при участии соответствующих ферментов. Так, например,
фосфорилаза В (неактивная форма) под действием адренали-
на переходит в фосфорилазу В (активная форма). Эти факты
доказывают, что адреналин и его родственные соединения
взаимодействуют с белковыми молекулами. В силу своей по-
лярности быстрее всего они присоединяются к поверхности
белковых глобул, где расположены в основном полярные
группировки аминокислот.
2.5.3. Пептидные гормоны
Следуя нашей классификации, учитывающей число эле-
ментов, принимающих участие в построении структур гор-
монов, рассмотрим группу соединений, образованные с уча-
стием еще одного элемента — серы.
К этой группе относятся так называемые «пептидные гор-
моны», представляющие собой обычные линейные пептиды,
состоящие из тех же 20 аминокислот, участвующих в постро-
ении белка. Важнейшими пептидными гормонами ([100],
с. 498–508) являются окситоцин, вазопрессин, гастрин, глю-
кагон, инсулин, адренокортикотропин, меланоцитстимули-
рующий гормон, паратгормон, тиреотропин и гормон роста.
О специфике структуры пептидных гормонов сказать
больше, чем сказано о строении пептидов, образующих бел-
ковые молекулы, практически нечего. Отличаются пептид-
ные гормоны друг от друга числом аминокислотных остатков
166
Живая клетка.indb 166 27.10.2009 11:40:11](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-166-320.jpg)
![Белок и его состояние в живой клетке
в полипептидной цепи, набором и последовательностью ами-
нокислот, образующих эту цепь.
Пептидные гормоны чрезвычайно легко присоединяются
к белковым молекулам (быстрее всего к их поверхности) и,
меняя их структуру, изменяют их функциональные свойства.
Как полагает Ю. Б. Филиппович [100], наиболее вероятным
приложением действия пептидных гормонов является регу-
ляция биосинтеза макромолекул и прежде всего информа-
ционных рибонуклеиновых кислот и белков-ферментов. Это
неизбежно ведет к сдвигам в обмене веществ и осуществле-
нии тех или иных функций в организме. Такого рода данные
получены при исследовании действия андренокортикотрон-
ного гормона и гормона роста.
Вполне возможно предполагать, что и другие пептидные
гормоны участвуют в регуляции нуклеинового и белкового
обмена. Не исключено, что пептидные гормоны, вклинива-
ясь в структуру мембран клеток, меняют их проницаемость.
Это ведет в свою очередь к изменению проникающих в клет-
ку глюкозы, аминокислот и других субстратов и кофакторов
клеточного обмена. Можно предполагать, что пептидный
гормон, ассоциируясь с белковой молекулой, играет роль ал-
лостерического регулятора. Этому будет, конечно, способ-
ствовать легкость образования водородных связей с пептид-
ной цепочкой молекулы белка.
2.5.4. Гормоны щитовидной железы
2.68. Тироксин
По химическому составу и строению гормоны щитовид-
ной железы отличаются от приведенных выше гормонов тем,
167
Живая клетка.indb 167 27.10.2009 11:40:11](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-167-320.jpg)

![Белок и его состояние в живой клетке
сом заряда будет происходить изменение КК-состояния бел-
ковой молекулы с изменением ее функциональных свойств,
а это в свою очередь ведет либо к упорядочиванию, либо к
нарушению клеточного обмена, если гормоны поступают к
клеткам в избытке.
Гипофункция щитовидной железы (гипотиреоидизм, ги-
потиреоз) вызывает у детей задержку роста, изменяет строе-
ние тела и задерживает умственное развитие. Этот вид пато-
логии известен под названием — кретинизм. Гиперфункция
щитовидной железы у человека приводит к возникновению
базедовой болезни, характеризующейся повышением основ-
ного обмена, усиленным распадом белковых тел тканей, нару-
шением функции сердечной мышцы. Увеличивается размер
щитовидной железы, возникает пучеглазие.
Таким образом, все гормоны так или иначе взаимодей-
ствуя с белковыми молекулами, меняют их свойства, что при-
водит к изменению клеточных структур, и в конечном счете
регулируют или нарушают жизнедеятельность всего орга-
низма. Каждый гормон, обладая специфической структурой,
взаимодействует с определенными белковыми молекулами,
что приводит к специфическим сдвигам в метаболической
системе клеток.
Современное состояние знаний о молекулярных механиз-
мах действия гормонов наиболее наглядно представлено в
обзоре Кулинского и Колесниченко [204]. Согласно взглядам
авторов, термин «гормоны» объединяет группу соединений,
являющихся специализированными и мобильными межкле-
точными регуляторами рецепторного действия [202−204].
При этом имеется в виду, что регуляторная функция являет-
ся главной, а, может быть, и единственной функцией гормо-
нов. Говоря о «межклеточном» действии гормонов, следует
понимать, что гормоны вырабатываются клетками и извне
действуют на клетки. Слово «мобильные» означает, что име-
ются в виду соединения, которые не закреплены в клеточном
матриксе.
169
Живая клетка.indb 169 27.10.2009 11:40:11](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-169-320.jpg)
![Белок и его состояние в живой клетке
Что означает «рецепторного действия»? Гормонональный
рецептор — это белок, специфически связывающий гормон,
что в конечном счете ведет к изменению свойств рецептора.
Обычно рецепторы состоят из 300–1200 аминокислот [205].
Различают «агонисты» — гормон и его аналоги, стимули-
рующие определенный рецептор, и «антагонисты» (блокато-
ры), предупреждающие эффект агонистов. Существуют и об-
ратные агонисты, они изменяют конформацию рецепторов и
даже при отсутствии агонистов дают противоположные им
эффекты. Гормон и рецептор одинаково важны для возник-
новения гормонального эффекта. Например, различают два
типа сахарного диабета — при первом типе недостаточно ин-
сулина, при втором — плохо или не работают рецепторы.
Бесплодие может быть связано не только с дефицитом по-
ловых гормонов, но отсутствием соответствующих функци-
ональных рецепторов. Не углубляясь далее в описание всех
сторон действия гормонов (читатель найдет их в цитируемых
работах) приведем только одну схему, иллюстрирующую со-
временные представления о регуляторном механизме дей-
ствия гормонов (рис. 56).
Так или иначе действие гормонов сводится к взаимодей-
ствию с белками и последующему изменению обменных про-
цессов. Остается без ответа вопрос о том, как осуществляется
эта и другие схемы в рамках авторегуляторных механизмов
клетки.
2.5.5. Гормоны растений
Хотя данные о регуляции морфогенетических процессов
у растений были получены раньше, чем у животных (еще в
1880 г. Ч. Дарвин объяснял поведение растений передвиже-
нием специфических веществ по растению), в дальнейшем
это наблюдение было незаслуженно забыто. Обстоятельно
этот вопрос стал рассматриваться только в начале XX в.
Специфика структурного построения организмов живот-
ных и растений (не обладающих нервной и имунной система-
170
Живая клетка.indb 170 27.10.2009 11:40:11](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-170-320.jpg)
![Живая клетка.indb 171
171
Рис. 56. Сигнал–трансдукторные системы клетки (общая схема) [204]:
цирк — циркуляционные, СТГ — соматотронные гормоны, ФРК — факторы роста клеток,
ИТ — йодтиронины, Р — рецептор, GБ — G-белок, Е — фермент, ТК — тирозинкиназа,
ЭПС — эндоплазматическая сеть, ПК — протеинкиназа, ТФ — транскрипционный фактор,
НR — гормонорецепторный комплекс.
Белок и его состояние в живой клетке
27.10.2009 11:40:11](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-171-320.jpg)
![Белок и его состояние в живой клетке
ми) не могла не отразиться на строении и способе функцио-
нирования веществ различной химической природы, хотя
термин «гормон» был предложен Фиттингом еще в 1909 г.
для объяснения течения физиологических процессов в рас-
тениях (цитировано по [217]).
Растения Животные
2.72. Брассинолид 2.73. Экдизон
Растения Животные
2.74. Абсцизовая кислота 2.75. Ретиноевая кислота
2.76. Ауксин 2.77. Серотонин
Все вопросы, связанные с физиологическим действием
фитогормонов, прекрасно освещены в работе Муромцева
172
Живая клетка.indb 172 27.10.2009 11:40:11](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-172-320.jpg)
![Белок и его состояние в живой клетке
и Данилиной [217]. Мы же ограничимся сравнением хими-
ческой природы гормонов растений и животных. Наиболее
четко родство этих соединений прослеживается на примере
терпеноидо-подобных гормонов (2.72–2.77).
Сравнительно новый класс фитогормонов — брасситосте-
роны, оказывающие главным образом ростстимулирующее
действие, обнаруживаемое, прежде всего, в молодых побегах
растений [218, 219]. Они довольно близки по структуре к сте-
роидным гормонам животных. Аналогичное сходство мож-
но обнаружить между абсцизовой и ретиноевой кислотами.
Естественно, нельзя ожидать полного совпадения структур
гормонов, но определенное родство имеет место. Имеющиеся
различия неизбежны тем более, что функциональная актив-
ность этих соединений различна. Имеет место также сход-
ство гормонов, являющихся производными аминокислот.
Все что отмечалось для витаминов и для гормонов, уча-
ствующих в построении физиологически действующих
живых структур, можно отнести и к фитогормонам. Прежде
всего, наличие в их молекулах π,π- и n,π-сопряженных систем,
благодаря которым обеспечивается подвижность электронов
за счет образования комплексов с переносом заряда с моле-
кулами белков. Свобода поворотов вокруг σ-связей боковых
группировок приводит к возникновению конформационных
изомеров, что увеличивает число микросостояний образую-
щихся комплексов.
Особое место в физиологии растений занимают терпе-
ноидные соединения. Являясь производными изопрена,
они синтезируются растениями в виде монотерпенов (С10),
сесквитерпенов (С15), дитерпенов (С20), тритерпенов (С30)
и выполняют многочисленные функции, хотя их роль для
растений не всегда до конца выяснена. Так, монотерпены со-
ставляют основу эфирных масел, которые служат агентами,
привлекающими насекомых, опыляющих цветковые расте-
ния, что обеспечивает продолжение рода соответствующих
живых организмов. Дитерпены обеспечивают заживление
173
Живая клетка.indb 173 27.10.2009 11:40:11](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-173-320.jpg)
![Белок и его состояние в живой клетке
ран на растениях и т. д. Для животных организмов, главным
образом для человека, важность этих соединений очевидна:
вся парфюмерная промышленность базируется на монотер-
пеновых эфирных маслах; среди сесквитерпеновых соедине-
ний встречаются многочисленные лекарственные препараты.
Химия терпеноидов — это особая отрасль науки. Ее осно-
вы достаточно подробно изложены в монографии Г. В. Пигу-
левского [285]. Обращаясь к структуре обсуждаемых соеди-
нений, можно видеть, что здесь также присутствуют π,π- и
n,π- сопряженные системы, имеется возможность конформа-
ционных переходов, широко представлена Et -изомерия. При
этом подавляющее большинство соединений обладает вы-
сокой степенью гидрофобности. Ни один из представителей
терпенов животными организмами не синтезируется.
2.6. Макроэрги
Согласно общепринятым представлениям, энергия, не-
обходимая клеткам для осуществления процессов синтеза
нужных им соединений, течения эндотермических реакций,
выполнения работы живой системой, запасается и извлекает-
ся при гидролизе макроэргических связей в так называемых
макроэргических соединениях. Попробуем понять механизм
использования энергии макроэргических связей в клетке, по-
знакомившись со структурой упомянутых соединений. Про-
стейшим соединением этого типа является фосфоенолпиро-
виноградная кислота (ФЕПК):
2.78. Фосфоенолпировиноградная
кислота
2.79. Креатинфосфат
174
Живая клетка.indb 174 27.10.2009 11:40:11](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-174-320.jpg)

![Белок и его состояние в живой клетке
Макроэргическая связь между кислородом и фосфором,
с двух сторон которой расположены n,π-сопряженные груп-
пировки, также легко гидролизуется.
Но основным макроэргом является аденозинтрифосфор-
ная кислота (АТФ), так как перечисленные только что макро-
эрги образуются с ее участием. Известно, что АТФ содержится
во всех живых организмах и принимает участие практически
во всех процессах, протекающих в клетках животных и рас-
тений независимо от их сложности.
Что же определяет такую универсальность этого соеди-
нения? Структура АТФ, согласно классическим представле-
ниям и с частичным учетом стереохимии, изображена фор-
мулой 2.81.
Это в том случае, когда остаток рибозы находится в фор-
ме фуранозы. Однако молекула рибозы может находиться и
в форме пиранозы. В водном растворе преобладающей будет
именно пиранозная форма ([211], с. 210). На рис. 57 представ-
лено равновесие между этими двумя формами в водном рас-
творе. Более подробную информацию об этом читатель най-
дет в работе Гаррета и Дворчика [212]∗.
Рис. 57. Равновесные состояния молекулы рибозы в водном растворе [211].
∗ Данных о возможности существования молекулы АТФ, где рибоза
будет присутствовать в виде шестичленного кольца, в литературе пока
не обнаружено.
176
Живая клетка.indb 176 27.10.2009 11:40:11](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-176-320.jpg)
![Белок и его состояние в живой клетке
Кроме аденозинтрифосфорной кислоты, в живых системах
обнаружены цитозинтрифосфорная кислота (ЦТФ), гуано-
зинтрифосфорная кислота (ГТФ) и уридин-5ʹ-трифосфорная
кислота (УТФ). Все эти соединения содержат в своем составе
не менее двух макроэргических связей.
Используя атомные модели Курто, А. Сент-Дьерьи ([215],
с. 83) предложил две формы молекулы АТФ («вытянутую»
и «свернутую», см. рис. 58).
Рис. 58. Молекулярная модель АТФ в вытянутом
(вверху) и свернутом (внизу) состоянии [215].
2.82. Комплекс АТФ с Mg++
Молекула АТФ в «свернутом» состоянии может удержи-
ваться за счет возможности образовывать комплекс с ионами
магния ([215], с. 85). В возникающем комплексе (2.82) делока-
лизованные электроны пирофосфатной цепи могут переме-
177
Живая клетка.indb 177 27.10.2009 11:40:11](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-177-320.jpg)
![Белок и его состояние в живой клетке
щаться на адениновую часть молекулы. Сент-Дьерьи считает,
что это не является случайным, а имеет функциональное зна-
чение.
Сент-Дьерьи еще в 1964 г. ([216], с. 108) предпринял по-
пытку всесторонне осветить роль АТФ в поддержании жи-
вого состояния. Основной упор сделан им на способность
молекулы данного макроэрга передавать электроны от пиро-
фосфатной части молекулы на остаток аденина, когда возни-
кает хелатный комплекс с участием иона магния.
Не излагая далее взглядов Сент-Дьерьи, приведенных в
цитируемой работе, снова обратимся к множественности
конформационных изомеров, в том числе и к «вытянутой»
форме молекулы. В этом случае молекула АТФ становится од-
новременно донором и акцептором электронов и благодаря
наличию в обеих частях молекулы двух (изолированных ри-
бозой) сопряженных систем может образовывать комплексы
с переносом заряда, образуя «мостики», с одной стороны, с
донором, а с другой, с акцептором электронов, активируя од-
новременно протекание двух реакций. Флуктуации молекулы
АТФ за счет остатка рибозы резко расширяет возможности
соединения принимать участие в большинстве процессов,
протекающих в клетке, даже морфология которой зависит от
АТФ. Мы уже встречались с тем (см. главу 1), что дискоид-
ная (живая) форма эритроцитов сохраняется до тех пор, пока
есть возможность осуществления синтеза этого макроэрга.
Присутствие электроотрицательных гетероатомов (O, N,
P) в структуре АТФ приводит к специфическому распреде-
лению зарядов в молекуле данного соединения ([210], с. 292),
что обеспечивает специфичность молекулы в целом. Таким
образом, АТФ выступает, с одной стороны, в качестве специ-
фического кофактора, а с другой стороны, благодаря множе-
ственности конформационных изомеров ее можно относить
к неспецифическим агентам. Это подтверждается участием
АТФ практически во всех процессах, протекающих в живой
клетке (что нами уже отмечалось).
178
Живая клетка.indb 178 27.10.2009 11:40:11](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-178-320.jpg)



![Белок и его состояние в живой клетке
2.12. Гистидин 2.87. Гистамин
Наиболее часто применяется лекарственный препарат,
содержащий L-гистидин, получаемый из эритроцитов крови
лошадей или быков ([214], с. 47−50). Этот препарат приме-
няется при язвенной болезни желудка и двенадцатиперстной
кишки, так как недостаток гистидина обусловливает ненор-
мальное состояние тканей, в том числе и болезненное состоя-
ние оболочки желудка. Под действием бактерий Bacillus coli
гистидин (2.12) превращается в гистамин (2.87)
Гистамин расширяет кровеносные сосуды и вызывает па-
дение кровяного давления, являясь антагонистом адренали-
на. Применяется гистамин для лечения желудочного тракта,
а также при бронхиальной астме, различных аллергических
состояниях, при суставном и мышечном ревматизме. К со-
жалению, широта действия гистамина препятствует его ши-
рокому применению, так как имеет место побочное действие
препаратов, содержащих гистамин.
Легко видеть, что и гистидин, и гистамин содержат в сво-
ей структуре сопряженную группировку с участием атомов
азота, что приводит к неравномерному распределению за-
рядов в пятичленном цикле. Это облегчает взаимодействие
соединений с молекулами белка путем образования комплек-
сов с переносом заряда. Связанный с пятичленным циклом
подвижный фрагмент молекулы обеспечивает возможность
взаимопереходов конформеров благодаря поворотам вокруг
σ-связей.
Препараты, содержащие витамины, широко применяют-
ся при лечении заболеваний, связанных с недостаточным
182
Живая клетка.indb 182 27.10.2009 11:40:11](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-182-320.jpg)
![Белок и его состояние в живой клетке
Рис. 32. Схема, иллюстрирующая место фолдинга белка в процессе
биосинтеза [104].
Рис. 33. Энергетическая поверхность, определяющая пути сворачива-
ния белка в нативном состоянии [104].
183
Живая клетка.indb 183 27.10.2009 11:40:11](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-183-320.jpg)
![Белок и его состояние в живой клетке
Рис. 36. Строение комплекса кальмо-
дулина Paramecium tetraurelia с ионами
кальция по данным рентгенострук-
турного анализа [131].
Рис. 37. Пространственная (а) и ленточная
диаграмма (б) молекулы рековерина — свобод-
ная от кальция (слева) и со связанным кальци-
ем (справа) [130].
184
Живая клетка.indb 184 27.10.2009 11:40:12](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-184-320.jpg)
![Живая клетка.indb 185
185
1 2
Рис. 53. Структура комплекса между цитохромом f и пластоцианином, выделенного из цианобактерий Nostoc,
охарактеризованного с помощью ядерного магнитного резонанса [195]: 1 — объёмная модель; 2 — ленточная
модель.
Белок и его состояние в живой клетке
27.10.2009 11:40:12](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-185-320.jpg)
![Белок и его состояние в живой клетке
Рис. 54. Пространственная структура молекулы актина [213].
Показаны триптофановые остатки (красным), тирозиновые остат-
ки (синим), катионы Са++ (желтым) и молекула АТФ (зеленым).
1 2
Рис. 55. Локализация отрицательно и положительно заряженных
групп, а так же атомов кислорода групп С = O на поверхности ма-
кромолекулы актина [213]. Снимки 1 и 2 отличаются друг от друга
поворотом молекулы на 180° вокруг вертикальной оси.
186
Живая клетка.indb 186 27.10.2009 11:40:12](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-186-320.jpg)

![Белок и его состояние в живой клетке
ным эффектом. Можно смело утверждать, что подавляющее
большинство органических соединений, которые наделены
физиологическим действием и могут использоваться в каче-
стве лекарственных средств, имеют в своем составе группи-
ровки содержащие π,π- или n,π-сопряженные системы. Что-
бы не быть голословными, приведем структурные формулы
некоторых лекарственных препаратов (2.88–2.99)∗.
2.92. Пирамидон 2.93. Антипирин
2.94. Анальгин 2.95. Адреналин
2.96. Никотин 2.97. Кокаин
∗ Подробную информацию о подавляющем большинстве лекарств чи-
татель найдет в фундаментальном руководстве Преображенского и Ген-
кина [214].
188
Живая клетка.indb 188 27.10.2009 11:40:12](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-188-320.jpg)
![Белок и его состояние в живой клетке
Механизм действия сопряженных систем, возможно, свя-
зан с образованием комплексов с переносом заряда или с об-
разованием водородных и дисперсионных связей с молекула-
ми белка, что изменяет течение процессов, катализируемых
белками-ферментами.
Все сказанное в полной мере относится к антибиотикам
типа пенициллина, стрептомицина, левомецитина, ауто-
мицина и террамицина (их структурные формулы читатель
найдет в цитированной работе [214]). Иначе построены анти-
биотики типа грамицидина, которые являются сравнительно
низкомолекулярными полипептидами. Их взаимодействие
будет напоминать белок–белок взаимодействие.
2.98. Хинин 2.99. Фенотиазин
Сейчас уже ни для кого не секрет, что практически все
лекарственные препараты обладают побочными эффектами.
Врачам часто приходится решать проблему — назначать или
не назначать тот или иной препарат, если можно ожидать,
что побочное (вредное) воздействие препарата превзойдет
его положительный эффект. Объясняется побочное действие
тем, что структура препаратов не строго специфична и впол-
не вероятно воздействие не только на определенный белок,
который нужно «исправить», но и на другие белки, что и при-
водит к неизбежным нарушениям.
В этом отношении использование лекарственных расте-
ний для изготовления лекарственных препаратов во много
раз более безопасно и эффективно, так как экстракты лекар-
ственных трав содержат сотни, а то и тысячи соединений, со-
189
Живая клетка.indb 189 27.10.2009 11:40:12](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-189-320.jpg)
![Белок и его состояние в живой клетке
держащих π,π- или n,π-сопряженные системы в ничтожных
концентрациях и тогда побочные воздействия на клетку сво-
дятся к минимуму. Об этом пойдет речь в следующей главе.
2.9. Яды и противоядия
До сих пор в данной работе мы обсуждали проблемы,
связанные со структурой и функционированием белка, имея
виду нормальное физиологическое состояние живой клетки.
Необходимо хотя бы вкратце остановиться на вопросах влия-
ния на белок (следовательно, на живую клетку и организм)
соединений, повреждающих белковую молекулу.
Наиболее обстоятельно этот вопрос освещен в моногра-
фии Оксекгендлера «Яды и противоядия» [232]. Если мы по-
пытаемся представить себе воздействие на белковые молеку-
лы химических соединений, то столкнемся с очень мрачной
картиной: фактически нет химических веществ, которые не
вызывали бы повреждений функционирующей белковой мо-
лекулы. Все дело в концентрации вещества попадающего в
окружающую среду клетки.
Даже в случае отсутствия у химического соединения тех
или иных реакций с веществами клетки, вредное воздействие
будет всегда иметь место, так как при высоких концентраци-
ях инертное вещество будет препятствовать нормальному
обмену веществ клеток. К таким веществам можно отнести
предельные углеводороды, азот, инертные газы и т. д. Но сей-
час не о них поведем речь. Нам важно понять, как действуют
яды, ничтожной концентрации которых достаточно, чтобы
убить клетку, повредив естественно, ее белковое содержимое,
главным образом, ферментативную систему.
Некоторые авторы делят яды на группы: Покровский [233]
на 9 групп, Голиков и Тиунов [235, 236] выделяют 11, Локтио-
нов [234] — 23 группы веществ.
Грин и Гольдбергер [89] подразделяли яды всего на
2 группы веществ. К первой группе они отнесли вещества,
190
Живая клетка.indb 190 27.10.2009 11:40:12](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-190-320.jpg)
![Белок и его состояние в живой клетке
взаимодействующие со многими компонентами клеток,
и в молекулярном плане их действия «напоминают слона в
посудной лавке». Поскольку избирательность их действия
мала, то основное количество вещества расходуется впустую
на взаимодействие с второстепенными звеньями клеточного
метаболизма. К таким веществам, например, относятся хло-
рамины. Яды второго типа взаимодействуют с одним опреде-
ленным компонентом клетки, специфически поражая ту или
иную мишень.
В этом плане, как считает Покровский ([233], с. 61), яды
можно рассматривать в качестве инструментов, позволяю-
щих выяснять структуру функциональных белков. Он пишет:
«В то же время яды являются тонкими инструментами, по-
зволяющими «препарировать» функциональные структуры
активных центров ферментов и порой с известной точностью
оценивать расстояния между отдельными функциональными
группами в молекуле белка, которые, несмотря на определен-
ную степень свободы конформации и флуктуации простран-
ственного расположения отдельных групп, все же способны
к осуществлению акта биологического катализа только при
соблюдении достаточно строгих условий пространственной
конфигурации».
К простейшим представителям таких ядов можно от-
нести синильную кислоту, окись углерода, диоксид азота
(2.100–2.102), некоторые фосфорорганические соединения
(2.103–2.105).
Посмотрим, что общего можно обнаружить в структуре
соединений, обладающих такого рода ядовитыми свойства-
ми. С этой целью приведем структурные формулы некоторых
токсических веществ.
2.100. Окись углерода 2.101. Синильная кислота 2.102. Диоксид азота
191
Живая клетка.indb 191 27.10.2009 11:40:12](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-191-320.jpg)
![Белок и его состояние в живой клетке
Что касается окиси углерода и синильной кислоты, то
здесь налицо сильное недонасыщение углеродных атомов.
В таком случае оба вещества в состоянии блокировать соот-
ветствующие белки: окись углерода — гемоглобин, синиль-
ная кислота — нервные центры, управляющие движением.
Диоксид азота является свободным радикалом и действу-
ет на системы, подверженные окислению: соединения, содер-
жащие SH-группы, аскорбиновую кислоту. Вследствие это-
го снижается активность целого ряда ферментов, таких как
глюкозо-6-фосфатдегидрогеназа, глутатионредуктаза, глута-
тионпероксидаза. При восстановлении содержания глутатио-
на и аскорбиновой кислоты, действие яда нивелируется [235].
В случае фосфорганических соединений, когда в молеку-
лу, содержащую сопряженные системы и гетероатомы — кис-
лород, фосфор, азот и серу, включается еще более электро-
отрицательный элемент фтор, возникают необычно высокие
величины зарядов. Тогда при взаимодействии с молекулами
белка блокируется их нормальное функционирование, что в
свою очередь приводит к метаболическим нарушениям и ги-
бели клеток. Подтверждением этих предположений является
то, что диизопропилфторфосфат (2.103), теряя атом фтора,
одновременно лишается токсичности. Хотя тиофос (2.104)
под действиеь тиооксидазы переходит в еще более токсичный
фосфакол (2.105).
2.103. Диизопропилфторфосфат
2.104. Тиофос 2.105. Фосфакол
192
Живая клетка.indb 192 27.10.2009 11:40:12](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-192-320.jpg)
![Белок и его состояние в живой клетке
Согласно взглядам Покровского ([233], с. 62), наиболее
распространенной и многочисленной группой ядов являются
вещества, структура которых родственна строению соответ-
ствующих субстратов ферментов (снова сталкиваемся с воз-
действием на белковые молекулы). Речь в этом случае идет
об ингибировании ферментативных процессов. Наиболее из-
ученными примерами ядов этого типа являются антихолинэ-
стеразные соединения. При ингибировании холинэстеразы в
физиологических условиях в клетках накапливается ацетил-
холин, проницаемость мембран изменяется, и генерируются
биоэлектрические потенциалы, в результате возникает пере-
возбуждение холинэргических структур. Сила ингибирую-
щего действия зависит не только от структурного подобия
субстрата и ингибитора, но и от прочности образующегося
комплекса ингибитор—фермент, что в свою очередь зависит
также от структуры реагирующих соединений.
Продемонстрировать влияние структуры на направлен-
ность и течение биохимических процессов можно на приме-
ре ферментных систем, участвующих в обмене урацила. Так,
фторзамещенный урацил (2.106) блокирует обмен урацила
(2.107), бромзамещенный урацил (2.109) — обмен тимина
(2.108).
2.106. Фторурацил 2.107. Урацил
2.108. Тимин 2.109. Бромурацил
193
Живая клетка.indb 193 27.10.2009 11:40:12](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-193-320.jpg)
![Белок и его состояние в живой клетке
К токсичным веществам можно отнести и снотворные
соединения, которые в повышенных дозах могут привести
к смертельному исходу. Если обратимся к структурной фор-
муле известного снотворного — люминала (2.110), то легко
видеть, с одной стороны, наличие все тех же сопряженных
систем, с другой стороны, отсутствие чрезмерно электронак-
цепторных группировок или атомов.
2.110. Люминал
Здесь мы сталкиваемся с чрезвычайно интересным фено-
меном: практически все лекарственные препараты являются
одновременно и ядами при их определенной дозировке. Вве-
ден даже так называемый «терапевтический индекс», кото-
рый чрезвычайно важен для врача ([89], с. 341).
Токсическая доза
Терапевтический индекс =
Терапевтическая доза
При большой величине этого отношения лекарственным
препаратом пользоваться безопасно. Если же индекс равен
единице или меньше, то это скорее яд, чем лекарственный
препарат, и пользоваться им нельзя, за исключением проти-
воопухолевых препаратов, которыми пользуются, надеясь
убить раковые клетки, оставив в целости здоровые (но это
уже область, которую обсуждать здесь нет возможности).
Стоит рассмотреть еще один аспект проблемы — когда
ядовитыми свойствами обладает не само соединение, а веще-
ство, синтезируемое на его основе. Фторацетат, токсичность
194
Живая клетка.indb 194 27.10.2009 11:40:12](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-194-320.jpg)
![Белок и его состояние в живой клетке
которого обнаруживалась для многих животных, оказался на
самом деле безвредным, а его токсичность обуславливается
фторлимонной кислотой, образующейся на основе фтораце-
тата ([233], с. 64). В молекуле этой кислоты атом фтора вы-
зывает за счет индукционного эффекта сильное смещение
электронов карбоксильной группы, что, по-видимому, по-
вышает стабильность энзим-субстрактного комплекса, что
в свою очередь затрудняет действие аконитазы и приводит
к накоплению фторлимонной кислоты (сокращенная схема
процесса представлена ниже). В конечном счете может иметь
место летальный исход. Такого рода действие ядов именуется
«летальным синтезом» ([233], с. 67).
2.111. S-Коэнзим А 2.112. Щавелевоуксусная
кислота
2.114. Аконитовая кислота 2.113. Фторлимонная кислота
2.115. 3,4-Бензпирен 2.116. Диметилнитрозамин
195
Живая клетка.indb 195 27.10.2009 11:40:12](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-195-320.jpg)
![Белок и его состояние в живой клетке
Особой группой «ядов», не вызывающих немедленных
летальных исходов, являются канцерогены. Они обычно дей-
ствуют в низких концентрациях и способны либо накапли-
ваться в тканях и приводить к малигнизации тканей, как, на-
пример, полициклический углеводород 3,4-бензпирен (2.115)
[282], либо вызывать опухолевый рост при однократном по-
падании в организм животного или человека, как например,
алкилнитрозамины. Наиболее сильным канцерогеном из них
является диметилнитрозамин (2.116).
У нас сейчас нет возможности обсуждать все свойства хи-
мических канцерогенов, но уже из приведенных двух струк-
тур видно, что и здесь мы имеем наличие сопряженных π,π- и
n,π-сопряженных систем. Однако, как ни для одного другого
класса токсичных соединений, для канцерогенов важна про-
странственная структура их молекул. Читатель найдет под-
робное обсуждение специфики канцерогенного действия в
специальной литературе [282–284], посвященной описанию
химического канцерогенеза.
Не останавливаясь далее на особенностях действия и про-
тиводействия ядов и противоядий, что в большей степени ка-
сается уже высших организмов и достаточно полно изложе-
но в работе Оксенгендлера [232], перейдем к вопросу о роли
сопряженных систем для построения и функционирования
белковых молекул.
2.10. Роль сопряжения в пос троении
белковых с труктур
При рассмотрении приведенных выше структурных фор-
мул важнейших классов органических соединений, участву-
ющих в построении и функционировании структур на осно-
ве белковых молекул, легко видеть, что системы, содержащие
группировки атомов с сопряженными связями, настоль-
ко распространены, что автор данной работы уже в конце
196
Живая клетка.indb 196 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-196-320.jpg)
![Белок и его состояние в живой клетке
1960-х гг. [226] пришел к выводу, что нельзя познать специ-
фику живого состояния, игнорируя специфические особен-
ности сопряженных систем.
Познакомимся с высказываниями по этому поводу веду-
щих специалистов, много сделавших для развития теоретиче-
ской биологии. Так, Пюльманы ([210], с. 546–547) сообщают:
«Этот тщательный выбор, сделанный природой в отношении
блоков, из которых состоят биохимические соединения, дол-
жен иметь большое значение для строения этих соединений,
и поэтому не было неожиданностью наблюдать (хотя этот
аспект биохимии, по-видимому, не был отмечен ранее), что
все наиболее важные биохимические вещества, связанные с
основными функциями живой материи или осуществляю-
щие эти функции, представляют собой полностью или, по
крайней мере, частично сопряженные системы».
Авторы также указывают: «Поскольку природа не про-
щает излишеств, и поскольку эти соединения являются от-
носительно сложными, очевидно, они обладают некоторой
существенной особенностью, которая приводит к тому, что
успешно участвуют в процессах жизнедеятельности. Этой
особенностью едва ли может быть что-нибудь иное, чем де-
локализация электронов…».
В этой же работе утверждается: «Динамичность жизни со-
гласуется с динамичностью электронного облака в сопряжен-
ных молекулах. Следовательно, такие системы можно рас-
сматривать и как главную структуру, и как главную основу
жизни».
Сент-Дьерьи придавал и в «Биоэнергетике» [215] и в «Суб-
молекулярной биологии» [216] очень большое значение дина-
мичности электронных облаков для осуществления процес-
сов, без которых немыслимо живое состояние. Естественно,
что это достигается благодаря присутствию в молекулах бел-
ка и других жизненно важных соединений π-электронов, π,π-
и n,π-сопряженных систем ([215], с. 24), способных легко воз-
буждаться, поглощая энергию hν, с переходом π-электронов в
197
Живая клетка.indb 197 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-197-320.jpg)
![Белок и его состояние в живой клетке
π*-возбужденное состояние, где энергетический уровень Е*
выше исходного уровня Е.
Еще в 1941 г. Ж. Вейс [222] выдвинул гипотезу, согласно
которой при сближении двух молекул на достаточно близ-
кое расстояние (~ 3,0–3,5 Å) возможен переход электрона от
одной молекулы к другой. Позже Р. Мэлликен с сотр. [220,
221] развили теорию комплексов с переносом заряда. Пере-
ход электрона имеет место, когда от молекулы, имеющий до-
статочно низкий ионизационный потенциал (ИП), он ухо-
дит к молекуле, обладающей достаточно высоким сродством
к электрону (ЭС). Первая молекула именуется донором (Д),
а вторая — акцептором (А). Этот процесс в общем виде мо-
жет быть представлен в следующем виде:
Образовавшийся комплекс, в зависимости от соотноше-
ния ИП и ЭС, может либо какое-то время существовать за
счет возникающих сил — ионных, полярных, дисперсионных
и т. д., либо распадаться с образованием катионов и анио-
нов, либо возникновением двух свободных радикалов. Все
это достаточно подробно изложено в работе А. Сент-Дьерьи
([216], с. 59–101).
Теперь нам ясно, что все биологически важные орга-
нические молекулы, содержащие π-электроны, π,π- и n,π-
сопряженные системы, обладая повышенной лабильностью
электронов и имеющие в своем составе электроотрицатель-
ные атомы (N, O, S, P), при сближении и определенном про-
странственном расположении, способны образовывать ком-
плексы с переносом заряда. Последние за счет резонанса
образовавшихся Д и А (при возникновении общей молеку-
лярной орбитали) снижают энергию системы.
Что же можно сказать о возможном участии молекулы
белка в образовании комплексов с переносом заряда? Мы уже
отмечали, что пептидная группировка в молекуле белка ко-
198
Живая клетка.indb 198 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-198-320.jpg)
![Белок и его состояние в живой клетке
планарна и содержит n,π-сопряженную систему, в образова-
нии которой участвуют π-электроны карбонильной группы
и свободная электронная пара атома азота. Естественно, эта
группировка может вступать в донорно-акцепторное взаи-
модействие с веществами, также обладающими π-связями
или гетероатомами со свободными электронными парами,
что нами отмечалось при рассмотрении структур витаминов,
гормонов, коферментов, макроэргов, лекарственных препа-
ратов и ядов. Эти возможности возрастают, если мы учтем
наличие остатков тирозина, фенилаланина, триптофана в по-
липептидной цепи, а также аминокислот, содержащих амино-
группы и карбоксилы.
По-видимому, образование комплексов с переносом за-
ряда стабилизирует белковую структуру, что наблюдается в
эксперименте. Так, оксидаза d-аминокислот стабилизируется
флавин-аденин нуклеотидом [227], в присутствии кофермен-
та меняется КК-состояние аспартат-трансаминазы [223, 227],
молекула D-глицеральдегид-3-фосфодегидрогеназы, присое-
динив кофермент, становится более устойчивой к действию
трипсина [230, 231] и мочевины [229].
Лактатдегидрогеназа и алкогольдегидрогеназа при экви-
молекулярном количестве дифосфопиридин-динуклеотида
стабилизируются к действию мочевины и повышенной тем-
пературы [228, 229], а также к действию детергентов [231],
аспартат-апотрансаминаза сердца и холотрансаминаза, при-
соединив пиридоксальфосфат, изменяет свое КК-состояние,
что установлено при использовании дисперсии оптического
вращения, водородно-дейтериевого обмена и иммуннохими-
ческого метода.
Как уже отмечалось (раздел 2.6), молекула АТФ в присут-
ствии магния может принимать конформацию, когда появля-
ется возможность переноса электрона от сопряженной цепи
фосфатной группировки к сопряженной системе аденина.
Сент-Дьердьи допускал, что молекула миозина, образуя ком-
плекс с переносом заряда с молекулой АТФ и активизируя ее,
199
Живая клетка.indb 199 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-199-320.jpg)

![Белок и его состояние в живой клетке
планарность становится неустойчивой. Наиболее точно оха-
рактеризованы свойства полисопряженных систем в обзоре
Берлина с сотр. [224]: «Вещества, в молекулах которых орди-
нарная связь находится между двумя двойными связями или
располагается между кратной связью и атомами с неподелен-
ными парами р-электронов, отличаются от соединений с изо-
лированными (несопряженными) кратными связями. Для та-
ких веществ характерны более высокая термодинамическая
устойчивость, уменьшение длины ординарных связей, длин-
новолновый сдвиг в электронных спектрах и ряд принципи-
альных отличий в реакциях присоединения и замещения».
Огромный интерес представляет возможность удлинения
полисопряженной цепи за счет кратных связей, имеющихся
внутри молекулы, что мы наблюдали на примере молекул ви-
тамина А и других каротиноидов. Интересны также межмо-
лекулярные комплексы, когда к сопряженной системе одной
молекулы присоединяется сопряженная система другой мо-
лекулы. Такая ситуация, о чем мы уже упоминали, имеет ме-
сто в случае сближения молекулы белка и молекул кофакто-
ров (витаминов, гормонов, коферментов, макроэргов и т. д.).
При этом, с одной стороны, резонансные взаимодействия
снижают уровень свободной энергии и стабилизируют систе-
му в целом. Но с другой стороны, требование копланарности
снижает устойчивость образовавшегося комплекса. Возника-
ет ситуация «игры»: комплексы образуются, но в силу тепло-
вого движения молекул тут же распадаются. Так как комплек-
сы обладают определенными физиологическими свойствами,
имеет место «игра» функциональных, главным образом, фер-
ментативных свойств, что неизбежно приводит к изменению
метаболизма в целом.
Как же может проявить себя обсуждаемая «игра» белко-
вых молекул? Легкость поляризуемости, легкость перехода
электронов от одной молекулы к другой, легкость возникно-
вения возбужденных состояний неизбежно приводят к из-
лучению квантов энергии, что и было постулировано Сент-
201
Живая клетка.indb 201 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-201-320.jpg)
![Белок и его состояние в живой клетке
Дьерьи [215, 216] и подтверждено Баренбоймом, Доманским
и Туроверовым [136, 225], обобщившими экспериментальные
данные, имеющиеся на то время в литературе и приведенные
в их монографии «Люминесценция белков и клеток».
Не излагая подробно сведения, содержащиеся в данной
монографии, отметим только, что впоследствии люминес-
ценция, фотолюминесценция, фосфоресценция стали неза-
менимыми инструментами, позволяющими выяснять тонкие
черты строения и динамики белка in vitro и in vivo.
В конечном счете мы подошли к ситуации, когда, говоря
о состояниях белковой молекулы в клетке, нельзя игнориро-
вать ее динамику, связанную с флуктуациями цепи, а также
переходы электронов π-связей, π,π- и n,π-сопряженных си-
стем от атома к атому функционирующей молекулы.
Волькенштейн с сотр. [237–239], изучая различные гем-
содержащие белки — миоглобин и гемоглобин, а так же
фермент-субстрактные комплексы ряда белков, пришли к
выводу, что конформационные флуктуации белковых глобул
взаимосвязаны с переносом электронов в белках. Это дало
им возможность говорить об электронно-конформационных
взаимодействиях в белковых молекулах (ЭКВ)∗.
2.11. Белок в живой клетке
Прежде чем обсуждать данную проблему, приведем дан-
ные о количестве различных белков и распределении их
молекул в органеллах (компартментах) живых клеток. Счи-
тается, что клетка млекопитающих содержит около 10 милли-
ардов молекул белка примерно 10 000 различных типов ([245],
т. 2, с. 5). Что касается их распределения, то в недавно опубли-
кованной работе Ю-Донга и Кая [243, 244] приведены данные
о распределении 3555 различных белков в 22 внутриклеточ-
ных органеллах пекарских дрожжей (см. табл. 2.5).
∗ Еще раз подчеркнем, что в действительности имеем дело с электронно-
конформационно-конфигурационными взаимодействиями (ЭККВ).
202
Живая клетка.indb 202 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-202-320.jpg)
![Белок и его состояние в живой клетке
Таблица 2.5
Распределение 3555 белков в 22 внутриклеточных
органеллах, согласно экспериментальным данным [243]
Внутриклеточная локализация Число белков
Актин 29
Почки 23
Шейка почки 60
Периферия клетки 106
Цитоплазма 1576
Раннее Гольджи 51
Эндосома 43
Эндоплазматический ретикулум 272
Переход от эндоплазматического
6
ретикулума к Гольджи
Гольджи 40
Позднее Гольджи 37
Жировые частички 19
Микротрубочки 20
Митохондрии 494
Периферия ядра 59
Ядрышко 157
Ядро 1333
Пероксисома (лизосома) 20
Полюс веретена 58
Мембраны вакуолей 54
Вакуоли 129
Другие органеллы 123
Всего: 3555
Приводя данные о распределении 3555 типов белков, ав-
торы отмечают, что часть белковых молекул может встраи-
203
Живая клетка.indb 203 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-203-320.jpg)
![Белок и его состояние в живой клетке
ваться не в одну, а в несколько органелл и тогда число вклю-
ченных в них белков увеличивается до 4709. Встраиваясь в ту
или иную органеллу, белковая молекула должна (неизбежно)
принимать свое КК-состояние в зависимости от соответству-
ющего окружения. При этом состояние и самой органеллы не
остается постоянным.
Мы уже видели, что форма и размеры митохондрий из-
меняются при покое и активном функционировании [52].
Мембраны перестраиваются, меняют свою проницаемость,
в липидный слой встраиваются белки и т. д. Прижизнен-
ное состояние белковых молекул наблюдать крайне сложно.
Поэтому постоянно возникают дискуссии о состоянии белка
в живой клетке.
В первой главе, излагая взгляды Бауэра на проблему «жи-
вого белка», мы отмечали правоту автора, отрицавшего су-
ществование этого феномена, хотя он допускал особое «жи-
вое состояние» белковой молекулы. Последующее развитие
биохимиии привело к возникновению новой науки — моле-
кулярной биологии. Основной задачей новой науки явилось
решение проблем, связанных с синтезом и последующим
функционированием белка.
К глубокому сожалению, на фоне выдающихся успехов
новой науки, были проигнорированы выводы сторонников
особого состояния белка в живой клетке, хотя еще в 1956 г.
Цыперович [115] писал: «Белок, выделенный и очищенный
даже при применении наиболее осторожных приемов, несо-
мненно, не тождественен тому же белку в естественных усло-
виях». Это, по-видимому, не относится к белкам-ферментам,
функционирующим в пищеварительном тракте, но в этом ни-
чего удивительного нет, так как и пепсин, и химотрипсин, и
трипсин, попадая в пищеварительный тракт, внутриклеточ-
ными белками уже не являются.
В дальнейшем, Антонини с сотр. [240], изучая реакцию
связывания красителей гемоглобином, получили ряд экс-
периментальных фактов, подтверждающих точку зрения об
204
Живая клетка.indb 204 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-204-320.jpg)
![Белок и его состояние в живой клетке
особом состоянии белка в живой клетке. Они обнаружили
изменения кинетики связывания кислорода и поглощения
красителей в зависимости от того, находится ли гемоглобин
в эритроците или в растворе, что, по их мнению, связано с
изменением конформационного состояния белковой моле-
кулы. Автором данной работы при использовании жидкост-
ной хроматографии зафиксированы структурные изменения
молекул гемоглобина при повреждающих воздействиях на
эритроциты (см. раздел 2.2). Одновременно это же было под-
тверждено работами, проводившимися в институте Цитоло-
гии АН СССР под руководством Брауна [241, 242].
Несмотря на приведенные в литературе эксперименталь-
ные данные, в последнее время в этом же институте отстаи-
вается точка зрения, что белок в клетке находится в нативном
состоянии (благодаря энергетической воронке) в минимуме
свободной энергии G, изменяющейся согласно уравнению:
При этом говоря о «густонаселенности» клеточного содер-
жимого не учитывается влияние компонентов, присутствую-
щих в клетке, на величину структурной свободной энергии
белковой молекулы [104, 110]. Наиболее вероятно, что благо-
даря возможности протекания КК-перестроек молекул белка
за счет их взаимодействия с внутриклеточными компонента-
ми и с учетом условий окружающей среды, мы не будем иметь
простого стремления к минимуму свободной энергии вне за-
висимости от упомянутых факторов.
Тогда сразу возникает вопрос — какое состояние белка
мы будем считать нативным состоянием, и какое — денату-
рированным? Под денатурированным состоянием сейчас уже
можно однозначно и определенно понимать состояние разу-
порядоченного, хаотически свернутого клубка, не обладаю-
щего никакой физиологической активностью и не способ-
ного выполнять никакой иной функции, кроме как служить
объектом для атаки протеолитических ферментов с перево-
205
Живая клетка.indb 205 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-205-320.jpg)
![Белок и его состояние в живой клетке
дом денатурированного белка в низкомолекулярные компо-
ненты, используемые клеткой для обеспечения ее метаболиз-
ма и катаболизма.
Гораздо сложнее обстоит дело с понятием «нативное со-
стояние». В последнее время появились термины: «проме-
жуточные» состояния [102–108] (между нативным и дена-
турированным), «ненативные» состояния (расплавленные
глобулы) [247, 248]. Во-первых, не доказано, что «промежу-
точное состояние» белковой молекулы является ненативным
белком, учитывая то, что промежуточных состояний может
быть множество. Они отделены друг от друга очень низки-
ми потенциальными барьерами (~3 ккал/моль), т. е. переход
белка из одного промежуточного состояния в другое может
происходить за счет тепловых движений как внутри глобу-
лы, так и на ее поверхности. Попадая в энергетическую во-
ронку (см. рис. 33), белок достигает минимума свободной
энергии Гиббса и в этом «нативном» равновесном состоянии
остается [104]. Это справедливо для описания состояния бел-
ковой молекулы в растворе. При этом регистрируется нали-
чие той или иной ферментативной активности. В клетке же
молекулы белка постоянно флуктуируют, перемещаются,
меняют свою форму, проникают через мембраны, приняв
линейную форму.
Мы уже отмечали, что эти изменения состояния моле-
кул белка происходят миллионы–миллиарды раз в секунду.
Обозначенное выше «нативное» состояние не будет позво-
лять белку выбираться из потенциальной воронки. Значит
общепринятое представление о «нативности» противоречит
фактическому поведению белка, находящегося в клетке. Как
это ни парадоксально, но «ненативные» белки, по-видимому,
оказываются более нативными, так как они способны через
состояние «расплавленной глобулы» принимать множествен-
ные состояния, которые так необходимы клетке при ее функ-
ционировании [245, 247]. Чтобы синтезированные белки de
novo не достигали равновесного «нативного» состояния, в
206
Живая клетка.indb 206 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-206-320.jpg)
![Белок и его состояние в живой клетке
клетке присутствуют «помощники» белка — тоже полипепти-
ды — шапероны [249].
Эта гипотеза была высказана еще в 1988 г. [248] и за по-
следующие 10 лет была многократно подтверждена, что и
позволило уже в 1997 г. Бычковой [247] написать: «Было бы
бессмысленно позволить белкам принять правильную жест-
кую третичную структуру с тем, чтобы разрушить ее через
короткое время при их созревании или олигомеризации.
С другой стороны, имеются данные, что транслокация бел-
ков через (или их внедрение в) мембрану также требует со-
стояния расплавленной глобулы. Поэтому было бы вполне
логично поддерживать это состояние, пока клетка нуждается
в нем, вместо того, чтобы позволить белку «прыгать» в натив-
ное состояние и обратно».
Схематически модель нативного состояния и состояния
расплавленной глобулы представлена на рис. 59.
Легко видеть, что два уровня организации белковой
структуры — вторичная и третичная, по разному воплощены
в этих состояниях. Если вторичная структура изображенная
на рисунке в виде цилиндров (на самом деле имеется в виду
α-спиральные участки) в основном сохраняется, то третич-
ная структура значительно сильнее разрушена: имеет место
даже разворачивание полипептидной цепи с выходом боко-
вых радикалов на поверхность глобулы.
Рис. 59. Схема, отражающая состояние белка в нативном состоя-
нии и состоянии расплавленной глобулы [247].
207
Живая клетка.indb 207 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-207-320.jpg)
![Белок и его состояние в живой клетке
Кроме структуры, именуемой «расплавленной глобу-
лой» или «нативным белком», рассматриваются так назы-
ваемые неправильно свернутые состояния с более низким
уровнем свободной энергии. При этом наблюдаются пере-
ходы α-спиральных структур в β-складчатые структуры. Бе-
лок в этом случае переходит в состояние, склонное к агрега-
ции, которая может завершиться образованием амилоидных
фибрилл.
Этот термин ввел еще в 1854 г. Рудольф Вирхов (цитиро-
вано по [250]). Здесь мы сталкиваемся с явлением, связанным
с таким КК–состоянием белка, которое способствует про-
цессу его кристаллизации. Явление получило название «кон-
формационные болезни» (коровье бешенство, болезни Аль-
цгеймера, Паркинсона), имея в виду, что белок меняет свое
КК-состояние, способствующее переходу белковых глобул в
кристаллическое состояние.
Ранее мы уже отмечали способность к кристаллизации, в
том числе и глобулярных белков. В последнее время все чаще
в литературе появляются работы, в которых сравниваются
результаты исследований белков в кристаллическом состоя-
нии и в растворе. В работе Борисова с сотр. [253] изучалась
кристаллическая аспартат-аминотрансфераза. Показано, что
в кристаллах фермента конформационные изменения ведут
к тому, что субстратсвязывающая способность белка частич-
но или полностью теряется, что не происходит в растворе
[253−256]. Однако наиболее существенным направлением
новых исследований следует признать изучение флуктуаций
в белковых молекулах. Стало очевидным, что нельзя понять
специфику поведения (в том числе и функционального) бел-
ковой молекулы, не зная, насколько она динамична и статич-
на. Мы уже неоднократно отмечали, что белковая молекула
может менять свою структуру в довольно широких пределах
[251, 252, 257, 259, 263, 264].
Какое же состояние мы можем считать «нативным»? Будет
логично, если мы примем, что к нативным следует относить
208
Живая клетка.indb 208 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-208-320.jpg)
![Белок и его состояние в живой клетке
белки, находящиеся внутри клетки и сохраняющие способ-
ность выполнять внутриклеточные функции, независимо от
того, находятся ли молекулы белка в виде свернутых глобул,
«расплавленных глобул» или принимают развернутую есте-
ственно упорядоченную структуру. Сюда же следует отно-
сить и промежуточные состояния, пока они не достигли не-
обратимой разупорядоченности денатурированного белка.
Особенно интенсивно стали изучаться все типы движений
белковой молекулы после того, как появилась возможность
фиксировать изменения ее структуры в наносекундном ин-
тервале времени, после фотовозбуждения триптофанового,
тирозинового или фенилаланинового остатков аминокислот,
являющихся протонными и электрондонорными группиров-
ками, способными к мгновенному переходу в возбужденное
состояние.
В зависимости от подвижности белковой структуры за
время жизни этого состояния с большей или меньшей ве-
роятностью могут образовываться внутримолекулярные
комплексы (эксиплексы) с участием в том числе и полярных
группировок. Обнаружено, что фосфоресценция белковых
группировок линейно связана с коэффициентом диффузии
растворителя [258].
Ведущие специалисты по физике и биофизике белка счи-
тают: «Опыт последних лет показал, что для выяснения функ-
циональных механизмов недостаточно знать статическую
структуру, и без анализа ее подвижности нельзя ни достичь
истинного понимания механизмов ферментативного катали-
за или депонирования и транспорта малых молекул белками,
ни разобраться в проблеме белково–нуклеинового узнавания
или генетического функционирования нуклеиновых кислот».
Все это положило начало исследованиям динамики бел-
ковых молекул с переходами их к конформационно различ-
ным состояниям и подсостояниям и связи этих переходов с
реакционной способностью. Функционирующее состояние
белковой глобулы отмечено для коровьего и человеческого
209
Живая клетка.indb 209 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-209-320.jpg)
![Белок и его состояние в живой клетке
лактальбулина и карбоангидразы В под влиянием различных
взаимодействий — кислые значения рН, высокие температу-
ры, умеренные концентрации гуанидин хлорида. Они перехо-
дят в особое состояние — промежуточное между нативным и
полностью развернутым.
Промежуточное состояние обладает нативной вторичной
структурой, но с флуктуирующей третичной [261]. В связи
с тем, что в живой клетке все органеллы движутся, перестра-
иваются, меняют форму и функциональные свойства в зави-
симости от окружающей среды и внешних воздействий, бел-
ковая молекула неизбежно будет, как уже отмечалось, также
свертываться и развертываться, переходя в возбужденное со-
стояние с повышенным уровнем энергии, но стремясь, есте-
ственно, к минимальной величине свободной структурной
энергии.
Однако, чем ниже уровень свободной энергии молекулы
белка, тем труднее ей приобретать структуру, необходимую
для той или иной функции. Нет ничего более ошибочного,
чем рассматривать белковую молекулу как нечто механи-
ческое, как это представлено в работе Чернавского и Чер-
навской [266], поставивших перед собой задачу обосновать
концепцию «белок — машина», что меньше всего объясняет
поведение белка в живой клетке. Не намного правильнее до-
пускать, что белок представляет собой некую сплошную од-
нородную среду, как это делают Морозов и Морозова [267].
Опираясь на все вышеизложенное, сформулируем чет-
вертый постулат существования белка в живой клетке.
Белок в живой клетке синтезируется в процессе
транскрипции-трансляции и принимает конформационно-
конфигурационную структуру, которая образуется и со-
храняется за счет валентных, водородных, дисперсионных,
вандерваальсовых связей, гидрофобных и электронных взаимо-
действий, главным образом, за счет образования комплексов
с переносом заряда. Валентные связи обеспечивают сохра-
210
Живая клетка.indb 210 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-210-320.jpg)

![Белок и его состояние в живой клетке
энергией G, меняющейся с переходом клетки в те или иные
состояния.
Как видно из приведенного постулата, состояние белка в
клетке, с одной стороны, обеспечивается сложным образом,
но с другой стороны ограничения, накладываемые двумя ми-
нимальными величинами свободной энергии, и присутствие
в клетке необходимых «помощников», а также наличие пото-
ка внешних воздействий и условий позволяют клетке оста-
ваться живой.
Если отвести белку роль основного вещества, обеспечи-
вающего жизнеобеспечивающие процессы, то без учета его
динамики, лежащей в основе электронно-конформационно-
конфигурационных переходов, не решить проблему авторе-
гуляции внутриклеточных процессов.
Видимо, это имел в виду Шайтан [270], когда писал: «Моле-
кулярные механизмы действия биополимеров тесно связаны
с их структурно-динамической организацией. В настоящее
время отсутствует строгая физическая теория, связывающая
динамическую структуру биополимера и его биохимическую
активность. Однако есть основания полагать, что в самой
структурно-динамической организации биополимеров со-
держатся предпосылки для самоорганизации и регулирова-
ния функционирования биохимических систем на молеку-
лярном уровне».
Создание такой физической теории осложняется еще и
тем, что, во-первых, белковая молекула вовсе не обязательно
выполняет только одну функцию. Показательны в этом плане
данные, полученные Евстафьевой с сотр. [271] о новых функ-
циях уже известного белка протимизина α, участвующего
в процессе клеточного деления в качестве стимулятора. Он
же участвует в защите клеток от апоптоза и окислительного
стресса.
Во-вторых, эта теория должна учитывать также роль дру-
гих компонентов клетки, о чем уже шла речь в данной главе.
Кроме того белок (согласно самым последним данным [268])
212
Живая клетка.indb 212 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-212-320.jpg)
![Белок и его состояние в живой клетке
может находиться в глобулярном или нативно-развернутом
состоянии с пониженной гидрофобностью, повышенным за-
рядом молекулы в целом и средней плотностью окружения и
числом сближенных остатков на заданном расстоянии. Для
20 типов аминокислотных остатков на базе 6626 белковых
структур уже построена статистическая шкала среднего чис-
ла сближенных остатков.
Можно надеяться на то, что такой подход позволит в
дальнейшем развить теоретическое обоснование физической
теории, связывающей динамическую структуру белка и его
физиологическую активность.
Что касается экспериментальных подходов, то продолжа-
ют публиковаться данные о связи конформационных перехо-
дов белковых глобул с их физиологической активностью [260,
269, 306, 394], см. также [251, 264].
Теперь остановимся хотя бы кратко на рассмотрении пу-
тей биосинтеза белка и роли нуклеиновых кислот в создании
и поддержании целостной живой структуры клетки.
213
Живая клетка.indb 213 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-213-320.jpg)

![Нуклеиновые кислоты и синтез белка
клеиновая кислота (ДНК), молекулы которой могут образо-
вывать двойную спираль, способную далее реплицироваться
по схеме, предложенной Уотсоном и Криком ([31], с. 9–23).
Доступное для понимания изложение этого вопроса читатель
найдет в прекрасной монографии Кендрью [30].
Фундаментально эти проблемы изложены в целом ряде
работ [13, 14, 32, 96, 173, 245, 274, 275, 275, 276]. Мы же огра-
ничим свое повествование рассмотрением специфики строе-
ния молекул нуклеиновых кислот так же, как это мы сделали,
рассматривая строение белков в предыдущей главе, однако
постараемся дать общую современную схему процесса био-
синтеза белковой молекулы.
Рис. 60. Фрагмент структуры ДНК [14].
Известно, что существует два типа молекул нуклеиновых
кислот — рибонуклеиновые кислоты (РНК) и дезоксирибону-
клеиновые кислоты (ДНК), различающиеся углеводными ком-
понентами, участвующими в построении полимерных цепей.
215
Живая клетка.indb 215 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-215-320.jpg)
![Нуклеиновые кислоты и синтез белка
РНК построены с участием рибозы, а ДНК-дезоксирибозы.
И еще одно отличие — в ДНК, помимо аденина, гуанина и ци-
тозина, принимает участие тимин, а в РНК-урацил. Приведем
сразу строение обеих цепей РНК и ДНК, как это представле-
но у С. Е. Бреслера ([14], с. 212), (рис. 60, 61). Легко видеть, что
цепи нуклеиновых кислот имеют гораздо более регулярную
структуру по сравнению с полипептидными цепями белка.
Рис. 61. Фрагмент структуры РНК [14].
Линейные цепи молекул ДНК и РНК одинаковы и по-
строены из остатков фосфорной кислоты и пентозы, к кото-
рой присоединяются остатки пуриновых и пиримидиновых
оснований.
Обратимся (в качестве примера) к строению моноаденин-
нуклеозида, являющегося одним из мономерных звеньев, уча-
ствующих в построении молекул нуклеиновых кислот (3.1).
Сразу следует отметить, что остаток фосфорной кислоты
и остаток аденина (представитель пуриновых производных
наряду с гуанином), обладают сильно делокализованными
216
Живая клетка.indb 216 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-216-320.jpg)

![Нуклеиновые кислоты и синтез белка
Рис. 62. Схема, объясняющая образование водородных связей
между парами оснований [273].
Из приведенной схемы видно, что в ДНК максимальное
число водородных связей возникнет, если в дубликате (такой
процесс называется репликацией) основания расположатся
так: тимин (Т) — аденин (А) и цитозин (Ц) — гуанин (Г).
Аналогичным образом строится молекула РНК, только
тимин при этом замещается на урацил (У).
Обычно применяют термин «транскрипция», чтобы от-
личить этот процесс от репликации. Благодаря высокой
стереорегулярности цепочек ДНК сдвоенная нить моле-
кулы сворачивается в спираль, что было показано с по-
мощью ренгеноструктурного анализа, хотя об этом пи-
сали исследователи еще в 1960-е гг. Так Бреслер ([14],
с. 236) пишет: «Биологические полимеры, белки и нуклеи-
новые кислоты обладают общей чертой — огромными вну-
тримолекулярными силами, приводящими к правиль-
ному спиральному строению молекул. В этих веществах
наблюдается своеобразная внутримолекулярная кристаллиза-
ция — образование областей правильной структуры с ближ-
ним и дальним порядком внутри каждой отдельной макро-
молекулы». В этом случае идет речь уже о вторичной струк-
туре молекул ДНК.
Схематично вторичная (спиральная) структура ДНК изо-
бражена на рис. 63.
Сразу бросается в глаза достаточно жесткая структура
спирали за счет большого числа водородных связей между
двумя цепочками молекулы. Ход спирали, а соответственно,
и вторичная структура в целом зависят, главным образом, от
218
Живая клетка.indb 218 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-218-320.jpg)
![Нуклеиновые кислоты и синтез белка
состояния остатка углевода, входящего в состав соответству-
ющей нуклеиновой кислоты. Мы уже отмечали, что фурано-
вое кольцо не является плоским и может находиться в двух
конформационных состояниях.
А B
Рис. 63. Строение ДНК. A, B — двойная спираль ([386], кн. 2, с. 169).
В молекуле ДНК рассматривают эти два состояния как
С3ʹ-эндо или С2ʹ-эндо (рис. 64). Для преодоления барьера
при переходе от первого состояния ко второму необходимо
затратить от 2 до 4 ккал/моль (барьер легко преодолевается
за счет теплового движения молекул). Иванов [272] счита-
ет, что этот переход связан с изменением В-структуры ДНК
в А-структуру и наоборот. Переключателем этого перехода
как раз и является переход С2ʹ-эндо в С3ʹ-эндо.
В зависимости от положения этого переключателя моле-
кула ДНК переходит в семейство В–форм (С2ʹ-эндо), либо
А — (С3ʹ-эндо). Двойная спираль РНК может существовать
только А–форме, так как 2ʹ-гидроксил рибозы создает пре-
пятствия для возникновения С3ʹ-эндо.
219
Живая клетка.indb 219 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-219-320.jpg)
![Нуклеиновые кислоты и синтез белка
Рис. 64. Состояние пентозного кольца в молекуле ДНК [272].
В настоящее время считается, что в физиологических
условиях ДНК имеет структуру близкую к В-форме. Меняя
условия среды, можно перевести ДНК в Z–форму или рас-
плавленное (денатурированное) состояние. Как выглядят эти
переходы на моделях молекулы ДНК, видно из рис. 65.
Рис. 65. Двойная спираль ДНК:
1 — в Z–форме; 2 — в В–форме
[274].
1 2
Франк-Каменецкий [273] считает, что наиболее важным
подходом к изучению поведения молекул ДНК является вы-
явление конформационных отклонений структуры ДНК под
действием тепловых движений. При этом нужно различать
220
Живая клетка.indb 220 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-220-320.jpg)
![Нуклеиновые кислоты и синтез белка
тепловые флуктуации вокруг равновесных состояний моле-
кул и скачки структуры, отвечающие переходу в различные
состояния с минимальными значениями энергии. В работе
Франк-Каменецкого рассматриваются и другие возможные
флуктуационные изменения структуры ДНК.
Для нас особенно важно констатировать, что, несмотря
на явную жесткость молекулы ДНК, возможны переходы и
конформационно-конфигурационные изменения, неизбеж-
но связанные с электронными взаимодействиями внутри
двойной спирали молекулы. Сочетание жесткости молекулы
и возможности ее тепловых флуктуаций позволяют молеку-
ле ДНК выполнять ее физиологическую роль: обеспечивать
сохранение и передачу информации о структуре белковых
молекул.
Снова вернемся в 1960-е гг. и вспомним, что пишет об этом
Бреслер ([14], с. 222): «Представим себе, что двойная спираль
ДНК находится в растворе, содержащем большое количество
различных нуклеотидов и их дериватов. Если концы спирали
разошлись (Этому будут способствовать тепловые флуктуа-
ции спиральных молекул ДНК — прим. автора), то на каж-
дую половину должны сорбироваться «зеркальные» основа-
ния (тимин на аденине, гуанин на цитозине и т. д.).
Если разделение спиралей продолжить, а сорбированные
нуклеотиды соединить в одну цепь, мы получим две одина-
ковые двойные спирали ДНК, т. е. произойдет редупликация
макромолекулы — ДНК».
В клетке белки и нуклеиновые кислоты не образуют изо-
лированных областей или зон, состоящих только из белков
или нуклеиновых кислот. Если первые преобладают в цито-
плазме, то вторые — в ядре. Однако и те и другие присут-
ствуют в обоих органеллах: в цитоплазме преобладают белки,
а в ядре нуклеиновые кислоты, но также связанные с белком.
В конечном счете биосинтез белка, согласно общепринятым
представлениям, осуществляется так, как это представлено
на схеме Спирина (см. рис. 66) [275].
221
Живая клетка.indb 221 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-221-320.jpg)
![Нуклеиновые кислоты и синтез белка
Не отказывая в оригинальности и стройности этих по-
строений, в уже цитированных работах Спирина [274, 275]
мы сталкиваемся с множеством осложнений, требующих до-
полнительного решения ряда проблем. Основная проблема,
решение которой потребовало от исследователей колоссаль-
ных усилий, — каким образом информация, содержащаяся в
ДНК, передается строящейся полипептидной цепи.
Главным переносчиком информации оказалась РНК, пре-
жде всего, так называемая высокомолекулярная информаци-
онная РНК (i-РНК), редуплицирующаяся на молекуле ДНК.
Но оставался вопрос о том, как каждая из 20 аминокислот
узнает в каком месте ей нужно встраиваться в строящуюся
полипептидную цепь. Выяснилось, что индивидуальная ами-
нокислота связывается с низкомолекулярной РНК, которая
именуется транспортной (t-РНК).
Вот как этот процесс изложен в работе Спирина ([274],
с. 28): «Триплетный кодон матрицы должен однозначно де-
терминировать определенную аминокислоту. Между тем
явного стерического соответствия структур аминокислот и
соответствующих им кодонов не наблюдается, т. е. кодоны
вроде бы никак не могут служить прямыми матричными по-
верхностями для аминокислот».
Решая эту задачу, Крик в 1955 г. [278] предложил свою
«адапторную гипотезу», где он постулировал существование
специальных адапторных РНК и специальных ферментов, ко-
валентно присоединяющих аминокислотные остатки к этим
РНК. Согласно гипотезе, каждой аминокислоте соответствует
свой вид адапторной РНК и свой фермент, присоединяющий
только данную аминокислоту к данному адаптору. Как это ни
прискорбно, но мы снова сталкиваемся с ситуацией, когда ко-
личество белков — ферментов, которые необходимо кодиро-
вать, неуклонно нарастает: для 20 аминокислот требуется 20,
так называемых аминоакцил — t-РНК-синтетаз. К этому не-
обходимо добавить, что в цитоплазме и в митохондриях свои
наборы кодонов, следовательно, и свои наборы синтетаз.
222
Живая клетка.indb 222 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-222-320.jpg)
![Нуклеиновые кислоты и синтез белка
Рис. 66. Общая схема биосинтеза белка (ДНК → РНК → белок) [275].
Кроме того необходимо, чтобы в процессе синтеза ДНК
и РНК принимали участие ферменты, именуемые ДНК-
полимеразами и РНК-полимеразами. Нужны также фермен-
ты для коррекции синтезируемых цепей нуклеиновых кис-
лот, ферменты, катализирующие процессы по редупликации
двойных спиралей кислот, целая серия ферментов, обеспечи-
вающих исправление повреждений в молекуле ДНК, чтобы
предотвратить возникновение вредных мутаций [279] и т. д.
Так или иначе исходное предположение, что молекула
ДНК сама себя копирует, очень далеко от истины. Как осу-
ществляется синтез ДНК согласно современным представле-
ниям, читатель найдет в работе Спирина [274].
Не вдаваясь в изложение всех тонкостей функционирова-
ния системы ДНК, i-РНК, t-РНК и ферментов, обслуживаю-
223
Живая клетка.indb 223 27.10.2009 11:40:13](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-223-320.jpg)
![Нуклеиновые кислоты и синтез белка
щих эту систему, кратко рассмотрим структурные измене-
ния и построения с участием молекул нуклеиновых кислот.
Сейчас уже можно считать установленным, что конформа-
ционное состояние молекул ДНК зависит от водно-солевого
состава среды, и изменяется при концентрации катионов
металлов [280] и сопутствующих им анионов соли [281].
В клетке эти компоненты, наряду с перечисленными в главе 2
участниками образующихся клеточных структур: белками,
витаминами, гормонами, макроэргами, коферментами, будут
влиять на КК–состояние молекул нуклеиновых кислот.
И действительно, молекулы, например, РНК в клетке на-
ходятся в виде образований — изогнутых, разветвленных,
свернутых в виде петель (рис. 67).
1 2
Рис. 67. Схема вероятной вторичной структуры 3-концевого домена
РНК вируса [275]: 1 — нуклеотидная последовательность и компле-
ментарность спаренных участков цепи; 2 — та же структура в виде
двух спиральных участков, соединенных однотяжевыми отрезками.
В то же время молекулы ДНК с белком образуют комплек-
сы, которые пространственно состыкованы так, что создают
плотноупакованные образования (рис. 68) [245].
Все это вносит дополнительные трудности для функцио-
нирования молекул нуклеиновых кислот в рамках общепри-
нятых схем. Особенно после ознакомления с поведением
молекул ДНК в комплексах с гистонами [246]. Видимо, допол-
224
Живая клетка.indb 224 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-224-320.jpg)
![Нуклеиновые кислоты и синтез белка
нительные трудности интерпретации экспериментальных
данных, полученных на внеклеточных препаратах по биосин-
тезу белка с участием нуклеиновых кислот, вынудили иссле-
дователей искать ответа на вопрос — почему молекулы ДНК
в хроматине находятся в изогнутом, свернутом состоянии и
как они при этом функционируют [272, 277, 278].
1 2
Рис. 68. Модельное изображение комплекса молекулы ДНК и белка
([245], т. 2): 1 — в форме ленты; 2 — с использованием метода
Монте-Карло.
В конечном счете эти поиски позволили Иванову вместе
с кристаллографом Спенсером заявить: «Идея, что ДНК —
просто-напросто склад генетической информации, похоже,
находится при последнем издыхании» [272]. Обратившись
еще раз к работе Коммонера [33], а также учтя последующие
данные, приведенные в статье Птицына [261] о случайном ха-
рактере аминокислотных последовательностей, лишь слегка
отредактированных в процессе длительного отбора, можно
прийти к выводу, что для обеспечения определенной физио-
логической функции нужна не строго детерминированная
по аминокислотным остаткам полипептидная цепь, а всего
лишь заданное соотношение полярных и неполярных ради-
калов аминокислот, входящих в состав этой цепи.
С этой точкой зрения совпадают и результаты, полученные
Поройковым, Есиповой и Туманяном [286], которые рассмо-
трели распределение идентичных аминокислотных остатков в
первичной структуре 83 негомологичных белков, содержащих
225
Живая клетка.indb 225 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-225-320.jpg)
![Нуклеиновые кислоты и синтез белка
14 000 аминокислот. Их распределение оказалось также близ-
ким к случайному. В конечном счете, подтверждается точка
зрения Коммонера, считавшего, что возможен не только ма-
тричный, но и эпигенетический способ образования белков,
обладающих определенными структурно-функциональными
свойствами.
Нам остается еще раз подчеркнуть важность рассмотре-
ния учета динамики молекул нуклеиновых кислот. Из послед-
них работ, где обсуждается эта проблема, мы уже упомянули
обзор Франк-Каменецкого [273], достаточно полно осветив-
шего всю информацию, появившуюся в литературе к 1983 г.
Несколько позже, в 1999 г. Рубин ([96], т. 1, с. 297) опубли-
ковал данные о временных характеристиках молекулярных
движений, в том числе и нуклеиновых кислот:
Колебания двойной спирали ДНК 10-13–10-11 сек
Локальные движения основных пар 10-10–10-9 сек
В–А переходы в ДНК 10-9 сек
Кинетика интеркаляции 10-4–10-3 сек
Распаривание пар оснований 10-3–10-1 сек
Диссоциация при образовании
10-3–10 сек
двойной спирали
Как видно из приведенных данных, быстрее всего осу-
ществляются движения, связанные с флуктуациями, веро-
ятнее всего тепловыми, самих молекул ДНК. К сожалению,
Рубин не привел данных о временных характеристиках об-
разования и распада комплексов нуклеиновых кислот с бел-
ками. Мой поиск решения этого вопроса в периодической ли-
тературе также не привел пока к положительному результату.
Легко видеть, что самыми медленными процессами явля-
ются процессы, которые должны вести к началу репликации
с последующим синтезом РНК и белка, хотя молекулы ДНК,
как и молекулы белка, флуктуируют с громадными скоростя-
ми, измеряемыми миллиардами раз в секунду.
226
Живая клетка.indb 226 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-226-320.jpg)

![Гл а в а 4
Вода и ее роль в поддержании
живого состояния клетки
Еще древние философы, в частности Аристотель, понима-
ли и признавали за водой ее неизмеримое значение для всего
сущего на земле, приписывая ей роль одного из четырех эле-
ментов, «начал», лежащих в основе окружающего мира ([287],
с. 6). Позже воду перестали рассматривать в качестве одного
из «начал» — было открыто то, что она состоит из водорода
и кислорода, затем была установлена ее формула и, наконец,
несколько десятилетий назад началось интенсивное изучение
структуры воды вообще и в живых системах в особенности.
Стало ясно, что вода является не только средой для протека-
ния биохимических реакций, но она воздействует на форми-
рование и стабилизацию «структуры биополимеров, биомем-
бран и более сложных надмолекулярных образований» [288].
Именно этот феномен определяет основное значение воды
для живых систем.
Что можно сказать о химическом составе самой воды?
Выше мы уже отмечали, что в образовании молекулы воды,
участвуют лишь два элемента: водород и кислород, следо-
вательно, среди молекулярных соединений вода является
простейшим веществом, хотя, учитывая изотопный состав
этих двух элементов, мы сталкиваемся с некоторыми ослож-
нениями.
Известно, что водород может существовать в виде трех
изотопов: Н — протия (в ядре один протон), D — дейтерия
(в ядре один протон и один нейтрон), Т — трития (в ядре
228
Живая клетка.indb 228 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-228-320.jpg)
![Вода и ее роль в поддержании живого состояния клетки
один протон и два нейтрона). Следовательно, вода может
иметь формулу Н2О — протиевая вода, D2О — тяжелая вода
и Т2О — тритиевая вода, содержание которой в природе
ничтожно, никакого влияния на живые системы тритий-
содержащее соединение практически не оказывает.
Тяжелая вода, хотя ее содержание и невелико (1:4700)
[288], не может быть проигнорирована с точки зрения ее
влияния на живые системы. Если подвергать воду электро-
лизу, то содержание тяжелой воды может увеличиться до
1/3 от веса всей воды. Оказалось, что для высших растений
и животных тяжелая вода является ядом. Присутствие тяже-
лой воды даже в ничтожной концентрации вредно для живо-
го организма. Это побудило Мухачева [289] назвать воду, из
которой удалена тяжелая вода, «живой» водой. Так или иначе,
дальнейшее изложение будет посвящено обычной протиевой
воде Н2О.
Нельзя обойти вниманием также вопрос об изотопном со-
ставе атома кислорода, который входит в состав воды. Име-
ет место присутствие в природной воде шести изотопов (14О,
15
О, 16О, 17О, 18О, 19О). Изотопы 14О, 15О, и 19О радиоактивны,
но, имея короткое время полураспада, не накапливаются в
природной воде [293], содержащей в своем составе Н217О,
Н218О в концентрации 0,04 и 0,20 % соответственно. Приго-
товить воду, содержащую только основной изотоп 16О чрез-
вычайно сложно, что вынуждает исследователей работать с
водой природного состава.
Если по составу обычная вода является простейшим сое-
динением, участвующим в жизнеобеспечивающих процессах,
то о ее структуре сказать этого ни в коем случае нельзя.
Больше 100 лет исследователи-теоретики и эксперимен-
таторы бьются над загадкой, какова же структура этого ка-
жущегося простым, но в действительности загадочного,
соединения, именуемого водой. За это время выдвинуто не-
сметное количество гипотез, теорий, догадок и предположе-
ний, решающих эту проблему. По-видимому, монографию,
229
Живая клетка.indb 229 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-229-320.jpg)
![Вода и ее роль в поддержании живого состояния клетки
вышедшую под редакцией Кутепова [290], можно считать
новейшим обобщающим трудом, в котором сосредоточены
самые последние результаты исследований, посвященных
воде. При этом наметился поворот от попыток решать задачи
чисто экспериментально, используя физико-химические ме-
тоды, к созданию компьютерных моделей.
Почему воде уделяется столь пристальное внимание?
Первая причина уже указана — это чрезвычайная значи-
мость воды для существования и функционирования всего
живого. Вторая — без воды невозможно сохранить и всю не-
живую природу на Земле. Не последнюю роль играет и фено-
мен простоты состава воды. Исследователям всегда казалось,
что не будет труда решить все проблемы, связанные со струк-
турой и свойствами этого уникального растворителя.
Свойства чистой воды достаточно хорошо представлены
в работе Клотца [291]. Вода может, как известно, находиться
в трех агрегатных состояниях: газообразном, жидком и твер-
дом. Для живых систем газообразное состояние не представ-
ляет интереса и в дальнейшем изложении рассматриваться не
будет. Естественно, внимание должно быть сосредоточено на
оставшихся двух состояниях. Известно, что молекула воды
диссоциирует с образованием иона водорода и гидроксила:
В жидком состоянии концентрация ионов водорода в воде
равна 1⋅10-7 М, а для твердого (льда) — 1⋅10-10 М. Неожидан-
но оказалось, что удельная электропроводность при перехо-
де от жидкости ко льду почти не меняется. Электропровод-
ность — перенос зарядов через поперечное сечение прово-
дника — в свою очередь, зависит от двух факторов: числа за-
рядов в единице объема и скорости их движения. Получается,
что скорость движения ионов водорода в твердой воде в 100
раз больше скорости движения положительно заряженного
водорода в жидкой воде [292]. Если теперь представим себе
230
Живая клетка.indb 230 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-230-320.jpg)
![Вода и ее роль в поддержании живого состояния клетки
цепочку, построенную из молекул воды, к которой присоеди-
нится ион водорода:
то легко видеть, что присоединившийся слева протон ока-
жется справа, переместившись по всей цепочке. Значит, чем
более упорядоченнее и протяженнее будут цепочки, состав-
ленные из молекул воды, тем с большей скоростью будет про-
исходить перенос иона водорода. Остается разобраться, что
собой представляет жидкая и твердая вода.
Но прежде чем приступить к изложению данных о струк-
туре воды, необходимо хотя бы кратко вспомнить, что собой
представляет водородная связь. Во введении мы уже отмеча-
ли, что если имеется система, где водород связан с электроо-
трицательным атомом:
то за счет индукционного смещения электронов, возника-
ет дробный заряд на атоме водорода (δ+). В таком случае,
с электроотрицательным элементом, имеющим свободную
электронную пару на внешней оболочке (в данном случае
кислородом) возникает взаимодействие, именуемое «водо-
родной связью».
Атом кислорода в молекуле воды обладает двумя неподе-
ленными парами электронов. В таком случае атом кислорода
оказывается способным образовать четыре связи с соседними
атомами. Возникает система, где атом кислорода находится в
центре тетраэдра. Используя свойства упорядоченной сетки
водородных связей и параметры тетраэдричности кисло-
родного атома, Локотош с сотр. [303] попытались объяснить
аномальное поведение воды с точки зрения ее плотности и
диэлектрической проницаемости. Они ввели понятие числа
водородных связей на одну молекулу воды.
231
Живая клетка.indb 231 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-231-320.jpg)
![Вода и ее роль в поддержании живого состояния клетки
Естественно, чем ближе к четырем связям на молекулу,
тем упорядоченнее структура. Лед, возникший из чистой
воды, всегда будет иметь 4 связи на одну молекулу. На рис. 69
изображена эта система, и легко видеть, что каждый атом
водорода принадлежит рассматриваемому атому кислорода
наполовину, а вторая половина принадлежит другому атому
кислорода [294].
Рис. 69. Распределение протонов во льду согласно
нейтронографическим данным [294].
Благодаря высокой упорядоченности в структуре льда
(это мы наблюдаем, знакомясь с экспериментальными фак-
тами), его структура изучена более обстоятельно и глубоко.
На рис. 70 представлено схематическое изображение молекул
кислорода в воде.
Рис. 70. Схематическое изображение
расположения молекул кислорода в
воде [284].
Сразу бросается в глаза тетраэдрическое расположение
связей в молекулах воды, т. е. мы можем констатировать, что
в воде атом кислорода подобен атому углерода с его тетраэ-
232
Живая клетка.indb 232 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-232-320.jpg)
![Вода и ее роль в поддержании живого состояния клетки
дрическим строением в насыщенных соединениях. И уже
в 1960-е гг., создавая теорию строения воды, Самойлов под-
метил и еще одно сходство углерода и кислорода в воде — это
способность образовывать шестичленные кольца, напоми-
нающие структуру циклогексана (рис. 71).
Рис. 71. Кольцо из шести молекул в структуре льда [294].
К этому же выводу можно прийти, если обратиться к
рис. 72, приведенному в работе Эйзенберга и Кауцмана [293].
Рис. 72. Расположение атомов
кислорода во льду ([293], с. 75).
Изображение кристалла льда с учетом вандерваальсовых
радиусов представлено на рис. 73 и 74.
Рис. 73. Изображение кристалла льда I с
учетом вандерваальсовых радиусов ато-
мов ([279], с. 16).
233
Живая клетка.indb 233 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-233-320.jpg)
![Вода и ее роль в поддержании живого состояния клетки
Рис. 74. Модель структуры льда [294].
Заслуживает внимания наличие в кристалле пустот и ка-
налов (рис. 73), что свидетельствует о некоторых отклонени-
ях от плотной упаковки в кристалле. Именно по этой причи-
не возможно существование до 9 видов льда в зависимости от
внешних условий, в частности от давления и температуры∗.
Не останавливаясь далее на тонкостях структуры льда
(читатель все это может почерпнуть из работы Эйзенберга
и Кауцмана [293]), обратимся к структуре жидкой воды, что,
несомненно, представляет особый интерес, для того чтобы
понять роль воды в живой системе.
Наверное, первая серьезная попытка разобраться в струк-
туре жидкой воды принадлежит Берналу и Фаулеру [299].
Если исходить из представления, что жидкая вода представ-
ляет собой разупорядоченную структуру льда, то становится
необъяснимым уменьшение объема при плавлении льда. Тог-
да авторы пришли к заключению, что вода в жидком состоя-
нии напоминает структуру кварца. Они утверждали, что по
характеру расположения атомов в пространстве в воде суще-
ствуют три типа: I, II и III.
∗ Полиморфизм льдов, а также возможность (у молекул воды) образо-
вывать различные структуры с определенными стереохимическими па-
раметрами водородных связей, позволяют кислороду воды образовывать
не только шестичленные циклы в форме «кресла», но и в форме «ванны»
и «твист-ванны», а также давать спиральные структуры. Это установлено
с помощью компьютерного модульного дизайна [302].
234
Живая клетка.indb 234 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-234-320.jpg)
![Вода и ее роль в поддержании живого состояния клетки
Однако это не означает, что существуют три объема
с разной структурой. Бернал и Фаулер пишут: «При всех тем-
пературах жидкость остается гомогенной, и только средние
взаимные расположения молекул в большей или меньшей
степени напоминают воду I, II и III». Что касается влияния
температуры, то оно проявляется следующим образом: при
низких температурах (близких к 0°С) в воде заметно про-
является тенденция к структуре льда-тридимита (вода I).
С ростом температуры эта тенденция исчезает, что объясняет
максимум плотности воды при 4°С. Далее, при повышении
температуры начинает преобладать (при комнатной темпера-
туре) структура кварца (вода II). При температурах близких
к критическим структура воды становится плотноупакован-
ной (вода III). Таким образом, по Берналу и Фаулеру в воде
существуют мезомерные превращения:
вода I ↔ вода II ↔ вода III.
Представления, развитые этими двумя авторами о тетраэ-
дрическом характере структуры льда, оказали большое вли-
яние на дальнейшее развитие исследований воды и водных
систем. Согласно взглядам Клотца [291], структура жидкой
воды отличается от твердой наличием разупорядоченных
зон.
На рис. 75 схематически изображено расположение моле-
кул воды в этих двух агрегатных состояниях. Легко видеть,
что в жидкой воде присутствуют агрегаты, состоящие из не-
большого количества молекул воды.
Яшкичев [298, -304] предложил модель коллективного
трансляционного движения молекул «воды в воде». По его
представлениям, наиболее вероятным является смещение
участка льдоподобного каркаса, состоящего из пяти молекул
воды, в новое местоположение, но при этом необходимо, что-
бы к началу смещения были разорваны водородные связи в
соседних участках, а также изменены валентные углы других
связей и изменена ориентация соседних молекул.
235
Живая клетка.indb 235 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-235-320.jpg)
![Вода и ее роль в поддержании живого состояния клетки
Рис. 75. Схематическое изображение структуры воды в жид-
ком и твердом состояниях [291].
Гордеев и Хайдаров [310], измеряя коэффициент непре-
рывной диффузии D1, также говорят о «непрерывном блуж-
дании групп молекул» в воде. При этом малая величина D1
свидетельствует, что молекулы воды объединяются в доста-
точно большие подвижные устойчивые структуры.
Согласно взглядам Булавина с сотр. [312] при плавлении
льда рвется только небольшая часть водородных связей, и
тогда локальная структура жидкой воды оказывается близ-
кой к структуре гексагонального льда. Отсюда возможность
рассматривать структуру жидкой воды под углом зрения ква-
зикристаллического ее состояния. Изучая тепловое движение
молекул воды методом квазиупругого некогерентного рас-
сеяния медленных нейтронов, авторы пришли к выводу, что
ожидать квазикристалличности можно только в таких жид-
костях, в которых имеются достаточно прочные водородные
связи. Естественно, вода является именно такой жидкостью.
Достаточно наглядно описал состояние жидкой воды Ан-
тонченко ([297], с. 83): «Экспериментальные данные и теоре-
тические расчеты позволяют сделать вывод о том, что жидкая
вода состоит из неупорядоченных структур с водородными
связями. Эти структуры подвижны — связи разрываются и
восстанавливаются вследствие диффузии и текучести жид-
236
Живая клетка.indb 236 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-236-320.jpg)
![Вода и ее роль в поддержании живого состояния клетки
кости». И далее: «Так как молекулы воды при комнатной тем-
пературе образуют динамическую сетку за счет водородных
связей, в воде действуют межмолекулярные силы, которые
велики по сравнению с таковыми в других жидкостях. Моле-
кулы воды склонны отталкивать другие частицы, если толь-
ко последние не содержат гидрофильных групп или не не-
сут электрического заряда. Если же частицы заряжены или
содержат гидрофильные группы, их взаимодействие с моле-
кулами воды может оказаться сильнее, чем взаимодействие
молекул воды между собой. Например, ионы малого размера
могут разрушать сетки из молекул воды и переориентируют
молекулы воды таким образом, что вокруг иона образует-
ся гидратная оболочка. Отметим, что под влиянием частиц
большого размера, в том числе и ионов, структурные элемен-
ты воды могут не разрушаться, а, наоборот, уплотняться».
Это утверждение Антонченко не только характеризует со-
стояние жидкой воды, но и намечает пути объяснения ситуа-
ций, когда вода начинает контактировать с теми или иными
соединениями, о чем речь пойдет ниже.
Исходя из теоретических подходов для решения вопросов,
связанных с расшифровкой структуры жидкой воды, Гуриков
[300] вводит понятие о первичной и вторичной структуре
водных растворов и на этой основе объясняет дестабилизи-
рующее действие полярных групп, которые способны образо-
вывать прочные водородные связи с ближайшими молекула-
ми воды, что препятствует образованию вокруг органических
молекул льдоподобных кластеров.
Не противоречат этим представлениям и машинные экс-
перименты Дьяконовой и Маленкова [311], составивших сле-
дующую картину жидкой воды:
1. Молекулы воды образуют «открытую пространствен-
ную сетку».
2. Среднее число водородных связей на молекулу воды
n = 2,7. Чаще всего встречаются молекулы, образующие по
три водородные связи.
237
Живая клетка.indb 237 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-237-320.jpg)
![Вода и ее роль в поддержании живого состояния клетки
3. Распределение водородных связей по длинам и углам
искривления варьируют в достаточно широких пределах и
совпадают с таковыми, полученными для кристаллогидратов.
Длина водородной связи 2,9–3,0 Å и угол искривления 15–20°.
4. Распределение молекул по энергиям имеет один мак-
симум.
Все эти результаты свидетельствуют о высокой реали-
стичности предлагаемых моделей.
Вряд ли можно обойти вниманием вопрос о поведении
воды в дисперсных системах. При этом в зависимости от
характера поверхности изменения в структуре воды носят
различный характер, что и приводит к изменению физико-
химических свойств воды. Так, на гидрофильных поверх-
ностях снижается подвижность молекул воды, повышается
вязкость и изменяется плотность. Масштаб этих изменений
различен — если вязкость повышается в 1,5–2 раза, то плот-
ность меняется всего на несколько процентов. Иначе ведет
себя вода вблизи гидрофобных поверхностей. Наблюдается
дальнодействующее притяжение друг к другу гидрофобных
тел в водной среде.
Факт отталкивания гидрофильных поверхностей и при-
тяжения гидрофобных, достаточно четко обосновали Де-
рягин и Чураев ([301], с. 7), опираясь на учет структурных
сил, возникающих в водной среде между соответствующими
поверхностями.
Взаимодействие молекул воды с любыми поверхностями,
а значит с любыми органическими и неорганическими веще-
ствами, побудило исследователей подразделять воду, присут-
ствующую в живых системах, на две категории: связанную
и несвязанную [287, 295, 309].
Были разработаны специальные методы для определения
связанной и несвязанной воды. Полученные эксперименталь-
ные факты не всегда поддавались однозначной интерпрета-
ции. Однако вряд ли феномен связывания воды различными
веществами можно отвергнуть полностью, хотя некоторые
238
Живая клетка.indb 238 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-238-320.jpg)
![Вода и ее роль в поддержании живого состояния клетки
методы показывали, что вода в живых организмах ведет себя,
со структурной точки зрения, как чистая вода.
Действительно, нереально ожидать, что молекула воды
вместе со своими соседями будет иначе себя вести, попадая
в клеточные структуры, например, ДНК или белоксодер-
жащие структуры, или в структуру цеолитов. Однако, как
заметил Габуда ([287], с. 95), «И принципиальное отличие
какого-либо гидратированного силиката, например цеоли-
та, от гидратированной ДНК лишь в том, что превращение
в связанной с ДНК воде радикально изменяет конформацию
двойной спирали, тогда как превращение в цеолитной воде и
даже ее полное удаление мало сказывается на состоянии си-
ликатного полимерного каркаса».
Таким образом мы подошли к обсуждению наиболее ин-
тересного вопроса — какое влияние оказывает вода прежде
всего на белковые соединения, и как скажется взаимодей-
ствие белка и воды на функциональных свойствах белка.
Обзор данных, имеющихся на тот момент (1983 г.), был
представлен Аксеновым [305], обратившим внимание, пре-
жде всего на внутреннее движение в белковой молекуле,
при использовании методов спин–решетчатой и спин–спи-
новой релаксации для протонов белков. Оказалось, что в
сухих белках и полипептидах имеют место лишь такие дви-
жения, которые не связаны с наличием свободных объемов,
например повороты вокруг σ-связей метильных групп. При
увлажнении белков, вода позволяет более крупным молеку-
лярным группам выполнять поворотные движения с часто-
той 108 сек-1 при отрицательных температурах и с частотой
109 сек-1 при комнатной температуре.
Эти исследования отражают общую тенденцию, наметив-
шуюся в молекулярной биологии — переход от изучения осо-
бенностей построения и стабилизации структуры биологи-
ческих макромолекул к выяснению физических механизмов
их функционирования, базирующихся на динамике молекул,
что нами уже неоднократно отмечалось.
239
Живая клетка.indb 239 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-239-320.jpg)
![Вода и ее роль в поддержании живого состояния клетки
Теперь необходимо рассмотреть вопрос, как влияет и вза-
имодействует вода с макромолекулами, присутствующими
в клетке. Можно ожидать, что вода как растворитель будет
усиливать динамичность белковых глобул. После того, как
Лихтенштейн с сотр. [265, 308, 315] разработали метод вве-
дения физических меток в молекулу белка, началось широкое
исследование внутримолекулярных флуктуаций в молекулах
различных белков.
Ряд авторов [316], используя данный метод, изучили вну-
тримолекулярные движения в молекулах сывороточного аль-
бумина человека, панкреатического ингибитора трипсина и
лизоцима в интервале температур от 100 до 320°К при увлаж-
нении белков (степень увлажнения h = 0,03; 0,25; 0,4; 0,65). По
достижении температуры 200°К происходит растормажива-
ние внутримолекулярной подвижности белка.
В последнее время Крупянский с сотр. [123] обстоятельно
исследовали влияние воды на белок при степени гидратации
(h от 0,05) миоглобина и лизоцима. Уже при самой низкой
степени увлажнения 0,05 обнаруживаются кооперативные
движения α-спиралей в миоглобине и β-складок и α-спиралей
в лизоциме. Кроме того наблюдаются индивидуальные дви-
жения небольших атомных групп. Дальнейшее увлажнение
образцов этих белков приводит к росту среднеквадратичных
смещений для обоих типов внутриглобулярных движений.
Эти результаты свидетельствуют о том, что вода влияет на
структуру и динамичность белка.
С одной стороны, вода ослабляет сеть водородных связей
(естественно, заменяя их новыми водородными связями) и
разрыхляет структуру макромолекулы. Это неизбежно ведет
к появлению конформационно-конфигурационной подвиж-
ности исследуемых белков.
С другой стороны, вода стабилизирует и упорядочивает
белковую глобулу. Создается ситуация, когда белковая глобу-
ла и вода образуют единую структуру, но это касается только
воды, связанной с белковой глобулой, как считает Рихард-
240
Живая клетка.indb 240 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-240-320.jpg)
![Вода и ее роль в поддержании живого состояния клетки
сон [313]. Приведенные им снимки, полученные при разре-
шении 1,2 Å, позволяют видеть, как молекулы воды образуют
мостики, стабилизирующие глобулу парвальбумина (рис. 76).
В работе приводится также рисунок, где представлено сте-
реоизображение молекулы рубредоксина, окруженной несвя-
занными молекулами воды (рис. 77).
Рис. 76. Молекулы воды (светлые кружки) в парвальбумине.
Видны мостики, образованные молекулами воды между цепями по-
липептидов в структуре β–цепей. Видны также фрагменты тиро-
зина, участвующие в образовании водородных связей [313].
В кристалле кальцийсодержащего белка — парвальбу-
мине — определено местоположение и характер связей
74 молекул воды с достаточно большой точностью. Напри-
мер, ошибка в определении длины связи составила всего
0,024 Å [313, 337]. Около 34 из этих молекул оказались полно-
стью закреплены в определенных местах, некоторые частич-
но закреплены. Большое число полностью занятых мест ука-
зывает на то, что молекулы воды, размещенные в кристалле,
сильно структурированы. 12 молекул воды найдены на рас-
стоянии, сопоставимом с длиной водородной связи, возника-
ющей при взаимодействии с аминным скелетом, 22 молекулы
расположены на таком же расстоянии от карбонильного кис-
лорода главной цепи. Из остающихся 40 молекул воды — 18
образуют, по крайней мере, одну связь с азотом или кислоро-
дом боковой цепи; 11 — вовлечены в образование контактов
241
Живая клетка.indb 241 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-241-320.jpg)
![Вода и ее роль в поддержании живого состояния клетки
вода–вода; 1 молекула связана с кальцием в ЕF металлсвязы-
вающей части, и 10 — не образуют водородных связей.
Рис. 77. Стереоизображение скелета рубредоксина, окруженного моле-
кулами воды (светлые кружки) и атома железа (темный кружок) [313].
Налицо довольно сложная картина распределения моле-
кул воды в объеме кристалла. Можно предполагать, что они
не будут оставаться строго фиксированными, когда белок
окажется в клетке, а будут перемещаться, меняя свой ста-
тус, но это неизбежно будет сопровождаться изменениями в
структуре белка.
Исследуя диэлектрические свойства воды, адсорбиро-
ванной (связанной) с яичным лизоцимом, обнаружили два
слоя связанной с белком воды [307]. Оказалось, что эта вода
не может быть охарактеризована ни как «льдоподобная», ни
как «нельдоподобная», так как одно из наблюдаемых свойств
(время релаксации) является промежуточным между льдом
и водой, тогда как другое (степень упорядоченности) не соот-
ветствует этому выводу. На самом деле молекулы связанной
воды менее подвижны по сравнению с чистой водой, но они,
одновременно, менее упорядочены. С такого рода противо-
речиями мы постоянно будем сталкиваться, знакомясь с экс-
периментальными исследованиями, направленными на вы-
яснение роли и состояния воды в системах белок—вода. Эти
исследования обобщены в прекрасном обзоре Кунца и Кауз-
мана [296].
242
Живая клетка.indb 242 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-242-320.jpg)
![Вода и ее роль в поддержании живого состояния клетки
Обсудив влияние структурного состояния воды на бел-
ки, коснемся кратко влияния воды на структуру ДНК. В силу
большой величины молекулярного веса данного полимера,
сложно получать системы, которые позволяли бы изучать по-
ведение столь важных для живых организмов соединений,
поэтому для этих целей получают микроэмульсионные систе-
мы с включенными в них ДНК.
Так, например, ряд авторов [314], используя ЯМР-
спектроскопию, изучали состояние воды в системе обращен-
ных мицелл при различных молярных соотношениях воды
и неионного поверхностно-активного вещества и влияние
воды на структуру внутримицеллярной ДНК. Показано, что
структура воды становится такой, как при переохлаждении, а
ДНК вступает в реакцию конденсации только при определен-
ном содержании воды.
Авторы делают вывод, что основной фактор, влияющий
на структурные перестройки внутри молекулы ДНК, это
определенное содержание свободной переохлажденной воды,
которая стабилизирует или дестабилизирует конденсирован-
ное состояние ДНК. Вполне возможно, что аналогичные про-
цессы могут иметь место и в живой клетке.
Мы уже констатировали, что наиболее важной проблемой
при попытке объяснить, как функционирует живая система,
является задача найти и обосновать взаимозависимость ее
структуры и функции. Сейчас уже стало ясно, что недоста-
точно знать, как построены биологически важные молекулы.
Проблему не решить, не зная молекулярной динамики, пре-
жде всего, белковых молекул. Эта динамика в свою очередь
зависит от присутствия воды и внутри белковой глобулы,
и во внешнем окружении белка.
Обратившись снова к фундаментальному руководству
Рубина по биофизике [96, т. 1, с. 297], находим, что преобра-
зование структурного состояния воды коррелирует с про-
цессами изменений белковых макромолекул и молекул ДНК
(см. главы 2 и 3):
243
Живая клетка.indb 243 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-243-320.jpg)

![Гл а в а 5
Ионы металлов и анионы в клетке
Роль катионов и анионов для обеспечения жизнедея-
тельности клеток неизмеримо велика, хотя трудно сформу-
лировать общие задачи, в решении которых они участвуют.
Исходя из общих соображений, все элементы, присутству-
ющие в клетке, можно условно подразделить на макро- и
микроэлементы.
К макроэлементам относят элементы, содержание кото-
рых в живых организмах превышает 10-2%. Если содержание
элемента находится в пределах от 10-3 до 10-5%, его относят к
микроэлементам. При содержании элемента ниже 10-5% его
называют ультрамикроэлементом.
В таблице 5.1 приведены данные по содержанию всех эле-
ментов, обнаруживаемых в организме человека ([9], с. 210).
Условно можно провести и такое подразделение: рассмо-
тренные нами в предыдущих главах соединения (белки, ну-
клеиновые кислоты, витамины, гормоны, вода) построены
из основных элементов — O, H, C, N, P, S, которые являются
базовыми для всех клеточных структур, без них жизнь на на-
шей планете вообще невозможна. Во вторую группу входят
элементы K, Na, Ca, Cu, Zn, Fe, Mg, Co, Cl, I, которые также
участвуют в химических процессах, входя в состав катализа-
торов (белков-ферментов) или составляя основу межклеточ-
ной жидкости, обеспечивая гомеостаз для клеток под кон-
тролем сложного организма.
Роль остальных элементов, перечисленных в таблице 5.1,
плохо или недостаточно изучена, или вообще неизвестна.
245
Живая клетка.indb 245 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-245-320.jpg)
![Ионы металлов и анионы в клетке
Общую информацию обо всех упомянутых и других элемен-
тах читатель найдет в цитированном руководстве [9]. Мы
же вкратце рассмотрим наиболее характерные и важные для
живых клеток элементы, обратив внимание на их участие в
функциональной активности клеток. Естественно, начнем
с первой группы периодической системы Д. И. Менделеева,
а именно, с щелочных металлов.
Таблица 5.1
Содержание химических элементов в организме
человека
Массовая доля, Химические элементы,
% масс. доля в %
10 и более O (62), C (21), H (10)
-10
1 N (3), Ca (2), P (1)
K (0,23), S (0,16), Cl (0,1), Na (0,08), Mg (0,027),
0,01–1
Fe (0,01)
10-3–10-2 Zn, Sr
10-4–10-3 Cu, Co, Br, Cs, Si
10-5–10-3 I
-5 -4
10 –10 Mn, V, B, Cr, Al, Ba
10-6–10-3 Mo, Pb, Ti
10-7–10-4 Be, Ag
10-6–10-5 Ni, Ga, Ge, As, Hg, Bi
10-7–10-5 Se, Sb, U
10-7–10-6 Th
10-12–10-4 Ru
246
Живая клетка.indb 246 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-246-320.jpg)
![Ионы металлов и анионы в клетке
5.1. Группа щелочных металлов
Эту группу (IA) отличает прежде всего то, что на внеш-
ней оболочке их атомов имеется всего один электрон, кото-
рый легко теряется. В результате образуется однозарядный
катион, на внешней оболочке остаются два или восемь элек-
тронов, т. е. столько же, сколько содержится их на внешней
электронной оболочке инертных газов. Это означает, что ка-
тионы щелочных металлов устойчивы, легко гидратируются
и сдвигают концентрацию ионов водорода и гидроксилов,
образующихся из молекул воды, в сторону резкого преобла-
дания гидроксилов. Общая картина изменения свойств эле-
ментов группы IA представлена в таблице 5.2.
Таблица 5.2
Изменение энергии ионизации Еi кДж/моль
и радиуса атомов ra 10-6м ([9], с. 232)
Еi
520 496 419 403 375
Li Na K Rb Cs Fr
155 189 248 268 268 280
ra
Из приведенных в табл. 5.2 элементов наибольший инте-
рес, исходя из роли в обеспечении жизнедеятельности клет-
ки, представляют два элемента — Na и K.
Они всегда присутствуют в клетках. При этом концен-
трация Na+ внутри клетки примерно в 15 раз меньше, чем
во внеклеточной жидкости, тогда как концентрация k+ при-
близительно в 35 раз выше внутри клетки, чем вне ее. Что-
бы поддержать такое распределение ионов, их необходимо,
с общепринятой точки зрения, перемещать против концен-
трационных градиентов. Возникли представления о суще-
ствовании специальных насосов, перекачивающих одни
247
Живая клетка.indb 247 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-247-320.jpg)
![Ионы металлов и анионы в клетке
ионы внутрь клетки, другие — наружу. Естественно, для
этого нужна энергия, которая затрачивается на поддержа-
ние ионных градиентов. Было установлено, что эта энергия
«поставляется» за счет гидролиза АТФ. Оказалось, что одна
молекула АТФ обеспечивает выведение из клетки трех ионов
натрия и поступление в клетку двух ионов калия ([9], с. 237).
Процесс получил название «активный транспорт».
Однако остается нерешенным вопрос — что же собой
представляют эти насосы и каков механизм их функциони-
рования? Как они управляются?
Попытки объяснить необычное поведение этих двух кати-
онов начались не с привлечения «активного транспорта» и на-
сосной системы, располагающейся в мембранах клетки. Пер-
вой серьезной теорией, объясняющей поведение этих двух
катионов, была фазовая, или сорбционная, гипотеза, объ-
ясняющая неравномерность распределения веществ между
клеточными компартментами и окружающей клетки средой,
различной растворимостью в фазах, составляющих содержи-
мое клетки. Принималось во внимание и химическое взаи-
модействие с активными группами внутриклеточных струк-
тур [318–320]. Самым серьезным трудом, обобщающим дан-
ные (имеющиеся к середине 1960-х гг.) по клеточной прони-
цаемости, следует признать книгу А. С. Трошина [319]. Под-
вергнув критике мембранную теорию распределения веществ
между клеткой и средой, он убедительно доказывает право-
мочность объяснения феномена избирательной проницаемо-
сти для тех или иных веществ, в том числе и катионов натрия
и калия. Вот что пишет Трошин по поводу асимметричности
движения этих и других веществ в клетку и из нее: «В дей-
ствительности же движение веществ всегда совершается
по градиенту концентрации. Диффузия вещества в системе
клетка/среда происходит всегда в ту сторону, где концентра-
ция его растворенной фракции меньше той, которая долж-
на установиться при диффузионном равновесии. Диффузия
вещества в клетку «против градиента концентрации» имеет
248
Живая клетка.indb 248 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-248-320.jpg)
![Ионы металлов и анионы в клетке
место в силу того, что часть его там адсорбционно или хи-
мически связывается, движение же вещества из клетки в сре-
ду совершается потому, что они освобождаются в клетке из
связанного состояния, и в силу того, что растворимость их
в протоплазме меньше, чем в среде. Энергия обмена веществ
здесь необходима, однако, для того, чтобы поддерживать на
определенном уровне сорбционные свойства живого веще-
ства (адсорбционную и химическую активность и растворя-
ющую способность протоплазмы)» ([319], с. 378).
Самым ценным в представленной точке зрения Трошина
следует признать то, что в клеточной проницаемости при-
нимает участие целостная структура клетки, которая в то
же время изменяется в зависимости от ее физиологического
состояния. По мере накопления экспериментальных фактов,
свидетельствующих о том, что распределение веществ зави-
сит и от мембран клетки [320, 321], фазовую теорию стали на-
зывать «фазово-мембранной». Наибольшие трудности опять
же возникают при попытке объяснить неравномерность
распределения k+ и Na+. Эта теория предполагает, что про-
топлазма обладает большим сродством к ионам калия, чем
к ионам натрия, так как она представляет собой полиэлектро-
литную систему, напоминающую ионообменные смолы [321].
Снова приходится считаться с тем, что выход или про-
никновение внутрь клетки тех или иных веществ связан с
генерированием энергии [322–326], при этом ферментатив-
ные системы, ответственные за выработку энергии клет-
кой, оказываются закрепленными на клеточных мембранах
[327, 328]. Уже в 1960-е гг. было экспериментально показано
существование, по крайней мере, трех типов мембранно-
го транспорта: 1) транспорт веществ с помощью спонтанно
протекающих диффузионных процессов; 2) транспорт с по-
мощью переносчиков; 3) активный транспорт веществ. Мо-
нахов [317] считает, что спонтанная диффузия обеспечивает
лишь 2–3% транспортируемых веществ. Транспорт происхо-
дит путем активного переноса веществ, в том числе катионов
249
Живая клетка.indb 249 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-249-320.jpg)
![Ионы металлов и анионы в клетке
и анионов, через мембраны или с помощью мембран. Основ-
ной аргументацией в пользу этого процесса является сопря-
жение процесса переноса веществ с процессом производства
и потребления энергии. Действующим участником активного
транспорта является АТФ — его синтез и распад с высвобож-
дением энергии. Нет необходимости останавливаться более
подробно на всей аргументации механизма переноса ве-
ществ. Обсуждение этого вопроса читатель найдет в цитируе-
мой работе Монахова, мы же перейдем к рассмотрению более
современных взглядов на транспорт веществ внутрь клетки
и выведение их наружу.
Проблема транспорта ионов обстоятельно освещена Ру-
биным [96] во втором томе его руководства по биофизике.
Как полагает Рубин, движущей силой диффузии ионов слу-
жит электрохимический потенциал μ:
где z — валентность; φ — электрический потенциал; Т — аб-
солютная температура в градусах Кельвина; R — газовая по-
стоянная; F — число Фарадея; μ0— стандартный химический
потенциал; с — концентрация.
Пассивное движение ионов происходит из области с вы-
соким электрохимическим потенциалом (ЭП) [325] в область
с более низким ЭП. Движущей силой переноса ионов явля-
ется градиент ЭП dμ/dx. Как видим, никакая кардинальная
избирательность и специфичность переноса не содержится в
приведенной формуле, хотя можно констатировать движение
ионов под действием электрохимического потенциала.
Изучая проникновение ионов через модельные бислой-
ные липидные мембраны, нашли, что проникновение заря-
женных частиц в неполярную фазу из воды сопряжено с за-
тратой энергии, довольно значительной по величине:
250
Живая клетка.indb 250 27.10.2009 11:40:14](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-250-320.jpg)

![Ионы металлов и анионы в клетке
ность молекул переносчиков по отношению к определенным
заряженным частицам, можно объяснить различное поведе-
ние ионов калия и натрия. Однако, остается все же неясным,
какие же силы удерживают по-разному эти ионы внутри
клетки.
В последнее время все большее число работ посвящено
изучению ионного транспорта посредством перемещения
через ионные каналы. Из-за малого их диаметра по каналу
возможно только однорядное движение ионов. Так, диаметр
натриевого канала 0,31 нм, а калиевого — 0,45 нм ([96] с. 114).
В результате невозможна независимая диффузия, тем более
что поверхность канала имеет специфическое строение. Не
останавливаясь далее на деталях перемещения ионов по ка-
налам, обладающим динамической структурой, приведем
пример схематического строения ионного канала (рис. 78).
Рис. 78. Схематическое изображение ионного канала [96].
252
Живая клетка.indb 252 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-252-320.jpg)
![Ионы металлов и анионы в клетке
Как видно из рисунка, в липидный бислой встроен транс-
мембранный белок, состоящий из 1900–4000 аминокислот-
ных остатков, уложенных в одну или нескольких полипеп-
тидных цепей ([96] с. 129), а также нескольких сотен сахарных
остатков, ковалентно связанных с аминокислотами. Возмож-
ность конформационно-конфигурационных изменений бел-
ковой молекулы (естественно, с одновременным изменением
электронных взаимодействий) позволяет управлять каналом
путем изменения внешнего электрического поля, например,
при поступлении нервного импульса.
В результате клетка получает возможность управляемо
получать необходимое количество соответствующих ионов.
Рассмотрим вкратце как ведут себя мембранные каналы при
воздействиях окружающей среды. Как всегда начнем с рас-
смотрения ответа мембраны на изменения температуры. По
сравнению с белками-ферментами, ионные каналы менее
чувствительны к изменениям этого параметра. Для большин-
ства из них Q10 ~ 3–5. Хотя небольшая группа ионных кана-
лов способна эффективно преобразовывать незначительные
температурные изменения в изменения ионной проницае-
мости клеточной мембраны с коэффициентом Q10 ~ 10–30.
Большинство термочувствительных каналов относится к се-
мейству ТRP-каналов, обнаруживаемых у различных видов
насекомых и животных. Роль ТRP-каналов для жизни клеток
чрезвычайно велика, так как они обеспечивают чувствитель-
ность клеток к разнообразным внешним воздействиям: ме-
ханическим, химическим, осмотическим, температурным и
световым [329].
Подвергая внутренние мембраны растений тепловому
шоку (нагревание в воде в течение 5–10 минут до 40°С или
в суховоздушном термостате — 3 ч), обнаруживали струк-
турные изменения белков, а также изменения содержания ка-
ротиноидов. Аналогичный результат получен при действии
дитиотреитола или ЕДТА, что свидетельствует о неспецифи-
ческом ответе мембран [330]. Обнаружено также влияние
253
Живая клетка.indb 253 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-253-320.jpg)
![Ионы металлов и анионы в клетке
различных соединений на катионные каналы, вплоть до их
блокирования [331–335]. Таким образом, можно констати-
ровать, что различные типы внешних воздействий меняют
структуру транспортных каналов, а, следовательно, и их про-
ницаемость для катионов.
Клетка, видимо, использует это свойство катионных кана-
лов для того, чтобы обеспечить внутренний гомеостаз кати-
онного состава и сохранения своей структуры, в том числе
и структуры самих каналов. Если структура последних нару-
шается, то это приводит к тем или иным заболеваниям. Так,
k+-каналы (k+АТОР) осуществляют уникальную связь между
метаболизмом клетки и возбуждаемостью многих органов и
типов клеток [356]. Орлов [349] рассматривает для электри-
чески невозбудимых тканей по крайней мере три системы
пассивного транспорта одновалентных катионов, которые
в то же время связаны с наличием переносчиков, осущест-
вляющих эквимолекулярный Na+–Na+ обмен. В то же время
потоки Na+ и k+ зависят также от внутриклеточного кальция.
Каким же образом асимметричный состав k+ и Na+ удержива-
ется внутри клетки?
Опять обратимся к «активному транспорту». Мы уже
отмечали, что перенос Na+ и k+ сопряжен с энергетически-
ми процессами клетки, что позволило ввести понятие о ка-
тионных насосах. В настоящее время эти насосы прочно
связали с Na+-, k+-АТФазой, локализованной в плазмати-
ческой мембране и осуществляющей активный транспорт
этих двух катионов. Обоснование данного представления
и обзор экспериментальных фактов в его пользу изложены
в работе Рубина ([96], т. 2, разд. VII, гл. XXII). Согласно Ру-
бину, удерживание и обмен Na+ и обмен k+ осуществляется
Na+- и k+-АТФазой с помощью специальной полости белка
АТФазы (рис. 79).
Обращаем внимание читателей, что процесс удержива-
ния k+ и выведение Na+ связан с конформационными измене-
ниями белковой молекулы. Рубин предполагает, что эти два
254
Живая клетка.indb 254 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-254-320.jpg)
![Ионы металлов и анионы в клетке
Рис. 79. Схематическое изобра-
жение белка-фермента Na+-, k+-
АТФазы [96].
иона различным способом встроены в молекулу АТФ-азы
(рис. 80) и при определенных условиях они обмениваются с
окружающей средой. На основе «активного транспорта» по-
лучено объяснение, каким образом осуществляется удер-
живание или выведение клеткой двух катионов щелочных
металлов с учетом влияния их на структуру белка-фермента
Na+-, k+-АТФазы.
Рис. 80. Две конформации Na-полости Na+-, k+-АТФазы [96].
Изучая стехиометрию Na+/k+-обмена, Герасимов счита-
ет ее близкой к соотношению 3 : 4. Причиной этого, по его
255
Живая клетка.indb 255 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-255-320.jpg)
![Ионы металлов и анионы в клетке
мнению, является различная степень гидратации ионов, что
обусловлено различной плотностью зарядов их ядер [336].
В таком случае мы снова возвращаемся к точке зрения Тро-
шина [319], согласно которой удерживание клеткой ионов
щелочных металлов осуществляется за счет структурных
свойств всей протоплазмы. Необходимо к этому добавить,
что мембраны являются фактически частью протоплазмы. В
качестве подтверждения этого можно привести данные о гли-
колитических ферментах эритроцитов (их можно смело от-
нести к цитоплазматическим белкам) по работе Грина с сотр.
[328]. Эти ферменты ассоциированы с мембранами. Соглас-
но взглядам многих исследователей (что мы уже отмечали),
структурное состояние целостной живой клетки определяет
направленность ионных потоков. Несмотря на это новейшие
исследования посвящены исключительно мембранным насо-
сам, их регулированию и обеспечению энергией за счет рас-
пада АТФ в мембранах [357–362]. Это тем более непонятно,
так как еще нет ответа на вопрос: как осуществляет клетка
согласованность всех возможных путей транспорта ионов, в
том числе k+ и Na+-ионов.
5.2. Группа щелочноземельных металлов
В эту группу (АII) входят элементы Be, Mg, Ca, Sr, Ba, Ra.
Исходя из количественного отношения и необходимости для
жизнеобеспечения клетки, кальций и магний можно смело
отнести к важнейшим элементам этой группы. Если элемен-
ты группы АII теряют оба электрона, имеющиеся на внешней
оболочке, то у них остается восемь (как и у элементов груп-
пы АI). В этом плане они сходны с первой группой, но, есте-
ственно, проявляют валентность, равную двум. Потеря двух
электронов со спаренными спинами, происходит труднее,
чем у щелочных металлов, отсюда выше энергия ионизации
256
Живая клетка.indb 256 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-256-320.jpg)
![Ионы металлов и анионы в клетке
и влияние на диссоциацию воды с меньшим сдвигом в сто-
рону преобладающего количества гидроксильных ионов. Две
свободные валентности позволяют Mg++ и Ca++ встраиваться
более прочно в молекулы белка, меняя их ЭКК-состояние, со-
провождающееся изменением их функциональных свойств.
Что касается кальция, то в главе 2.1 мы вкратце останав-
ливались на кальций-связывающих белках. Этот вопрос осве-
щен в обзорах Пермякова [337, 338], считающего, что «ионы
кальция играют важнейшую регуляторную роль во многих
биологических процессах, таких, например, как мышечное
сокращение, тромбообразование, выброс нейротрансмит-
теров, образование микротрубочек, гормональные ответы,
экзоцитоз, минерализация тканей, деление клеток, адгезия и
рост клеток и т. д.». Обращает на себя внимание то, что кон-
центрационный градиент Ca++ внутри клетки и во внекле-
точной жидкости во много раз превышает соответствующие
градиенты для Na+, k+ и Mg++. Во внеклеточной жидкости кон-
центрация Ca++ достигает ~10-3 М, тогда как внутри клетки —
составляет ~10-7 М и ниже. По-видимому, внутриклеточные
белки связываются с ионом кальция во много раз слабее, чем
внеклеточные.
На примере нервных волокон Максимов и Орлов [339]
обстоятельно рассмотрели вопрос о роли Ca++ при функцио-
нировании нервных клеток, транспорт ионов Ca++ и асимме-
тричное удерживание их в различных компартментах клетки.
Обращает на себя внимание наличие многочисленных меха-
низмов, обеспечивающих гомеостаз ионов в клетке. Наличие
Ca2+-каналов не исключает участие Na+-, k+-каналов в транс-
порте и двухвалентных ионов. В то же время Ca2+-каналы об-
ладают способностью изменяться под действием электриче-
ских потенциалов. Такие каналы присутствуют практически
во всех клетках [351]. Перемещение ионов кальция (Ca2+-ток)
зависит и от гормонов. Так инсулин влияет на Ca2+-ток путем
регуляции потенциал-зависимых каналов в изолированных
кардиоцитах крыс [352].
257
Живая клетка.indb 257 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-257-320.jpg)
![Ионы металлов и анионы в клетке
Что касается эритроцитов, то существует точка зрения о
надежности барьера, позволяющего поддерживать электро-
химический градиент с разницей в 10 000 раз между клеткой
и средой [340–342]. Так как Ca2+ влияет на структуру практи-
чески всех компонентов клетки [343], можно предположить,
что эти ионы оказывают влияние на интегрированность ме-
таболизма в целом [342].
Оказавшись в клетке посредством того или иного пути,
ион кальция связывается с внутриклеточными белками:
рековерином [344], тропонином С [345, 346], кальций-
связывающим белком В карпа [347], парвальбумином [348,
349], калмодулином [350], зависимым от витамина Д кальций-
связывающим белком [353]. При связывании ионов Ca2+ с
тем или иным белком происходит изменение ККВ-состояния
последнего (см. рис. 40). Регуляция сродства к Ca2+-насоса,
перекачивающего Ca2+, осуществляется свободной от каль-
ция формой кальмодулина [364]. Измеряя скорость транс-
порта 45Ca2+ и АТФ-азную активность, изучали зависимость
сродства к кальцию Ca2+-насосов мембран эритроцитов,
саркоплазматического ретикулума скелетной мускулатуры
и митохондрий сердца. Было найдено, что структура Ca2+-
связывающего домена Ca2+-АТФ-азы образована с участием
четырех карбоксильных групп [364]. Однако данные о срод-
стве к кальцию носят противоречивый характер. По мнению
Орлова, Na+, k+, Н+ и Mg++ конкурируют за места связывания
в молекуле «насоса» [395]. Нельзя забывать, что сродством к
кальцию обладают и белки, находящиеся в цитоплазме.
Ряд гидролитических ферментов, катализирующих ги-
дролиз эфирных, фосфоэфирных и пептидных связей, также
связывают Ca2+. Среди этих ферментов фосфолипаза А2, ста-
филококковая нуклеаза, термолизин, трипсин, химотрипсин
([338], с. 15). Заслуживает внимания взаимодействие Ca2+
с кальций-зависимой протеазой эритроцитов крыс. В опы-
тах in vitro показано, что под действием Ca2+ этот фермент
расщепляется, что требуется для появления энзиматической
258
Живая клетка.indb 258 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-258-320.jpg)
![Ионы металлов и анионы в клетке
активности, хотя in vivo процесс расщепления не подтверж-
ден. Фермент активируется под действием иономицина и
Ca2+ [355]. Кальций связывают белки-лектины, не обладаю-
щие ферментативной активностью, но выполняющие различ-
ного рода биологические функции, в частности, участвуют в
процессах взаимодействия белков с углеводами [354].
Что касается Mg2+, то его роль для поддержания живого
состояния вытекает, с одной стороны, из того, что при необ-
ходимости он может заменить Ca2+ [396] и даже конкуриро-
вать с последним [395], вклиниваясь в Ca2+-поток. С другой
стороны, функционирование всей системы ионных потоков
(по современным представлениям) не может осуществлять-
ся без участия АТФ-азы. В то же время мы видели в разделе
2.6, что Mg2+, образуя хелатный комплекс с молекулой АТФ,
способствует передаче электронов с одной части молекулы
на другую. Это в свою очередь позволяет функционирую-
щим структурам осуществлять электронные взаимодей-
ствия во всей клетке. Кроме того преобразование солнеч-
ной энергии в энергию химических связей органических
веществ происходит с участием хлорофиллов, неизменным
компонентом которых в подавляющем большинстве случаев
является Mg2+ (5.2).
5.2. Структура хлорофиллов
259
Живая клетка.indb 259 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-259-320.jpg)

![Ионы металлов и анионы в клетке
Важным свойством d-элементов является их переменная
валентность, что позволяет им находиться в разной степени
окисления и осуществлять широкий диапазон окислительно-
восстановительных свойств. Но особенно важным является
присутствие в атомах d-элементов незанятых электронных
пар, которые позволяют этим элементам участвовать в обра-
зовании хелатоподобных комплексов. В разделе 2.4.13 приве-
дена формула витамина В12 (цианкобаламина) (2.47), где ко-
бальт образует такой комплекс. Сходную картину мы можем
наблюдать, обратившись к структуре гема (5.3), где комплекс
образован с участием иона двухвалентного железа. Как из-
вестно, гем входит в состав гемоглобина и миоглобина, без
которых сложные организмы не могут существовать.
5.3. Гем (протогем, ферропрото-
порфирин, ферропротогем,
восстановленный гематин)
Нельзя обойти вниманием еще один элемент — медь. Уже
в 1960-е гг. Фриден [365] сумел обобщить имеющиеся в то
время биохимические данные о роли двухвалентной меди для
живых организмов, а в 1969 г. [366] написать: «Недавними ис-
следованиями установлено, что медь, как и некоторые другие
микроэлементы, присутствующие в организме в очень малых
количествах, играет существенную роль в биохимических
процессах, протекающих в организме». Ион меди входит в со-
став многих ферментов, главным образом оксидаз. Сравни-
261
Живая клетка.indb 261 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-261-320.jpg)
![Ионы металлов и анионы в клетке
тельно недавно было обнаружено уникальное свойство меди
образовывать связь металл—металл [367]: Cu–Cu взамен
связи — S–S — в цитохромоксидазе и в N2O-редуктазе.
5.4. Анионы в клетке
Уже из общих соображений можно предполагать, что жиз-
необеспечение клетки осуществляется не только с участием
катионов, несущих положительные заряды, но и анионов,
компенсирующих их. Действительно, еще в 1961 г. Дефнер
[368] опубликовал данные о содержании катионов и анионов
в аксоплазме кальмара (табл. 5.4).
Таблица 5.4
Содержание катионов и анионов в аксоплазме
кальмара [368]
Содержа-
Содержание,
Анионы Катионы ние,
μeq/100 мг
μeq/100 мг
Cl– 151,2 K+ 344,0
HPO4– – и H2PO4– 28,81 Na+ 65,0
Изотионовая кислота 164,62 Ca++ 7,0
Аспарагиновая
кислота
79,06 Mg++ 20,0
Аргинин 3,46
Глутаминовая
21,23 Лизин 2,60
кислота
Орнитин 1,95
Всего 444,92 Всего 444,01
262
Живая клетка.indb 262 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-262-320.jpg)
![Ионы металлов и анионы в клетке
Здесь приведены данные не обо всех катионах и анионах,
но если добавить неучтенные компоненты, общая картина не
изменится. Так, например, проникновение в клетку K+ неиз-
бежно должно сопровождаться входом в клетку Cl– или дру-
гого аниона. Скорость проникновения в клетки различных
анионов сильно зависит от вида животных, от вида ткани, а
также от типа аниона, хотя известны случаи, когда анионы
Cl– и SO4– – проникают из клетки во внешнюю среду одинако-
во медленно [369].
Заслуживает особого внимания то, что проникновение в
клетку анионов носит сложный характер. Так, Ленинджер с
сотр. [324] показали, что неорганический фосфат проникает
в клетку параллельно с проникновением Ca++. При этом об-
наружено, что фосфаты не аккумулируются митохондриями
печени, если нет Ca++. Другие катионы кальций заменить не
могут кроме того необходимо также присутствие АТФ, Mg++
и сукцината.
Подробное изложение всех вопросов, связанных с содер-
жанием и скоростью обмена анионов между клеткой и сре-
дой, читатель найдет в фундаментальном руководстве, из-
данном при участии виднейших специалистов-цитологов в
1965 г. под редакцией А. С. Трошина ([318], 1, с. 507–512).
Поток анионов в клетку, согласно данным Ходжкина и Го-
ровица [370], на 2/3 обеспечивается за счет анионов хлора.
В ряде работ было показано ([318], с. 506), что анион Cl– про-
никает в клетку в количестве, эквивалентном иону K+, если
в окружающей клетку среде содержится KCl, или иону Na+,
если там же присутствует NaCl. Анион HCO3– проникает в
клетку в зависимости от количества CO2 , содержащегося в
среде.
Фосфор в клетке находится в виде органических соеди-
нений, таких как нуклеиновые кислоты, фосфопроизводные
сахаров, фосфолипиды, но проникает в нее в виде анионов
HPO4– – и H2PO4–, при этом содержание его в клетке состав-
ляет всего 0,043 часть от количества в среде [371]. Е. Хар-
263
Живая клетка.indb 263 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-263-320.jpg)
![Ионы металлов и анионы в клетке
рис [372, 373] полагает, что фосфор в клетке находится в ад-
сорбированном состоянии на поверхности мембран.
Обмену ионов хлора мешают другие анионы. Так, выход
из клетки Cl– замедляется, по данным Харриса [373], аниона-
ми, располагающимися в следующий ряд:
Br – < NO3– < I– < ClO4– < CNS–
Хлор в клетку может проникать через специфические
хлорные каналы [393]. Проникающие в клетку анионы влия-
ют на структуру макромолекул, изменяя их конформацию.
Недавно, используя методы вискозиметрии и двойного луче-
преломления, группа авторов [281] исследовала влияние на
проникновение в клетку однозарядных анионов: F–, Cl–, I–,
NO3–, ClO4–, CNS–, CH3COO–.
Изучалась термодинамическая жесткость молекулы ДНК
в растворе в широком диапазоне ионных сил и при различ-
ных значениях температуры. Оказалось, что персистентная
длина ДНК не зависит от вида анионов соли при любом зна-
чении ионных сил, тогда как размеры ДНК, определяемые
по характеристической вязкости, изменяются под влиянием
анионов, что обусловлено, видимо, изменением дальних вза-
имодействий макромолекул ДНК с последующим изменени-
ем их конформационного состояния.
Известно, что живая клетка обладает способностью пе-
реходить в возбужденное состояние, при котором в клетке
возникают локальные заряды. Величина этих зарядов за-
висит от потока ионов, например, несущих положительный
заряд в одном направлении и отрицательный заряд — в
противоположном. Возникает поляризация клеточной струк-
туры, что обусловлено изменением проницаемости мембран
([318], 1, с. 512).
Приводить примеры роли тех или иных ионов можно
было бы и дальше, но и упомянутых данных вполне доста-
точно, чтобы сформулировать седьмой постулат.
264
Живая клетка.indb 264 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-264-320.jpg)

![Гл а в а 6
Строение мембран и их роль
в жизнеобеспечении клетки
В первой главе мы уже касались биологии мембраны,
а в пятой, рассматривая проблемы переноса ионов из внеш-
ней среды в клетку, столкнулись с участием мембран в этом
процессе. Теперь логично остановиться, прежде всего, на
химической структуре соединений, которые входят в состав
мембран и создают основу для пространственного построе-
ния этих поверхностных и разграничительных образований.
Согласно представлениям А. А. Болдырева с сотр. [374],
главными компонентами мембран являются белки (40−60%)
и липиды (60−40%). В составе последних преобладают фос-
фолипиды и триглицериды, затем производные аминоспир-
тов и стерины. Встречаются в мембранах также углеводы,
как правило, олигосахара и их производные с липидами (гли-
колипиды) и белками (гликопротеины).
Несмотря на то, что мембраны по составу основных
компонентов различаются между собой, в их состав прак-
тически всегда входят фосфолипиды, производные L-глице-
ро-3-фосфата (фосфатиды):
R1 — остаток предельной карбоновой
кислоты,
R2 — остаток непредельной карбоновой
кислоты,
X — спирты, в том числе холестерол.
6.1. L-глицеро-3-фосфат
266
Живая клетка.indb 266 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-266-320.jpg)


![Строение мембран и их роль в жизнеобеспечении клетки
лей по двойным связям (геометрические изомеры), вариации
радикалов X и R, мы можем представить себе то громадное
число изомеров, которые могут присутствовать в мембранах.
Что касается белков, то по данным Болдырева [341, с. 14]
существует более 30 белков, входящих в состав различных
мембран. По своим функциям они исключительно разноо-
бразны: иммунные и структурные белки, белки, образующие
в мембране каналы для ионов, рецепторы медиаторов и гор-
монов, ферменты, в том числе транспортные [409].
Имеются еще интегральные белки, при удалении кото-
рых нарушается структура мембраны. Именно белки при-
дают мембранному бислою его специфические свойства,
хотя структурная целостность мембраны определяется ли-
пидами, как уже отмечено, имеющими полярную головку и
гидрофобный хвост. Интегральные белки упорядочивают
прилегающие к ним липиды, ограничивая их подвижность.
В присутствии белкового компонента вязкость мембраны
увеличивается в десятки раз.
В растительной клетке прочность мембраны обеспечива-
ется не интегральными белками, а целлюлозой, наиболее рас-
пространенным органическим веществом на Земле (на долю
целлюлозы приходится около 50% всего органического веще-
ства планеты).
Особо нужно отметить двойственность поведения мем-
бран благодаря присутствию фосфолипидов. Как мы уже ви-
дели, в их состав входят остатки предельных и непредельных
карбоновых кислот. Если благодаря первым мембранам при-
суща гибкость (большое число конформационных изомеров),
то вторые превращают мембраны в более жесткие структуры
(присутствуют геометрические изомеры).
Болдырев ([388], с. 27) образно и красочно обрисовал мем-
брану, как мы ее сейчас представляем: «На ее поверхности,
как на волнах штормового океана перемещаются «лодочки»
периферических белков, а интегральные белки, как айсбер-
ги, утоплены вглубь волнующейся поверхности бислоя. Син-
269
Живая клетка.indb 269 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-269-320.jpg)
![Строение мембран и их роль в жизнеобеспечении клетки
хронные колебания морщат эту поверхность, пробегая по ней
и медленно затухая. С мембраной взаимодействуют сотни ве-
ществ с обеих сторон ее — из клетки или со стороны внешней
среды. Одни вещества жадно поглощаются, другие активно
выбрасываются наружу. Клетка реагирует на появление чу-
жеродных белков, а также на свои собственные (белковые и
небелковые) сигнальные молекулы∗. В большинстве случаев
специфику функций клеточной мембраны обеспечивают ее
белковые структуры».
В качестве примера Болдырев приводит белок гликофо-
рин, имеющий в своем составе 26 гидрофобных аминокислот.
Эта часть (спиральная) погружена в мембрану, а гидрофиль-
ные участки «высовываются» из нее по обе стороны. Глико-
форин имеет в своем составе и углеводные компоненты.
При изучении плазматических мембран Лодиш и Ротмен
[375] нашли, что в состав этих образований входят в основ-
ном фосфоэтаноламин и холестерол, структура которых
представлена на рис. 81. Так как в работе авторов рассматри-
вается вопрос о сборке клеточных мембран, они считают, что
гидрофильность головной части молекул и гидрофобность
хвостовой определяют направленность их встраивания в
структуру мембран.
По представлению Лодиша и Ротмена, плазматическая
мембрана выглядит так, как представлено на рис. 82, где чет-
ко видны все компоненты: липиды, интегральные и перифе-
рийные белки, углеводы. Строение мембран асимметрично:
углеводы всегда находятся на внешней поверхности, а пери-
ферийные белки, как правило, на внутренней — цитоплазма-
тической.
Эта асимметрия возникает и сохраняется благодаря тому,
что встраивание белка в липидный бислой происходит со
∗ По-видимому, Болдырев имеет в виду «сигнальные» молекулы, ко-
торые вырабатываются другими клетками сложного организма (главным
образом, животного). — прим. автора.
270
Живая клетка.indb 270 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-270-320.jpg)
![Строение мембран и их роль в жизнеобеспечении клетки
Рис. 81. Липиды и холестерол в клеточной мембране ([375], с. 151).
Головной конец – гидрофильный, хвостовой — гидрофобный.
Рис. 82. Модель плазматической мембраны (пояснения в тексте),
([375], с. 154).
271
Живая клетка.indb 271 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-271-320.jpg)
![Строение мембран и их роль в жизнеобеспечении клетки
стороны цитоплазмы, где белки синтезируются. Естественно,
гидрофильные молекулы углеводов подстраиваются с внеш-
ней стороны клетки, где они обычно и находятся.
Рис. 83. Схема, иллюстрирующая временную и авторскую динамику
представлений о структуре мембран ([386], с. 8).
272
Живая клетка.indb 272 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-272-320.jpg)
![Строение мембран и их роль в жизнеобеспечении клетки
Интересные результаты получены Лодишем и Ротменом
по воссозданию структуры мембран после обработки их де-
тергентом, удаляющим липиды. Если затем тем или иным
способом удалить детергент, вернуть липиды к смеси бел-
ков и углеводов, происходит самосборка мембраны, но уже
без наличия асимметрии, т. е. углеводы оказываются с обеих
сторон реконструированного образования, напоминающе-
го мембрану. Эти результаты позволяют авторам говорить о
сборке «мембранного мешка» не путем de novo, а за счет рас-
тягивания уже существующего.
Эта точка зрения перекликается с высказанной другими
авторами гипотезой, что для образования новой мембраны
нужна «затравка», т. е. кусочек старой. По-видимому, про-
блема мембранообразования еще слишком мало разработана
и требует основательных исследований для ее разрешения,
тем более, что представления о строении мембран еще нель-
зя считать окончательно сложившимися и завершенными.
Если обратиться к динамике представлений по этому вопро-
су (рис. 82), приведенной в работе А. Б. Рубина ([386], с. 8),
видно, что первоначальная модель Даниэли и Даусона, пред-
ложенная в 1935 г., претерпела многочисленные преобразо-
вания, зависящие, видимо, от субъективных и объективных
причин: выбор объектов исследования и т. д. На вопрос, по-
ставленный Рубиным (см. рис. 83), можно в качестве ответа
предложить модель мембраны Лодиша и Ротмена (рис. 82).
Последней из многочисленных моделей можно считать
жидкостно-мозаичную модель Тейлора, Грина и Стаута
(см. рис. 14). Дальнейшее развитие техники исследований, ве-
роятно, принесет новые, уточняющие детали в обсуждаемые
модели.
Геометрические модели мембран включают в качестве
основных компонентов белки, на поверхности глобул кото-
рых находятся полярные группировки. Допускается присут-
ствие поярных групп и внутри глобул, но тогда требуется
присутствие там же молекул гидратной воды. Однако ко-
273
Живая клетка.indb 273 27.10.2009 11:40:15](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-273-320.jpg)
![Строение мембран и их роль в жизнеобеспечении клетки
личественные данные о гидратной воде широко варьируют
и, кроме того, носят противоречивый характер ([387], с. 12).
Касаясь общей структуры плазматических мембран, сле-
дует отметить двойственный характер их структуры — на-
блюдаются ламелярные и глобулярные участки ([387], с. 15).
При этом выявляемая под электронным микроскопом глобу-
лярная структура мембраны, наряду с приведенными карти-
нами ее ламелярного строения, трактуется обычно как зави-
симые от температуры обратимые фазовые переходы. Данные
электронной микроскопии о размерах липопротеиновых гло-
бул подтверждаются седиментационными результатами.
Присутствие в мембранах глобул вполне естественно, так
как встроенные в них молекулы белков-ферментов, объеди-
няя вокруг себя молекулы воды и липидов, склонны к гло-
булярному строению. В этом процессе участвуют и другие
малые молекулы, изменяющие общее построение и функцио-
нальную активность мембран. Так, например, α-токоферол
(витамин Е, см. 2.31) является незаменимым компонентом
биологических мембран [385] и выполняет важную функ-
цию по сохранению их целостности, участвуя в регуляции
пероксидного окисления липидов и являясь мощным при-
родным антиоксидантом. При этом действие α-токоферола
проявляется в очень широком диапазоне концентраций
(от 10-4 до 10-25 М).
В качестве другого примера можно привести действие на
мембраны меллитина, основного компонента пчелиного яда
[381], который является мини-белком, молекула которого
состоит всего из 26 аминокислотных остатков (6 из них не-
сут положительный заряд). Обладая сильным поверхностно-
активным действием, меллитин при взаимодействии с мем-
бранами нарушает их проводимость, а также встраиваясь
в их матрикс, формирует короткоживущие поры [390]. По-
разительно то, что происходящие изменения свойств фосфо-
липидов бислоя распространяются на расстояние в десятки и
сотни молекул от включившейся молекулы меллитина [391].
274
Живая клетка.indb 274 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-274-320.jpg)
![Строение мембран и их роль в жизнеобеспечении клетки
Малые молекулы определенных веществ, обладающих
специфической структурой, могут, не меняя строения мем-
бран, проникать в клетку, пересекая гидрофобный бислой
и перенося с собой те или иные соединения. Так, нонактин
(6.6), образуя с катионом калия и четырьмя молекулами воды
комплекс (уже гидрофобный), пересекает за счет тепловых
движений гидрофобную зону мембраны [383]. Аналогичным
образом осуществляется перенос и других катионов и анио-
нов [379].
6.6. Нонактин
Белки мембран ответственны также за образование ион-
ных каналов, обеспечивающих перенос ионов через мем-
браны, что мы уже излагали в главе 5 настоящей работы. Не
совсем понятно, почему структура, например, натриевых ка-
налов сходна с таковой ацетилхолинового рецептора [382].
Вполне возможно, что клетке «выгодно» перестраивать одну
структуру в другую, не меняя существенным образом пер-
вичную структуру белка, задаваемую геномом.
Иногда клеточные белки подразделяются на мембран-
ные и плазматические [392], хотя такая классификация
основана, скорее всего, на методических подходах, связан-
ных с экстракцией белков [384]. В действительности многие
плазматические белки могут обратимо связываться с био-
мембранами [393].
Нельзя обойти вниманием влияние Са2+ на модуляцию
рецепторных каналов [378], которые играют ведущую роль в
регулировании деятельности нервных клеток. При этом про-
исходит фосфорилирование каналов и быстрая потенциация
каналов через Са2+-зависимый белок.
275
Живая клетка.indb 275 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-275-320.jpg)
![Строение мембран и их роль в жизнеобеспечении клетки
До сих пор, говоря о проницаемости и функционировании
мембран, мы обсуждали вопросы обмена клетки с окружаю-
щей средой на примере проницаемости и обмена неоргани-
ческих ионов. Следует остановиться на функционировании
мембран при обмене с их помощью органических соедине-
ний, молекулы которых не заряжены и их величина намного
превосходит размеры неорганических ионов.
Особое положение занимают органические вещества
(неэлектролиты), обмен которых между клеткой и средой
требует особых подходов. В обширную группу неэлектроли-
тов входят соединения различных классов с самыми разноо-
бразными химическими и физико-химическими свойства-
ми. К ним относятся газы, спирты, углеводы, аминокислоты,
креатинин, белки и т. д. Механизмы проницаемости их че-
рез мембраны столь многолики, что разбирать все нюансы
этих процессов не стоит, так как это сделано в монографии
А. С. Трошина еще в 1985 г. [389].
Остановимся хотя бы кратко на проникновении через
мембраны белковых веществ, роль которых для клетки ве-
лика. Белки не могут в неизменном виде поступать в клетки
извне. Когда идет речь о проникновении белков через мем-
браны, то имеется в виду только перемещение внутри клетки,
где они синтезируются и переправляются в те компартменты,
где они должны функционировать. Именно эта задача долж-
на решаться клеткой, жизнь которой зависит от метаболизма
всей клеточной системы, состоящей из цитоплазмы и целой
системы внутриклеточных органелл (митохондрии, лизо-
сомы, липосомы, вакуоли, цистерны, микротрубочки, пла-
стиды и т. д.). В конечном счете в клетке существуют целые
сети компартментов, разделяемых мембранами [380]. Сре-
ди этих сетей первое место, видимо, принадлежит аппарату
Гольджи. Вместе с эндоплазматическим ретикулом (ER), ап-
парат Гольджи (АГ) и плазматические мембраны составляют
единую мембранную систему клетки [377]. Сюда же, видимо,
следует отнести систему пластид, митохондрий и стромул в
276
Живая клетка.indb 276 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-276-320.jpg)
![Строение мембран и их роль в жизнеобеспечении клетки
растительных клетках [376]. Сведения об этих системах по-
явились еще в период световой микроскопии, затем были
подтверждены с помощью электронной микроскопии. Вы-
воды тех периодов подтверждаются данными, полученными
современными методами: конфокальной, флуоресцентной и
видеомикроскопией, позволившими проводить наблюдения
над живыми клетками [376].
Сейчас принята следующая общая схема движения бел-
ков (карго): синтезированные в ER белки концентрируются в
переходном ER(tER) и транспортируются в промежуточный
между ER и АГ компартмент, из которого они переходят в АГ
в отпочковывающихся пузырьках или по тубулярным струк-
турам. Затем белки ковалентно модифицируются, проходя
через цистерны АГ, на трансповерхности АГ сортируются
и отправляются к местам своего назначения [374]. В цити-
руемой работе приводятся пути модифицирования молекул
белков: гликозилирование олигосахаридных цепей белков и
липидов, сульфатирование ряда сахаров и тирозиновых ра-
дикалов, а также активация предшественников полипептид-
ных гормонов и нейропептидов.
Заканчивая изложение информации, имеющейся в лите-
ратуре о структуре и функциях мембран, можно констатиро-
вать следующее:
а) в построении мембранного матрикса участвуют соеди-
нения, обладающие возможностью возникновения необо-
зримого количества изомеров (конформационных и геоме-
трических);
б) белки, поступающие из цитоплазмы и компартментов,
присутствующих в ней (АГ, ER, стромы, цистерны, пузырь-
ки и т. д.), также разнообразны, и их поступление, видимо,
диктуется изменяющимися условиями среды, окружающей
клетку.
Согласно современным представлениям, ведущая роль в
процессах приема, переработки и передачи информации в
клетке принадлежит биомембранам. Посмотрим, как пред-
277
Живая клетка.indb 277 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-277-320.jpg)
![Строение мембран и их роль в жизнеобеспечении клетки
ставляют себе этот процесс биофизики [410]: «Внешние сиг-
налы преобразуются во внутриклеточные в плазматической
мембране. Разнообразные системы получения и переработки
информации в животных и растительных организмах осно-
ваны на едином принципе. Внешняя сигнальная молекула,
или первичный мессенджер (посредник — химический агент,
квант света и т. д. ), связывается со специфическим белком-
рецептором в мембране и активирует белок-преобразователь,
который в свою очередь активирует вторичный мессенджер,
переносящий сигнал внутрь клетки.
На молекулярном уровне передача информации обеспе-
чивается цепочкой мембранных белков, последовательно
взаимодействующих друг с другом. Взаимодействие белков
приводит к их конформационной перестройке: изменению
структуры и функции. На определенной стадии дальнейшая
передача информации поручается находящимся в цитоплаз-
ме вторичным посредникам: малым молекулам и ионам»∗.
Авторы развивают эту идею, рассматривая участие цАМФ,
цГМФ, ИТФ, Са2+, арахидановой кислоты, диацилглицерола и
считают этот способ передачи сигналов универсальным. Они
отводят значительную роль также и специализированным
мембранным белкам (G, Gs, Gi), которые связываются с пере-
численными вторичными посредниками.
Можно было бы и дальше развивать эти представления,
если бы найти ответ на основной вопрос: кто и что определя-
ет, какие белки и вторичные мессенджеры будут участвовать
в передаче информации и управлении внутриклеточными
процессами. Ответа на этот вопрос у авторов упоминаемой
работы найти не удалось.
Ни в коем случае нельзя забывать, что все изложенное
должно помочь нам понять, как происходит авторегуляция
внутриклеточных процессов в живой клетке.
∗ Ну чем ни демон Максвелла, только уже занимающийся реальной
деятельностью — прим. автора.
278
Живая клетка.indb 278 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-278-320.jpg)
![Строение мембран и их роль в жизнеобеспечении клетки
Возьмем на вооружение тезис о том, что мембранам при-
надлежит роль регуляторов внутриклеточных процессов.
Тогда сохранение клеточного гомеостаза тоже будет обеспе-
чиваться мембранами. Отсюда регулирование метаболиз-
ма клетки, ее живое состояние неизбежно будет связано с
участием мембран, которые тем или иным способом долж-
ны управлять потоками веществ, поступающих в клетку и
вытесняемых из нее в окружающую среду. Мы уже доста-
точно подробно знакомились (глава 5) с избирательной и
неизбирательной проницаемостью мембран для катионов
и анионов, обсуждали экспериментальные работы и теоре-
тические подходы, посвященные проблеме проницаемости
органических соединений (аминокислот, углеводов, жиров,
спиртов, стеринов).
Избирательность, специфичность переноса веществ в
клетку и из нее может быть обеспечена с участием либо ак-
тивного транспорта с помощью «насосов» и специфических
переносчиков, либо с участием многочисленных ионных ка-
налов, управляющих поступлением всех перечисленных сое-
динений. И в том и в другом случае необходимо, однако, по-
нять механизм действия самих образований (Ca++-, K+-, Na+-,
Mg++-, Ba++-, Cl–- и других каналов и «насосов»). И активный
транспорт, и функционирование всех каналов зависят от при-
сутствия АТФ, АДФ, АМФ, рН среды, различных факторов и
активаторов, белков группы G. Все это достаточно подробно
изложено в работе Крутецкой и Лонского ([410], с. 93–182).
Отвлечемся от построений, приведенных в цитируемом
труде, и попытаемся понять, что может лежать в основе
функционирования «насосов» и каналов. Обратимся к слу-
чаю понятному и обычному, когда окружающей средой клет-
ки является жидкость (газ в данном случае не обсуждаем).
Значит, любое вещество неизбежно подвержено жидкостной
диффузии и непрерывно перемещается вместе с растворите-
лем. Процесс этот происходит в направлении, обеспечиваю-
щем в конечном счете уменьшение свободной энергии Гиббса
279
Живая клетка.indb 279 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-279-320.jpg)

![Строение мембран и их роль в жизнеобеспечении клетки
Мы уже видели, что молекулы специфических белков
встроены в мембраны с участием все тех же, только что упо-
минавшихся, макроэргов, которые обеспечивают определен-
ное конфигурационно-конформационное состояние белка.
Вещество, диффундирующее в клетку, в таком случае либо
подвергается химическому превращению, либо перемещается
по каналу, избирательно задерживаясь в соответствии со сво-
ими физико-химическими свойствами, что фактически под-
тверждается данными В. А. Филова и Е. И. Люблиной [424],
обнаружившими корреляцию между физико-химическими и
биологическими свойствами.
Скорость перемещения веществ, диффундирующих через
канал в клетку, как и в хроматографической колонке, в соот-
ветствии с уравнением Ван Деемтера, будет, вероятно, зави-
сеть от одних и тех же параметров:
где HETP — высота, эквивалентная теоретической хромато-
графической тарелке, и (в нашем случае) величина, характе-
ризующая эффективность разделения; λ — константа, учиты-
вающая нерегулярность поверхности канала; dp — диаметр
канала; γ — кривизна (извилистость) канала; Dm — фактор,
характеризующий диффузию жидкости; M — линейная ско-
рость потока; kʹ — фактор распределения между жидкостью
и поверхностью канала.
Понятно, что основное отличие каналов мембраны от хро-
матографической капиллярной колонки в вариабельности
поверхностей мембранных каналов. Конформационные из-
менения белков, участвующих в построении мембран, будут
вести к изменению параметров селективности разделения и,
следовательно, к изменению скорости перемещения веще-
ства, проникающего в клетку. Конечно, поток поступления
вещества при этом не должен быть непрерывным.
281
Живая клетка.indb 281 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-281-320.jpg)
![Строение мембран и их роль в жизнеобеспечении клетки
Обратившись к структуре каналов, мы увидим, что они
снабжены некими «воротами» (см. рис. 78 или схемы кана-
лов в работе Крутецкой и Лонского [410]). Вполне естествен-
но предположить, что «ворота» не всегда открыты, что они
пульсируют, открываясь или закрываясь, согласно получае-
мым сигналам (что и постулируется в цитируемой работе).
В таком случае сходство с хроматогрфическим процессом
еще более усиливается.
Пусть читатель простит спекулятивность этой гипотезы,
но других подходов к объяснению общего механизма функ-
ционирования мембран живой клетки, основанных на мно-
голетнем изучении литературных данных, автору пока найти
не удалось.
Теперь можно сформулировать восьмой постулат.
Мембраны, окружающие клетку, построены из недетер-
минированных (кроме белка) соединений, множественность
которых позволяет клетке быстро приспосабливаться к
меняющемуся составу окружающей среды. Благодаря тесной
связи мембран и внутриклеточного содержимого (встраива-
ющиеся в мембраны белки те же, что и белки, функциониру-
ющие внутри клетки), мембраны «сортируют» («хромато-
графируют») все вещества в зависимости от потребностей
строения, функционирования и поддержания живого состо-
яния клетки, что достигается, в том числе и посредством
участия мембран в процессе регуляции внутриклеточного ме-
таболизма, направленного на синтез макроэргических соеди-
нений, также необходимых для создания и функционирования
живой структуры.
Перейдем теперь к изложению проблемы внутриклеточ-
ного метаболизма, базирующегося на участии в этом процес-
се белков-ферментов.
282
Живая клетка.indb 282 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-282-320.jpg)

![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
цитологи, биохимики, биофизики и другие специалисты, из-
учающие функционирование живой клетки, выглядят очень
впечатляюще, но вряд ли соответствуют истинной картине
авторегуляторного процесса. Задача осложняется еще и тем,
что клетка, переходя в то или иное новое состояние, должна
вернуться (в те же доли секунды) в исходное положение, что-
бы быть готовой к новым взаимодействиям с окружающей
средой.
Скромная попытка вникнуть в проблему поиска авторе-
гуляторных механизмов была предпринята автором данной
работы в конце 1960-х гг. [397]. Имеющиеся на тот период ли-
тературные данные не позволяли найти решение этой задачи
даже на уровне предполагаемой гипотезы, однако, уже тогда
было ясно, что задачу не решить, не познав структуру прото-
плазмы, а также органелл, присутствующих в ней.
Попробуем разобраться в этом вопросе, привлекая ли-
тературные данные, опубликованные после конца 1960-х гг..
Начнем изложение со структуры ферментов и механизмов их
функционирования.
7. 1. Структура ферментов и механизмы
их функционирования
Естественно, что все, изложенное в предыдущих главах о
структуре белка, можно полностью отнести и к ферментам.
Будучи катализаторами химических превращений, имеющих
место в живой клетке, они составляют основу авторегулятор-
ных механизмов, без которых немыслимо ее существование и
функционирование.
Первой попыткой объяснить механизм действия фермен-
та была гипотеза, рассматривающая систему фермент—суб-
страт по подобию ключ—замок, т. е. такой альянс, когда изло-
мы, имеющиеся в молекуле фермента, полностью зеркально
соответствуют изломам в молекуле субстрата. Уже в 1960-е гг.
284
Живая клетка.indb 284 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-284-320.jpg)
![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
Кошланд [101] говорил об индуцированном соответствии
молекул фермента и субстрата: «...сам субстрат взаимодей-
ствует с ферментом таким образом, что создается необходи-
мое расположение каталитических групп, в результате чего
становится возможным ферментативное воздействие на суб-
страт. Таким образом, в этой теории сохраняется требование
пространственного соответствия, характерное для теории
«шаблона», но вводится дополнительное условие индуциро-
ванного изменения белковой структуры фермента».
Очень важно найти ответ на вопрос, сохраняется ли стро-
ение молекулы фермента при переходе его в раствор из кри-
сталлического состояния. Фершт [398] однозначно полагает,
что этот ответ положительный. Почему это важно? Известно,
что все данные о структуре молекул белка при его рентгено-
графическом и электронно-микроскопическом исследовании
получены для кристаллических препаратов. При отрицатель-
ном ответе эти данные потеряли бы свое значение. Однако
следует учесть, что в растворе белок находится в нескольких
конформационных состояниях и при кристаллизации отби-
рается чаще всего одна из них.
Интересные данные о третичной структуре трех фер-
ментов: химотрипсина, эластазы и трипсина приведены на
рис. 84. Поражает сходство состояний их полипептидных
цепей. Гомология цепей химотрипсина и трипсина совпада-
ет на 50%, но гомология внутри глобулы белка — на 60%, а
на поверхности лишь на 10%, что и отражается в целом на
третичной структуре. Различия наблюдаются только в распо-
ложении поверхностных петель, тогда как внутренние части
глобул практически не отличаются.
Можно предполагать, что активные центры этих фер-
ментов возникают при взаимодействии с субстратами на
поверхности глобул. Для химотрипсина было показано рас-
положение его активного центра в поверхностной впадине.
Аналогичные данные получены для 83% из 67 изученных
ферментов (см. раздел 2. 2).
285
Живая клетка.indb 285 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-285-320.jpg)
![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
1 2 3
Рис. 84. Ленточные диаграммы полипептидных цепей: 1 — химотрип-
сина; 2 — эластазы; 3 — трипсина. ([398], с. 29). α-Углеродные ато-
мы располагаются на сгибах ленты. Небольшие различия имеются в
структуре лишь внешних петель.
Расшифровать механизм действия ферментов можно,
зная лишь структуру и поведение фермент-субстратных ком-
плексов (ФСК), что осуществить весьма и весьма сложно, так
как комплексы существуют доли секунды, тогда как снятие
рентгенограммы длится несколько часов.
И снова остается создавать построения и модели на осно-
вании косвенных данных, так как получать результаты иссле-
дования, наблюдая целостные живые клетки, в которых воз-
никают ФСК, пока не представляется возможным.
Какие же свойства белковых молекул следует принимать
во внимание, чтобы понять: что происходит, когда образу-
ется ФСК? Прежде всего, белковая молекула чрезвычайно
динамична, хотя валентные связи полипептидной цепи при-
дают ей достаточно жесткий характер. Мы уже видели, что
цепь складывается в определенные структуры (α-спирали,
β-складки, рыхлые участки цепи), которые в конечном сче-
те образуют либо клубок, либо глобулу. Благодаря возмож-
ности поворотов вокруг σ-связей (энергия, необходимая
для этих поворотов, легко преодолевается за счет теплового
движения атомов и молекул) в глобуле или клубке заложена
возможность принимать множественные конформационно-
286
Живая клетка.indb 286 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-286-320.jpg)
![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
конфигурационные изменения, что мы уже неоднократно об-
суждали.
Субстрат, приближаясь к глобуле, вызывает в ней пере-
стройки, которые соответствуют его структуре. Посмотрим,
как это выглядит в современном понимании ([28], с. 155).
На рис. 85 (1) представлена схема присоединения субстра-
та к ферменту, согласно индуцированному соответствию по
Кошланду. Видно, что после присоединения субстрата фер-
мент видоизменяет слегка свою структуру и увеличивается в
размере. Отделение продуктов реакции ведет к возврату ис-
ходной структуры и восстановлению размеров фермента.
1
2
Рис. 85. Схемы, иллюстрирующие кошландовскую гипотезу инду-
цированного соответствия ([28], с. 155): 1 — простая схема, пояс-
няющая механизм действия. Фермент в результате присоединения
субстрата к активному центру слегка изменяет форму фермента и
последний становится более объемным; 2 — более подробная схема.
Соединяясь с ферментом, субстрат вызывает в нем изменение, в ре-
зультате которого активные группы фермента сближаются.
287
Живая клетка.indb 287 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-287-320.jpg)
![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
На рис. 85 (2) изображена молекула фермента в виде свер-
нутой полипептидной цепи, которая может измениться так,
что молекула субстрата оказывается в активном центре, где
и будет осуществляться реакция. Одновременно видно, что
молекулы, обладающие структурой, расположение пептид-
ных групп которой не может привести к образованию ФСК,
останутся неизменными, т. е. реакции не будет.
Наглядное представление об образовании фермент-суб-
стратного комплекса можно почерпнуть из рис. 86, взятого
из фундаментального руководства по биохимии Л. Страйера
([408], т. 2).
Рис. 86. Конформация гексокиназы значительно изменяется при свя-
зывании глюкозы (показано стрелкой). Две доли фермента сближают-
ся и окружают субстрат ([408], 2, с. 36).
Теперь нам нужно разобраться, каков механизм превраще-
ний самого ФСК. В разделе 2.2 мы уже рассматривали извест-
ное в химии белка явление, именуемое, аллостерией. Суть его
в том, что некое вещество, присоединяясь к молекуле белка,
не участвует в самой ферментативной реакции, но вызывает
в ней (молекуле белка) изменения, способствующие образо-
ванию структуры активного центра, с помощью которого и
осуществляется та или иная реакция. Для того чтобы понять,
как осуществляется саморегулирование, необходимо пред-
ставить себе не только включение ферментативной реакции,
288
Живая клетка.indb 288 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-288-320.jpg)
![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
но и ее приостановку, ингибирование. Существует два типа
ингибиторов: конкурентные и аллостерические. Когда некое
вещество может занять хотя бы часть места, куда должен бу-
дет присоединиться субстрат, реакция блокируется, и такое
ингибирование называется конкурентным (рис. 87 (1, 2 и 3)).
Если же вещество, внедряясь в молекулу фермента, меняет
ее так, что активный центр не может принять нужную для
субстрата конфигурацию, такое ингибирование называется
аллостерическим (рис. 88).
1 2
3
Рис. 87. Конкурентное ингибирование ([28], с. 162): 1 — простая схема,
поясняющая механизм ингибирования; 2 — фермент сукцинатдегидро-
геназа катализирует превращение янтарной кислоты в фумаровую;
3 — конкурентное ингибирование фермента малоновой кислотой.
Аллостерия белковой молекулы нами кратко уже обсуж-
далась в разделе 2.2. Наиболее существенным в данном фено-
289
Живая клетка.indb 289 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-289-320.jpg)
![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
мене является то, что при взаимодействии аллостерического
эффектора с молекулой белка изменяется кинетика фермен-
тативной реакции, что достаточно полно изложено в работе
Курганова «Аллостерические ферменты» [405]. Стоит под-
черкнуть, что явление аллостерии лежит в основе процессов
регулирования ферментативной активности — от стимули-
рования, до ее полного блокирования.
Рис. 88. Аллостерическое ингибирование ([28], с. 164).
Все изложенное ранее о ФСК характеризует направлен-
ность изменений молекулы фермента, но не отвечает на во-
прос, что же происходит в химическом плане с молекулами
фермента и субстрата. В данном случае мы прежде всего
должны учитывать:
290
Живая клетка.indb 290 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-290-320.jpg)
![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
а) лабильность (динамичность) молекулы белка-фермента;
б) возможность конформационно-конфигурационных пе-
рестроек белковой глобулы;
в) существование на поверхности глобулы всевозможных
петель, выступов и щелей;
г) присутствие в полипептидной цепи аминокислот, не-
сущих группировки, способные давать все типы связей, на-
чиная от ковалентных и ионных до дисперсионных и вандер-
ваальсовых;
д) способность доменов белка образовывать агрегаты;
е) присутствие в клетке неорганических соединений (ка-
тионов и анионов);
ж) присутствие в клетке молекул воды и низкомолекуляр-
ных органических веществ (гормоны, витамины, макроэрги,
коферменты).
Все перечисленные химические и физические свойства
структуры компонентов, присутствующих в живой клетке,
неизбежно оказывают влияние на белковые глобулы, кото-
рые должны обладать ферментативной активностью. В пер-
вую очередь они оказывают влияние на образование и функ-
ционирование активных центров ферментов.
Следует обратить внимание на ингибирование фер-
ментативной активности по типу обратной связи, когда
молекула фермента блокируется продуктами реакции —
«the phenomenon of feedback inhibition» [406]. Этот тип регу-
лирования весьма и весьма распространен. Интересно, что
влияние на активность фермента оказывают не только про-
дукты самой реакции, но и вещества, которые образуются в
результате дальнейших биосинтетических процессов. Так,
оказалось, что гомосериндегидрогеназа ингибируется обра-
зующимся при этом треонином, который вызывает агрега-
цию фермента с образованием неактивной формы, в то же
время такая агрегация снимается гомосерином, изолейци-
ном или метионином. Эти наблюдения позволяют предпо-
лагать, что агрегация-дезагрегация молекул фермента так-
291
Живая клетка.indb 291 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-291-320.jpg)
![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
же играет существенную роль в регуляции ферментативной
активности, зависящей от динамичности белковых молекул
(см. рис. 38).
Лабильность и динамичность белковой молекулы обуслов-
лены прежде всего свободными поворотами вокруг σ-связей,
т. е. конформационными изменениями. Они ведут к разрыву
одних и образованию других водородных, сульфгидрильных
и ионных связей, иначе говоря, к конфигурационным сдви-
гам. Благодаря тому, что последовательность аминокислот в
полипептидной цепи детерминирована, а глобула свернута
так, что структурная энергия близка к минимальной, при об-
разовании активного центра изменяются углы между хими-
ческими связями. В молекуле возникает деформация и допол-
нительное напряжение [401], возрастает энергия, и фермент
переходит в возбужденное состояние [97, 399]. Чизмаджев
с сотр. [402] считают, что течение ферментативной реакции
можно подразделить на два этапа — быстрая конформаци-
онная перестройка активного центра, затем медленная пере-
стройка белковой глобулы, длящаяся вплоть до секунд.
До сих пор мы рассматривали перестройки белковой
глобулы, возникновение активного центра и образование
ФСК, учитывая конформационно-конфигурационные из-
менения, сопровождающие эти процессы. В разделе 2.10 мы
отмечали, что согласно данным Волькенштейна и сотр. [237,
238, 400, 403], такие перестройки в обязательном порядке
сопровождаются перераспределением электронных плот-
ностей в молекулярных системах. ФСК они рассматривают
как сложную систему, состоящую из нескольких подсистем,
взаимодействующих между собой, когда субстрат реагирует
с активным центром фермента. Происходит перераспределе-
ние электронных плотностей и возникает ЭККВ, которое и
приводит к разрыву одних и образованию других валентных
связей. Для простоты считается, что остальная часть глобу-
лы белка-фермента при этом остается неизменной, хотя это
и не совсем так. Часть энергии, выделяющейся в этом про-
292
Живая клетка.indb 292 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-292-320.jpg)
![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
цессе протекания реакции, диссипируется и поглощается
глобулой с ее незначительными изменениями, что позволяет
ей вернуться в исходное состояние и быть готовой к после-
дующему акту катализа.
Для осуществления реакции необходимы не только изме-
нения в молекуле фермента, но и активация самого субстра-
та при образовании ФСК [238]. Активация будет зависеть от
зарядового состояния активных групп, их числа и простран-
ственного расположения. Следует заметить, что при рас-
положении групп таким образом, что система не достигает
энергетического минимума, активация превышает энергию
равновесного комплекса.
Более подробную информацию о ФСК, АЦФ (активный
центр фермента), влиянии на АЦФ ближнего и дальнего
окружения фермента читатель найдет в работе М. В. Волькен-
штейна с сотр. [400]∗. Мы же перейдем к вопросу рассмотре-
ния метаболизма живой клетки.
7. 2. Роль метаболизма в жизнеобеспечении
клетки
Метаболизм (обмен веществ) играет ведущую роль в
снабжении клеток энергией и веществами, которые клетка
использует в качестве строительных блоков для своих струк-
турных преобразований. Считается, что даже у простейших
микроорганизмов осуществляются не менее тысячи различ-
ных химических реакций.
На самом деле их число на порядок больше, если учесть,
что в клетке присутствует более десяти миллиардов молекул
одних только белков, подавляющее большинство которых об-
∗ Энергетика ферментативного катализа достаточно полно изложена в
работе Л. Ф. Дмитриева [404].
293
Живая клетка.indb 293 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-293-320.jpg)
![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
ладает каталитическими свойствами, т. е. катализирует пре-
вращения поступающих в клетку веществ.
На первый взгляд кажется, что добиться согласованности
всех реакций практически невозможно. Но без согласован-
ного течения реакций метаболизм не будет иметь смысла.
Известный биохимик Л. Страйер ([408], т. 2, с. 6) не считает
положение столь безнадежным, если учитывать, что реак-
ции протекают по определенным простым типам. Кроме того
число молекул соединений, выполняющих ключевую роль в
проявлениях всех форм жизни, по его мнению, не превышает
сотни. Но это не так уж и мало, если учесть, что добиться со-
гласованного течения и двух процессов не всегда бывает лег-
ко, особенно если это согласование должно осуществляться
спонтанно, самопроизвольно.
Течение химических процессов, естественно, должно под-
чиняться термодинамическим законам. Мы уже во введении
констатировали, что, согласно первому закону термодинами-
ки, энергия системы и среды сохраняется. Изменение энергии
системы (ΔЕ) в начале процесса (ЕА) и в конце его (ЕВ); тепло-
та, поглощаемая системой (Q) и работа, выполняемая ею (W),
связаны соотношением:
Видим, что изменение энергии системы не зависит от
пути, по которому совершается переход от начального состо-
яния к конечному. Отсюда следует, что ΔЕ не может служить
критерием спонтанности протекания той или иной реакции.
Вероятно, для этой цели нужны какие-то иные функции, ко-
торые позволили бы отвечать на вопрос о самопроизволь-
ности процесса превращения веществ. Такой функцией об-
ладает прежде всего энтропия (S), характеризующая степень
разупорядоченности системы.
Второй закон термодинамики гласит, что спонтанно могут
протекать только те процессы, которые ведут к возрастанию
энтропии в системе и окружающей среде:
294
Живая клетка.indb 294 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-294-320.jpg)
![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
Однако использовать величину изменения энтропии про-
цесса сложно, особенно для описания химических реакций,
так как приведенное уравнение требует, чтобы была известна
величина энтропии окружающей среды. Эта трудность была
устранена путем сочетания первого и второго начал термо-
динамики и введением новой функции свободной энергии
Гиббса (G).
Учитывая, что для реакций важно не изменение энергии
системы, а изменение теплового эффекта реакции (Н), тогда:
По Страеру [408] реакция может идти спонтанно только
при отрицательном значении ΔG.
Система находится в равновесии и не претерпевает ника-
ких изменений, когда ΔG = 0.
При положительном значении ΔG протекание реакции
возможно, если будет приток энергии за счет сопрягающей
реакции.
Хотя изменение величины свободной энергии и позволяет
делать заключение о спонтанности протекания той или иной
реакции, ее механизм при этом не выявляется. Он не зависит
от пути превращения, возможно, многостадийного, на неко-
торых этапах даже с положительным значением ΔG.
Чтобы реакции с положительным значением ΔG не бло-
кировали весь процесс метаболизма, по всей вероятности
необходимы вещества, способные обеспечить энергией не-
возможные процессы. Страйер считает, что энергия для этих
целей поставляется за счет распада аденозинтрифосфорной
кислоты (2.81) и других макроэргов, синтез которых проис-
ходит с участием той же аденозинтрифосфорной кислоты
295
Живая клетка.indb 295 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-295-320.jpg)
![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
(АТФ). Название «энергетическая валюта» очень подходит
для АТФ, время жизни молекулы которой составляет 1 мину-
ту (образовавшись, она тут же распадается).
С использованием АТФ протекают реакции переноса фос-
фатных групп на молекулы, которые включаются в метаболи-
ческие превращения, конечная цель которых — генерирова-
ние все той же АТФ. АТФ участвует в образовании и других
энергосберегающих соединений: фосфофенолпировиноград-
ной кислоты (2.78), дифосфоглицериновой кислоты (2.80),
креатинфосфата (2.79). Эти соединения обладают более вы-
соким потенциалом переноса фосфатных групп, что позво-
ляет им превращать АДФ опять же в АТФ. Согласно Страеру,
«клетки поддерживают содержание АТФ на высоком уровне,
используя свет и окисляемые субстраты в качестве источни-
ков свободной энергии. Гидролиз АТФ резко сдвигает равно-
весное отношение концентрации продуктов к концентрации
реагирующих веществ в сопряженной реакции — примерно в
108 раз» ([408], т. 2, с. 13).
Как известно, в клетках АТФ может образовываться из
веществ, поступающих из окружающей среды, двумя спо-
собами: путем гликолиза, или окислительного фосфорили-
рования. В качестве примера рассмотрим гликолитическое
расщепление глюкозы до пирувата. Все эти превращения с
указанием изменений стандартной свободной энергии ΔG0
представлены схематически на рис. 89. Как видим, процесс
начинается с фосфорилирования молекулы глюкозы (7. 1).
Первая реакция (7.1 → 7.2) имеет положительное из-
менение ΔG0 и может идти только в сочетании с гидроли-
зом АТФ при образовании АДФ, что в сумме приводит к
изменению ΔG0 = –16,7 кДж/моль и самопроизвольному
протеканию реакции. Следующая ступень — изомериза-
ция глюкозо-6-фосфата во фруктозо-6-фосфат с участи-
ем фермента фосфоглюкозоизомеразы возможна, хотя ее
изменение (ΔG0 = +1,7 кДж/моль) положительно, но эта вели-
чина незначительна.
296
Живая клетка.indb 296 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-296-320.jpg)

![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
ется одна молекула АТФ. Еще одна молекула АТФ образуется
в результате превращения фосфоенолпирувата в пируват. Та-
ким образом, из одной молекулы глюкозы получается четы-
ре молекулы АТФ, согласно схеме на рис. 89. Если учесть, что
две молекулы АТФ были истрачены на осуществление стадий
с положительной величиной ΔG0, общий баланс составляет
2 молекулы АТФ на одну молекулу глюкозы.
Глюкоза
Глюкоза-6-фосфат
Фруктоза-6-фосфат
Фруктоза-1,6-дифосфат
Дигидроксиацетон Глицеральдегид-3-фосфат
фосфат
1,3-дифосфоглицерат
3-фосфоглицерат
2-фосфоглицерат
Фосфоенолпируват
Пируват
Рис. 89. Гликолитический путь превращения глюкозы в пируват [411].
ΔG0 для реакций от глицеральдегид-3-фосфата к пирувату умножает-
ся на 2, так как из моля глюкозы образуется по 2 моля этих веществ.
298
Живая клетка.indb 298 27.10.2009 11:40:16](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-298-320.jpg)

![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
структурные элементы клетки, придавая им высочайшую ди-
намичность за счет ЭККВ. Остается представить себе, как все
эти взаимодействия самопроизвольно регулируются и под-
держивают живое состояние клетки.
Рис. 90. Окислительный цикл трикарбоновых кислот
(цикл лимонной кислоты [423], с. 106).
300
Живая клетка.indb 300 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-300-320.jpg)
![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
7. 3. Авторегуляция внутриклеточных
процессов
Учитывая труднодоступность печатных изданий, в кото-
рых была опубликована статья об авторегулярности внутри-
клеточных процессов [397], обратимся к тем выводам, кото-
рые были сделаны автором в 1960-е гг.
Уже тогда удалось прийти к следующему заключению: «Та-
ким образом в живой системе, благодаря тесному сближению
молекул, содержащих π-сопряженные системы, можно ожи-
дать образования значительных сопряженных зон, стабили-
зирующих структуру в целом за счет снижения энтальпии
системы.
Однако включение в гиперсопряженную систему соеди-
нений, содержащих макроэргические связи, делает систему
чрезвычайно лабильной. Создается следующая ситуация: чем
выше упорядоченность в системе, тем протяженнее сопря-
женные системы, но тогда сильнее делокализованы электро-
ны, а, следовательно, легче происходит их перераспределение
под действием различных факторов, что влечет за собой на-
рушение упорядоченности. Синтезировав разрушившиеся
соединения, система возвращается в исходное состояние и
т. д. В конечном счете, изменения структуры в системе долж-
ны принять колебательный характер, зависящий, как от спец-
ифики самой системы, так и от окружающей среды. Благодаря
этому живая система получает возможность «настраиваться»
на изменяющиеся внешние условия путем изменения харак-
тера колебаний без существенных изменений своей специфи-
ческой структуры в целом».
В 1935 г. Костычев [412] писал: «Если устроить смесь всех
ферментов, находящихся в клетке, то совокупность их дей-
ствия даже отдаленным образом не будет напоминать био-
химических процессов, совершающихся в протоплазме. Дело
в том, что кроме присутствия ферментов, необходима еще
301
Живая клетка.indb 301 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-301-320.jpg)
![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
организация и структура живой клетки, благодаря которой
биохимические реакции протекают не случайно, а координи-
ровано». Мы уже видели, что Бауэр [151] также отдавал ве-
дущую роль в сохранении живого состояния клетки именно
структуре живого субстрата.
Лепешкин [95], Насонов и Александров [50] развивали
представления, согласно которым, жизнедеятельность свя-
зана с особым состоянием протоплазматических белков и
их комплексов с другими веществами. Функционирование
белков-ферментов зависит от их структурного и физико-
химического состояния [413]. Электронно-микроскопи-
ческие исследования пластид показали, что разрушение по-
следних сопровождается возрастанием ферментативных
активностей. Связывание инвертазы клеточными структура-
ми обуславливает потерю ее активности при одновременном
смещении в сторону синтетических процессов.
Шнейдер [414], а также Мак-Ларен [415] считают, что ки-
нетика ферментативных реакций зависит как от количества
фермента, так и от структурной организации клетки. Жу-
ков [416] еще в 1935 г. отмечал, что при паранекрозе (доста-
точно глубокие структурные изменения) возможна смена
биохимических процессов, о чем свидетельствуют данные
и других авторов, показавших, что парабиоз (структурные
изменения) сопровождается усиленным гликолизом, распа-
дом креатинфосфата и АТФ, при этом проводимость нерва
исчезает. Когда восстанавливается нервная система прово-
димость, одновременно восстанавливается количество ве-
ществ, подвергшихся разрушению.
Франк [418, 419] показал, что распространение возбужде-
ния по нервному волокну и сокращение мышечного волокна
сопровождаются обратимыми структурными перестройками
внутриклеточных органелл с одновременной сменой биосин-
тетических процессов. Он [420] считал, что структурные и
биохимические изменения в клетке при возбуждении и раз-
дражении возникают синхронно и неотделимы друг от друга.
302
Живая клетка.indb 302 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-302-320.jpg)
![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
Сент-Дьерьи [215, 216] в своих работах, посвященных из-
ложению основ живого состояния, главным образом, кле-
точных структур, основное внимание уделил образованию и
поведению самых различных комплексов и образований ор-
ганических веществ, взаимодействующих друг с другом. Он
убедительно доказал, что свойства любого соединения ме-
няются в зависимости от контактов и взаимодействий с дру-
гими веществами и растворителем, коим в живых системах
является вода, одновременно участвующая в образовании
живых структур. Обе работы легко доступны нашему читате-
лю, и потому нет необходимости подробно останавливаться
на их содержании.
Д. Грин и Р. Гольдбергер [89], рассматривая клетку как
основу жизни, не считают возможным касаться вопроса от-
личий клеток сложного организма друг от друга, так как
это внесет путаницу и не позволит в конечном счете понять
принципы функционирования простейшей живой клетки.
Ближе всего к понятию простейшей клетки подходят бакте-
рии. Авторы указывают ([89], с. 13: «Минимальный комплект
оснащения, необходимый любой клетке, должен включать:
1) систему мембран, которые окружают клетку, разделя-
ют ее внутри на отсеки, управляют химическим хозяйством и
несут на себе ряд важных катализаторов клетки;
2) аппарат для получения точных копий клетки путем ко-
пирования ее основных структур;
3) аппарат, обеспечивающий различные клеточные функ-
ции энергией, получаемой в результате окислительных про-
цессов.
Вокруг этих трех ключевых систем клетки и принципов,
лежащих в основе их работы, концентрируется вся биохи-
мия».
«Минимальный комплект оснащения», необходимый
клетке для ее функционирования, назван, но не так просто
определить, что это и как оно располагается внутри клетки.
Это осложняется тем, что в клетке, как известно, все движется
303
Живая клетка.indb 303 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-303-320.jpg)
![Ферменты, метаболизм и авторегуляция внутриклеточных процессов
и меняется. Изменяется форма различных частиц (митохон-
дрии, лизосомы, микротрубочки и т. д. ), изменяется конфор-
мационное и конфигурационное состояние внутриклеточ-
ных белков, а вместе с этими изменениями нарушаются или
возникают электронные взаимодействия внутри молекул и
между ними [238, 239, 407]. И еще раз подчеркнем, что все это
должно происходить в авторегуляторном режиме.
Как при этом не вспомнить, что писал о состоянии фер-
ментов в протоплазме А. С. Трошин ([319], с. 323): «Соглас-
но этой теории ферменты могут находиться в протоплазме
в двух формах: в свободном (растворенном) и в связанном
(адсорбированном на структурных элементах протоплазмы)
состояниях. В растворенном состоянии ферменты гидроли-
тически активны, а в связанном состоянии они теряют эту
способность и проявляют синтетическое действие».
Итак, мы изложили представление об авторегуляции ме-
таболизма и других внутриклеточных процессов, сложивше-
еся до 70-х гг. XX в. Что же принципиально нового появилось
после 1970-80-х гг.?
По-видимому, следует признать, что наиболее быстры-
ми темпами развивались представления о динамичности
всех процессов, связанных с сохранением живого состояния
клетки. И хотя уже в те годы Франк [87] и Камия [88] кон-
статировали непрерывность перемещения и видоизменение
органелл в живой клетке, понадобилось немало усилий ис-
следователей, чтобы стало ясно, что в основе динамичности
живой клетки лежит динамичность белка и его комплексов со
всеми его компонентами.
Наиболее убедительные данные в этом направлении ис-
следователи стали получать после того, как появилась воз-
можность наблюдать изменения белковых молекул через
миллиардные доли секунды. Вернемся к главе 2 нашей ра-
боты и обратим внимание на рис. 45 и 50, где изображены
молекулярные движения, зафиксированные через 200 пико-
секунд, и характерные конфигурации белка в растворе через
304
Живая клетка.indb 304 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-304-320.jpg)


![Гл а в а 8
Гипотетическая качественная модель
живой клетки
Создание модели в современном понимании — это при-
ближение к такому построению, которое позволит с исполь-
зованием компьютерной техники рассчитывать и предсказы-
вать поведение объекта. Мы уже отмечали, что сегодня еще
не создана физико-математическая теория живых систем. Бу-
дет ли она создана в ближайшем будущем, предсказать пока
невозможно, поэтому ограничимся качественным подходом
к этой задаче. Заранее оговорим, что это всего лишь попытка
понять, как построена и функционирует клетка. Эта попыт-
ка была предпринята нами еще в 1970 г. [428]. В основу по-
строения данной модели было взято поведение эритроцитов
теплокровных животных [66, 67]. Наблюдали поведение эри-
троцитов мышей и крыс в фазово-контрастном микроскопе,
фиксируя изменения их формы под воздействием ионов тя-
желых металлов (Hg2+, Cd2+). Результаты этих экспериментов
изложены в главе 1. Ниже представлена схема 8.1, обобщаю-
щая данные Пондера [429] и результаты наших исследований.
Как видим, под воздействием гемолитиков или при нару-
шениях внутреннего строения эритроцитов (при переходе их
в кренированное, а затем сферическое состояние) живой эри-
троцит погибает. Определенные ошибки генома (мутации),
приводящие к изменению первичной структуры гемоглоби-
на, заканчиваются кристаллизацией последнего и, в резуль-
тате, эритроцит теряет свою функциональную способность,
что равносильно смерти клетки.
307
Живая клетка.indb 307 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-307-320.jpg)
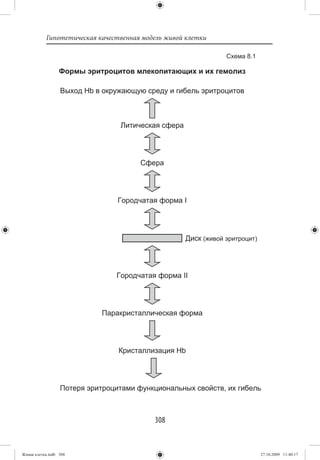
![Гипотетическая качественная модель живой клетки
Таким образом на примере этих простейших клеток видим,
что и разупорядочивание, и переход к кристаллическому со-
стоянию ведет к их гибели, что мы констатировали в главе 1.
Уже в 1970-х гг. прошлого столетия нам было ясно [428],
что при построении качественной модели живой клетки
нужно исходить из предположения о структурном единстве
всех компонентов, участвующих в ее построении, т. е. о вза-
имосвязи всех элементов клетки друг с другом. Состояние
макромолекул, как известно, определяется возможностью
возникновения внутри- и межмолекулярных связей, прежде
всего между молекулами белков и нуклеиновых кислот. Этот
феномен подробно изложен в предыдущих главах и кратко
сформулирован в соответствующих постулатах.
Рассмотрим, в чем заключаются трудности интерпрета-
ции и важность знаний, получаемых при исследовании бел-
ков и нуклеиновых кислот, когда мы пытаемся понять, как
функционирует живая система, сохраняющая свое структур-
ное состояние.
Главным препятствием на пути познания живого являет-
ся то, что основные сведения о свойствах, строении и функ-
циях белков получают в результате извлечения их из клеток,
убитых и подвергнутых разрушению. Белок очищается и из-
учается в том виде, в каком он получен в результате этих опе-
раций. Возникает вопрос — можно ли использовать данные
о поведении, строении и функциях «умерщвленных» и очи-
щенных белков при попытках понять, как ведут себя эти же
белки в живых клетках. Б. П. Токин [16, 434] предупреждал в
своих работах, что такой перенос неизбежно будет приводить
к ошибочным выводам.
В качестве основного отличия живого от неживого часто
используют способность живых клеток к метаболизму. Одна-
ко при этом само понятие «метаболизм» нуждается в объяс-
нении, о чем также писал Токин ([16], с. 50).
Динамичность белковой молекулы столь высока, что име-
ет место существование множественных изомерных форм,
309
Живая клетка.indb 309 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-309-320.jpg)
![Гипотетическая качественная модель живой клетки
обладающих одной и той же функциональной активностью,
хотя вряд ли стоит исключать при этом синхронную множе-
ственность также функциональных свойств. В случае фер-
ментов речь идет об изозимах. Особая сложность в этом
случае заключается в возможности возникновения изозимов
как в результате деятельности генома, направляющего синтез
гомологичных последовательностей аминокислот [430], так
и в результате конформационно-конфигурационной изоме-
рии (см. главу 2).
«Целесообразность» чужда физике, что отмечалось еще
Н. Бором ([79], с. 126) и затем Л. А. Блюменфельдом [12], но
она всегда наблюдается, когда мы имеем дело с живыми си-
стемами и, в том числе, естественно, с живыми клетками.
Силы диффузии и стремление любых систем к равнове-
сию и более вероятному состоянию неизбежно должны при-
водить к выравниванию и гомогенизации внутриклеточного
содержимого. Однако в действительности в живой клетке
всегда имеет место пространственная гетерогенность, что в
свое время подчеркивал А. Г. Гурвич ([431], с. 115).
Во главе 2 мы рассматривали вопрос о силах и связях ста-
билизирующих нативную белковую глобулу. В соответствии
с имеющимися литературными данными решающее значение
при этом принадлежит водородным связям и гидрофобным
взаимодействиям. Однако обстоятельный анализ, проведен-
ный П. Л. Приваловым [432], привел его к выводу, что оцени-
вать вклад «гидрофобных взаимодействий» для стабилиза-
ции белковых глобул чрезвычайно сложно. При понижении
температуры эти взаимодействия проявляют вообще деста-
билизирующее влияние. Такое же осложнение имеет место,
когда рассматриваются силы, стабилизирующие гетероген-
ное состояние протоплазмы. В зависимости от температу-
ры компоненты протоплазмы находятся в стеклообразном
(витрифицированном) жидкокристаллическом состоянии.
Наиболее легко возникает жидкокристаллическое состояние
в мембранах, тогда как гидратированные фазы витрифици-
310
Живая клетка.indb 310 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-310-320.jpg)
![Гипотетическая качественная модель живой клетки
руются гораздо труднее [433]. В конечном счете, предсказать
переходы фаз внутри клетки практически невозможно, а от
этих переходов зависит функциональное состояние клетки.
Дело осложняется также тем, что в упорядоченных сре-
дах, к каковым относятся живые клетки, взаимное влияние
макромолекул распространяется на расстояния, значительно
превышающие обычные взаимодействия молекул друг с дру-
гом [421]. В результате та или иная молекула, внедрившаяся в
клетку и обладающая избыточной энергией, может передать
свою энергию соответствующему акцептору на расстояниях,
много больших диаметра столкновения (50–100 Å). Речь идет
о переносе энергии по так называемому резонансному меха-
низму. Вызываемые таким способом возмущения могут быть
переданы на расстояния и больше 1000 Å [466].
Обнаруживаемые в последнее время воздействия слабых
магнитных полей на биологические системы создают допол-
нительные трудности на пути теоретической интерпретации
экспериментальных фактов. Это объясняется тем, что в маг-
нитобиологии имеет место явный дисбаланс между физикой
и биологией. В этой области науки физика находится в зача-
точном состоянии [435].
Не лучше обстоит дело со сверхслабыми воздействиями
химических веществ на биологические системы [436]. Обна-
руженные воздействия, например, антиоксидантов на элек-
трическую активность нейронов виноградной улитки, нахо-
дятся на уровне 10-13–10-17 М, что не поддается объяснению,
так как нельзя такого рода воздействия связать с какой-либо
определенной структурой.
М. Н. Кондрашова [437] обнаружила, что в митохондриях,
когда имеет место переход от высокоэнергетических к низко-
энергетическим состояниям, происходит не просто ослабле-
ние одних и усиление других биохимических превращений, а
наблюдается альтернативное переключение путей метаболиз-
ма по аналогии с физиологическими пороговыми реакциями,
т. е. меняется знак ответа на одно и то же воздействие.
311
Живая клетка.indb 311 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-311-320.jpg)
![Гипотетическая качественная модель живой клетки
Мы уже неоднократно отмечали, что для живой клет-
ки необходим гомеостаз по всем параметрам (температура,
рН, ионный состав, поступление питательных веществ, дав-
ление и т. д.). Обеспечение гомеостаза на уровне организма
осуществляется с участием витаминов, гормонов, нейрогу-
моральных процессов и обнаруженных в последнее время
регуляторных пептидов [438], которые получили название
«химического языка». Не ясно только, как происходит согла-
сование действий этих регуляторных систем.
Вероятно, наиболее серьезным осложнением для понима-
ния построения и функционирования живой клетки являет-
ся число белковых молекул и их видов, участвующих в обра-
зовании клеточных компартментов. Мы уже упоминали, что
число молекул белка в клетке составляет 109, а число видов
белков превышает 10 тыс ([439], с. 5), при этом подавляющее
большинство их обладает ферментативной активностью. Не
ясно, как осуществляется координация действия ферментов.
Не менее сложно понять, как автономно управляется жи-
вая клетка, когда время жизни комплексов, возникающих при
взаимодействии молекул, присутствующих в клетке, состав-
ляет подчас миллиардные доли секунды (см. главы 2, 3, 4).
В последнее время уделяется внимание цитоскелету клет-
ки и его влиянию на регуляцию ее метаболизма. Дело в том,
что на поверхности цитоскелетных образований (везикулы)
сосредоточены, например, гликолитические ферменты (фос-
фофруктокиназа, енолазы, пируватокиназа), участвующие в
метаболизме глюкозы, а также инсулин, влияющий на этот
процесс. В работе Ж. Лиу с сотр. [422] подробнейшим обра-
зом изучена роль цитоскелета в регуляции гликолитического
пути превращений глюкозы. Мы сталкиваемся со сложней-
шей схемой регуляции, в которой участвуют микротрубочки,
эндоплазматический ретикулум, аппарат Гольджи, мембра-
ны, микрофиламенты, везикулы цитоскелета. Вновь возни-
кает вопрос: как они взаимодействуют друг с другом и каков
механизм управления этими процессами? Привлечение АТФ
312
Живая клетка.indb 312 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-312-320.jpg)
![Гипотетическая качественная модель живой клетки
в качестве источника энергии мало что объясняет, так как не-
известен механизм перехода одного вида энергии в другой.
Не проще дело обстоит и с индивидуальными фермента-
ми. Так, изучая влияние АДФ, ГТФ и глутамата на связыва-
ние НАДФ(Н) глутаматдегидрогеназой (ГТД) из печени быка
Р. Коберштейн и Х. Санд [427] нашли, что ГТД, состоящая из
шести полипептидных субъединиц в присутствии эффек-
торов АДФ, ГТФ и глутамата, может связывать кофермент
в 18 точках. При этом, в зависимости от числа оккупирован-
ных точек, меняется активность самого фермента.
Загадочно поведение пируваткиназы, активность которой
зависит от присутствия Mg2+, тогда как Ca2+ в низких кон-
центрациях действует как активатор, а при более высоких как
ингибитор, что обнаружено М. Капуром [426]. Он же нашел,
что фруктозо-1,6-дифосфат является потенциально самым
мощным активатором, тогда как фруктозо-6-фосфат значи-
тельно менее эффективен. Валин является потенциальным
ингибитором, а тирозин, фенилаланин и триптофан индиви-
дуально не влияют на активность фермента, но при одновре-
менном их присутствии наблюдается сильная активация пи-
руваткиназы. Не трудно понять, что известные регуляторные
механизмы, базирующиеся на феномене «обратной связи»,
здесь, по-видимому, неприменимы.
Мы уже касались проблемы процесса набухания и вы-
талкивания воды клеткой (см. главу 1). Кажущаяся простота
этого феномена обманчива. Наблюдается зависимость от со-
держания АТФ, ионов Ca2+ и Mg2+, гормонов, разобщителей
дыхания и т. д. Снова необходим поиск ответа на вопрос, как
клетка управляет процессом гомеостаза водного режима, от
которого зависит сохранение ее живого состояния.
Обсуждая подвижность самих клеток, С. А. Самарин [440]
пытается обосновать этот феномен тем, что он обусловлен
актином, что можно подтвердить результатами многочис-
ленных работ, проводившихся под руководством Г. М. Фран-
ка [441]. Однако остается неясным вопрос, каким образом
313
Живая клетка.indb 313 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-313-320.jpg)
![Гипотетическая качественная модель живой клетки
клетка суммирует внешние сигналы, идущие от рецепторов,
чтобы ответить на них направленными изменениями актина
в нужном месте и в нужное время. И вновь мы вынуждены ду-
мать об идентификации всех звеньев сигнальной цепи, веду-
щих от рецепторов к белкам-эффекторам. Чем больше будет
привлекаться рецепторов, эффекторов, белков-посредников
и т. д., тем запутаннее будет выглядеть авторегуляторный ме-
ханизм, тем труднее понять, как в клетке происходит его ис-
полнение.
Сложно обстоит дело с представлениями о гибели клеток,
их переходе в неживое состояние. Современные представле-
ния о состоянии этой проблемы читатель найдет в работах
В. Н. Манских [444], Б. В. Черняка с сотр. [445], которые обоб-
щили данные об апоптозе (программируемой гибели клеток),
аутофагии, фагоцитозе, некрозе, клеточном старении. К со-
жалению, авторы не представили никаких данных о химизме
этих процессов. Не исключено, что таких данных просто нет.
Можно продолжить перечень примеров осложнений, на-
блюдаемых при попытках экспериментально выяснить ав-
торегуляторные механизмы живой клетки, но уже из при-
веденных данных ясно, что схемы, с помощью которых мы
попытались бы в рамках общепринятых представлений мо-
лекулярной биологии дать это объяснение, были бы либо за-
путанными и сложными для понимания, либо вообще нере-
альными для исполнения самой клеткой.
Любая молекула, внедрившаяся тем или иным путем
в клетку, «не знает», что ей делать и куда двигаться. Мо-
лекула управляется теми физико-химическими свойства-
ми, которыми она обладает. Как это происходит, должна
бы объяснить модель клетки, построенная с учетом тех же
физико-химических свойств соединений, составляющих
основу клеточных построений. При этом главное, что долж-
но учитываться, — это взаимное влияние внутриклеточных
компонентов и возможные изменения их структуры под воз-
действием окружающей среды и функционального состояния
314
Живая клетка.indb 314 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-314-320.jpg)
![Гипотетическая качественная модель живой клетки
самой клетки. Есть смысл сформулировать основные предпо-
сылки для создания обсуждаемой модели.
Мы уже отмечали, что внутри клетки имеет место плот-
ная упаковка молекул, напоминающая ситуацию, которая
осуществляется в смешанных органических кристаллах, ког-
да выступы одной молекулы входят в углубления другой, что
постулировано в свое время А. И. Китайгородским [442, 443].
Картина напоминает детскую мозаику, только не на плоско-
сти, а в объеме. Отсюда — очень важное свойство внутри-
клеточной организации: ее возникновение и сохранение воз-
можно только в строго заданных параметрах молекулярной
структуры полимеров, образующих клетку. В таком случае
главенствующими силами при образовании клетки были бы
валентные связи. Но тогда клетка была бы уподоблена чисто
механическим устройствам с шатунами, спицами, шарни-
рами и т. д., что и побудило некоторых авторов именно так
и представлять строение «живой клетки» (см. [266])∗. Но, с
другой стороны, валентные связи, обеспечивающие целост-
ность полимерных цепей, имеют важнейшее значение для
живой клетки. Не будь этих связей, клетка превратилась бы в
смесь мономерных молекул и атомов, и тогда ни о каком жи-
вом ее состоянии не могло быть и речи.
Ситуация с состоянием белка в клетке определяется фак-
торами, изложенными в четвертом постулате (см. аздел 2.11).
Нужно еще раз подчеркнуть, что белок в клетке находится в
постоянной динамике. Его стремление к минимуму свобод-
ной энергии Гиббса не должно приводить ни к равновесию,
аналогичного водному раствору белка, ни к кристаллическо-
му состоянию. И в том, и в другом случае неминуема гибель
клетки.
На первое место, в таком случае, выходят данные о дина-
мике белковых молекул, которая обеспечивается как за счет
∗ Но в таком случае структура клетки была бы жесткой и нежизнеспо-
собной — прим. автора.
315
Живая клетка.indb 315 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-315-320.jpg)
![Гипотетическая качественная модель живой клетки
КК-переходов полипептидных цепей (см. раздел 2.1, рис. 31,
38, 49, 50), так и условиями, в которых оказывается живая
клетка (рН, температура, ионная сила растворов, окружаю-
щих клетку, участие в построении белковой глобулы органи-
ческих и неорганических компонентов клеточных структур)
(см. разделы 2.2, 2.4–2.7).
Белковые движения, если обратиться к их временным
характеристикам, в значительной степени коррелируют с
движениями в молекулах нуклеиновых кислот и водных
структурах (см. [446], 1, с. 296–297), что свидетельствует об
уникальности белковых комплексов с участием их в образо-
вании жизнеобеспечивающих построений.
Итак, необходимо понять, какие же силы и связи главен-
ствуют при образовании и функционировании живой клетки.
Изложенные ранее факты и гипотезы однозначно свидетель-
ствуют о том, что процессы жизнеобеспечения базируются
на так называемых «слабых взаимодействиях» (водородные,
полярные, дисперсионные, вандерваальсовые связи, гидро-
фобные взаимодействия (см. раздел 2.3), а также на образова-
нии комплексов с переносом заряда (см. раздел 2.10)).
Образование ассоциатов белковых молекул, взаимодей-
ствующих друг с другом и мономерными молекулами других
классов (витамины, гормоны, липиды, углеводы, ионы метал-
лов), также играют роль в поддержании живого состояния
клетки. Необходимо учитывать, что образующиеся в резуль-
тате этих взаимодействий комплексы можно подразделить на
два типа:
1) стационарно сохраняющиеся в течение всей жизни
клетки компоненты — мембраны, мембранные системы (ап-
парат Гольджи, ретикулум), ядра, митохондрии, лизосомы,
микротрубочки и т. д.;
2) комплексы, продолжительность жизни которых исчис-
ляется долями секунды (см. раздел 2.3).
Вряд ли можно представить себе систему, динамически
сохраняющую свою целостность и функциональность, но не
316
Живая клетка.indb 316 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-316-320.jpg)
![Гипотетическая качественная модель живой клетки
обладающую способностью перестраивать, исправлять, уда-
лять компоненты, отработавшие и уже не нужные, а также
поступившие из окружающей среды вещества, свойства ко-
торых неприемлемы для системы. Живая клетка действитель-
но обладает такой способностью, и именуется она метаболиз-
мом (см. раздел 7.1–7.3).
Естественно, метаболизм должен быть целенаправлен-
ным, и мы видели, что целью химических превращений под
действием белков-ферментов, является получение так на-
зываемых макроэргических соединений и коферментов, со-
держащих группировки с сильно делокализованными π,π-
и n,π-сопряженными связями, разрыв которых сопровожда-
ется высвобождением энергии.
Мы подошли к решению вопроса об энергетике живой
клетки. Энергия нужна для выполнения работы живым ор-
ганизмом, для перемещения внутриклеточных компонентов,
для поддержания гомеостаза внутри клетки путем обеспече-
ния энергией активного транспорта и т. д. Можно представ-
лять, что в каждом конкретном случае существует особый
механизм преобразования энергии, и тогда для управления
этими процессами потребуется полная система датчиков,
регуляторов, исполнительных устройств. Вряд ли этот путь
реален.
Думается, что во всех случаях имеет место один и тот же
механизм получения энергии за счет структурной свободной
энергии Гиббса. Макроэргические соединения (АТФ, ГТФ,
ЦТФ, креатинфосфат, ацетилкоэнзим А и др.), встраиваясь
в комплексы с белковыми молекулами, образуют системы с
очень высокой лабильностью электронов.
Этому способствуют также комплексы, образующиеся в
липидных мембранах, где имеются изолированные «блуж-
дающие» π-связи, что достаточно полно освещено в обзоре
Л. Ф. Дмитриева [449].
Под действием внешних воздействий либо импульсов
нервной системы происходит разрыв макроэргических свя-
317
Живая клетка.indb 317 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-317-320.jpg)
![Гипотетическая качественная модель живой клетки
зей с высвобождением энергии, которая диссипируется, либо
расходуется на сопряженные реакции или на совершение ра-
боты. Далее системы релаксируют к исходному состоянию
с участием макроэргов и при необходимости осуществляют
синтез соответствующих макроэргов.
Эти процессы протекают благодаря конфигурационно-
конформационным перестройкам и с изменением электрон-
ных взаимодействий.
Как известно [447], полная энергия молекулы приближен-
но может быть представлена в виде суммы ее составляющих:
При этом законы квантования распространяются как на
полную энергию молекулы, так и на энергию ее компонентов.
Величина W представляет энергию взаимодействия составля-
ющих (энергия электронных, колебательных и вращательных
взаимодействий).
Если теперь обратится к клетке, то величина E войдет в
величину полной энергии клетки, но добавится энергия, обу-
словленная слабыми взаимодействиями. В результате энер-
гия структур, образованных с участием валентных связей,
остается практически неизменной (если не считать поступа-
ющих из окружающей среды питательных веществ). Следо-
вательно, живое состояние и его динамика, зависят, в первую
очередь, от изменений энергии слабых взаимодействий и их
динамики.
В результате, изменения энергии Гиббса, складывающие-
ся из флуктуаций величин энтальпийных и энтропийных со-
ставляющих, можно представить следующим образом:
,
318
Живая клетка.indb 318 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-318-320.jpg)
![Гипотетическая качественная модель живой клетки
где вс — водородные и ионные связи; дс — дисперсион-
ные связи и слабые S–S-связи; пс — полярные и вандер-
ваальсовые связи; гф — гидрофобные взаимодействия;
кпз — комплексы с переносом заряда; кки — конформационно-
конфигурационные изменения.
Конформационные изменения ведут к появлению мно-
жественных микросостояний и к увеличению энтропии, рас-
считываемой по формуле Больцмана, приведенной в главе 2
(четвертый постулат).
Когда клетка «живет», любые математические расчеты но-
сят сугубо приближенный характер, даже если эти расчеты
выполняются для тех или иных изолированных систем. Нуж-
но не забывать гипотезы Э. Шредингера [27] о статистическом
характере процессов, совершающихся в живых системах.
К глубокому сожалению, этот вывод Шредингера остался
мало замеченным и не обоснован дальнейшими исследова-
ниями. Все внимание было сосредоточено на представлении
Шредингера о живых структурах как о «апериодических кри-
сталлах», что справедливо для отдельных клеточных образо-
ваний, функционирующих внутри клетки, но не для целост-
ной структуры клетки.
Очень важно учитывать, что в процессе возникновения
и функционирования клетки образуются ассоциаты либо в
виде определенных блоков (надмолекулярных образований)
(см. второй постулат), либо в виде короткоживущих комплек-
сов, обладающих теми или иными свойствами. Возникающие
образования могут нести в себе свойства жидкости или твер-
дого тела — кристалла. И в том, и в другом случае ведущая
роль принадлежит водородным связям.
Если имеет место жидкая фаза, водородные связи непре-
рывно разрываются и вновь возникают, не фиксируя опре-
деленного расположения молекул друг относительно друга.
В кристалле те же водородные связи обеспечивают стерео-
химическое расположение структурных компонентов клет-
ки [448].
319
Живая клетка.indb 319 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-319-320.jpg)
![Гипотетическая качественная модель живой клетки
Что же можно считать основным свойством живых
структур? Несомненно, это способность к самоорганизации
белков, нуклеиновых кислот, липидов и углеводов. В резуль-
тате этих процессов возникают клеточные органеллы, пере-
численные ранее. Мощнейшим фактором, определяющим
стереонаправленность процессов возникновения внутри-
клеточных образований, является асимметрия только что
упомянутых соединений. Напоминаем, что молекулы амино-
кислот относятся к L-ряду, а углеводов – к D-ряду. Если в мо-
лекуле имеется асимметрический (хиральный) атом углеро-
да, то участие рацематов в построении структур полностью
исключается. Игнорирование этого феномена при вовлече-
нии рацемических питательных, лекарственных, ароматизи-
рующих и т. д. веществ неизбежно приводит к катастрофи-
ческим последствиям, что обстоятельно освещено в работе
В. А. Твердислова и В. В. Сидоровой [456], которые пишут:
«Масштаб опасности «хирального загрязнения» переоценить
трудно. Изомерные соединения могут стимулировать рост
заболеваемости в различных регионах, в том числе далеких
от зон эмиссии». Они считают, что в ближайшие десятилетия
опасность «хиральной беспечности» может приобрести гло-
бальный характер. Нельзя не согласиться с ними в том, что
человечество должно упредить эту опасность.
По мере развития инструментальных физико-химических
методов, взгляды на кажущуюся однородность цитоплазмы
(такие взгляды были приняты при использовании классиче-
ской световой микроскопии) постоянно изменяются в связи с
обнаружением все новых и новых структурных образований.
Так или иначе именно структура определяет функцию, но
мы уже видели, что функционирование клеточных структур
ведет к образованию компонентов, изменяющих саму струк-
туру. Знаменитый парадокс «курицы и яйца» в живой клетке
заключается в кажущемся парадоксе структура ↔ функция.
Однако в живой клетке имеет место синхронность этих двух
составляющих.
320
Живая клетка.indb 320 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-320-320.jpg)



![Гипотетическая качественная модель живой клетки
клетки. Изменение этой структуры немедленно будет вести
к изменению функциональных свойств метаболизирующих
систем, направленных на получение веществ, устраняющих
возникающее отклонение. Это может быть достигнуто только
в том случае, если все противоположно направленные про-
цессы будут строго координированы.
2. Все живые организмы при своей жизнедеятельности в
обязательном порядке чередуют периоды активности с пе-
риодами покоя.
Известному врачу-физиологу А. С. Залманову ([467],
с. 49–71), при освещении вопросов, связанных с описанием
причинных связей при физиологических прявлениях в чело-
веческом организме, пришлось выделить в отдельный раздел
изложение причин и течений этих проявлений под названи-
ем «Усталость». Согласно его взглядам, если усталость орга-
низме не будет сменена покоем, неминуема гибель живого
организма.
Как мы знаем, активность клетки непременно сопрово-
ждается некоторым разупорядочеванием ее структурных
компонентов, что ведет к переходу молекул, составляющих
основу живой клетки, в возбужденное состояние с повышен-
ным уровнем свободной энергии Гиббса. Если клетка не смо-
жет вернутся в исходное упорядоченное состояние с мини-
мальной величиной энергии, наступит ее перевозбуждение
и она погибнет.
3. Живые организмы не всегда в состоянии устранить те
или иные нарушения, возникающие, как правило, в резуль-
тате экстремальных воздействий окружающей среды. Мы
пытаемся помочь организму устранить эти нарушения, при-
меняя те или иные лекарственные вещества. Но, так как (со-
гласно модели) любое лекарство, имеющее в своем составе те
же лабильные системы (например, π,π- и n,π-сопряженные
группировки), а в клетке имеют место статистически согла-
сованные сети химических реакций, неизбежны сбои этой
согласованности. В случае если это касается нервных клеток,
324
Живая клетка.indb 324 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-324-320.jpg)
![Гипотетическая качественная модель живой клетки
возникает боль, которую мы (опять же с помощью лекарств)
снова пытаемся устранить. К сожалению, это процесс иногда
приводит к гибели организма.
Не считаясь с этим фактом, человечество, научив-
шись создавать новые лекарственные препараты, увле-
клось сначала тем, что получали их из природных источни-
ков, а затем — с помощью оргсинтеза. К чему это привело,
можно узнать из труда О. А. Мазура ([468], с. 7): «По под-
счетам специалистов в XVII–XVIII вв. за каждые 20 лет в
мире появлялось в среднем одно новое эффективное ле-
карство за 2 года. В конце XIX в. появлялось 3 лекарства
за 2 года. В конце XX столетия на нашей планете создавалось
8–10 принципиально новых лекарственных средства... Неко-
торые специалисты приводят еще более устрашающие меня
как врача-натуропата цифры, подчеркивающие неудержи-
мый рост числа лекарственных веществ потребляемых со-
временным человечеством. Они пишут, что в 30-х гг. XX в.
в мире применялось около 30 000 медикаментов, а к 70 гг. их
насчитывалось свыше 200 000.
Статистические данные говорят что современное чело-
вечество за один год принимает миллионы тонн различных
лекарственных химиопрепаратов. В США, например, населе-
ние принимает только аспирина 20–30 тонн в день т. е. более
10 000 000 килограмм в год.»
Комментарии к этому излишни. Ну а результат? Обратим-
ся снова к трудам А. С. Залманова ([469], с. 187). Вот что он
пишет:
«В США, где специализация врачей дошла до крайнего
предела, где беспрестанно растет количество новых меди-
каментов, где хирурги заменяют органы искусственными
субстанциями, президент академии питания в Нью-Йорке
М. К. Мартин опубликовал отчет о количестве больных
за 1958 г.
Вот эти цифры: 20 миллионов людей с аллергическими за-
болеваниями, 300 000 слепых, 1 миллион больных глаукомой,
325
Живая клетка.indb 325 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-325-320.jpg)

![Гл а в а 9
Возникновение живой клетки
В главе 1 мы постулировали, что клетка является эле-
ментарной единицей живой субстанции. Следовательно,
вопрос о происхождении или возникновении живой клетки
связан с проблемой возникновения жизни вообще.
Почему мы должны хотя бы кратко осветить этот вопрос?
Дело в том, что нельзя принять ту или иную точку зре-
ния, объясняющую построение и функционирование жи-
вых структур, и не ответить на вопрос: как эти структуры
возникли.
В предисловии мы уже отмечали, что в истории науки нет
более дискуссионной проблемы, чем проблема возникнове-
ния жизни.
Ожесточенные споры и дискуссии между разными пред-
ставителями общества часто плачевно заканчивались для
тех, кто отстаивал точку зрения, отличавшуюся от таковой
господствующей в то время политической прослойки.
Недавно вышел обширный обзор Т. Г. Грушевицкой и
А. П. Садохина [450], в котором подведен итог многовеко-
вых споров о проблеме происхождения жизни. Они пишут
(с. 445): «Попытки решить этот важнейший вопрос предпри-
нимались философами и учеными на протяжении многих ве-
ков. Своими корнями они уходят в эпоху античности. С тех
пор прошло более двух с половиной тысяч лет, но в биологии
существует лишь шесть концепций, объясняющих происхо-
ждение жизни:
327
Живая клетка.indb 327 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-327-320.jpg)
![Возникновение живой клетки
• креационизм — сотворение жизни Богом;
• концепция стационарного состояния — идея вечно-
сти жизни;
• концепция многократного зарождения живого из не-
живого;
• концепция панспермии — возникновение жизни из
космоса;
• случайное однократное происхождение жизни;
• закономерное происхождение жизни путем химиче-
ской эволюции».
Авторы далее признают, что креационизм имеет наибо-
лее длительную историю и продолжает привлекать внимание
множества сторонников, в том числе и ученых. В то же вре-
мя противники концепции заявляют, что креационизм анти-
научен.
Однако это противостояние, длившееся веками между
наукой и религией, сейчас постепенно сглаживается. Соглас-
но взглядам знаменитого хирурга, ученого с мировым именем
В. Ф. Войно-Ясенецкого (Святителя Луки) [451] противоре-
чий между этими двумя сторонами человеческого познания
вообще не должно быть, так как они касаются разных сторон
окружающего нас мира.
Сопоставлять или противопоставлять их, по меньшей
мере, некорректно. Религиозные представления основаны на
вере. Наука же базируется на фактах и явлениях, наблюдае-
мых визуально или с помощью тех или иных приборов.
Столкновения и противоречия между наукой и религией
всегда имели место только тогда, когда заходила речь о про-
исхождении всего сущего, в том числе, живой субстанции.
Чуть позже постараемся понять, можно ли, руководствуясь
научными данными, опровергнуть утверждения Символа
Веры о Творце, заменив их незыблемыми законами, откры-
тыми наукой.
Что касается следующих четырех концепций, то Груше-
вицкая и Садохин [450] достаточно убедительно обосновали
328
Живая клетка.indb 328 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-328-320.jpg)
![Возникновение живой клетки
их неправдоподобность, и нам нет необходимости повторять
их аргументы. Но на последней концепции о биохимической
эволюции, по-видимому, следует остановиться более подроб-
но, тем более что эта концепция является общепринятой.
Сейчас уже можно считать доказанным, что органические
соединения, даже такие, как аминокислоты, липиды, углево-
ды и нуклеотиды могут быть образованы под действием фи-
зических факторов, имеющих место в первичных условиях
Земли: радиация, электрические разряды, высокая темпера-
тура, отсутствие кислорода в атмосфере и т. д.
Не оспаривая этих данных и представлений, обратим
внимание на принципиальные отличия смесей органических
веществ, возникающих под действием вышеупомянутых фи-
зических факторов, от тех же веществ, выделяемых из объек-
тов биологического происхождения. На рис. 92 (1, 2) и рис. 93
(1, 2) приведены газовые хроматограммы суммарных соеди-
нений, получаемых из различных смесей.
1 2
Рис. 92. Газовые хроматограммы гексановых фракций из сланца Поси-
доний (1) и продуктов разряда в метане (2) ([34], с. 98).
Легко увидеть, что никакой избирательности и специфич-
ности в образовании этих соединений под действием физи-
ческих и химических факторов нет и в помине и, конечно, не
может быть. Для того, чтобы из таких смесей избиратель-
но возникли вещества, присутствующие в объектах биоло-
гического происхождения, действительно, нужна эволюция,
329
Живая клетка.indb 329 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-329-320.jpg)
![Возникновение живой клетки
направленная на достижение определенной цели, которой
нет у физико-химических систем.
1 2
Рис. 93. Газовые хроматограммы углеводородной фракции, полученной
при действии соляной кислоты на карбид железа (1) и алкановой фрак-
ции, выделенной из сине-зеленой водоросли Nostoc (2) ([34], с. 52,53).
В таком случае авторы, используя эволюционный процесс
для объяснения этого феномена, идут на привлечение раз-
личного вида домыслов или просто замалчивают решение
данной проблемы.
Особенно трудно представить себе, как самопроизвольно
протекающие химические (синтетические) процессы приве-
дут к образованию асимметрических (хирально чистых) мо-
лекул аминокислот, нуклеотидов и нуклеозидов, углеводов,
гормонов, витаминов и т. д. Л. В. Яковенко и В. А. Тверди-
слов [452] попытались решить эту задачу, предложив гипо-
тезу, согласно которой предшественники клеток возникли в
поверхностном слое мирового океана. По их мнению, эта по-
верхность неравновесна и, кроме того, распределение ионов
(K+, Na+, Ca++) в ней асимметрично.
Эта же асимметрия наблюдается и тогда, когда в водной
среде оказываются рацематы биологически активных соеди-
нений. Яковенко и Твердислов экспериментально, в лабо-
раторных условиях, обнаружили, что микробрызги водных
растворов глутамина и лейцина обогащаются соответствую-
330
Живая клетка.indb 330 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-330-320.jpg)
![Возникновение живой клетки
щими L-энантиомерами на 5–10%. Такое обогащение вполне
достаточно, чтобы была достигнута, по их мнению, 100% хи-
ральная чистота.
Однако, во-первых, концентрация аминокислот (10 г/л),
взятая в их опытах, практически недостижима в естествен-
ных условиях, когда аминокислоты возникают спонтанно под
действием химических и физических факторов. Во-вторых,
абсолютно неясно, как поведут себя эти и другие аминокис-
лоты, когда они будут присутствовать в составе смесей, со-
стоящих из сотен и даже тысяч компонентов, концентрация
каждого из которых составляет тысячные или миллионные
доли процента, а ведь хиральная чистота наблюдается у всех
компонентов живой клетки. В-третьих, нет ответа на вопрос,
каким образом закрепляется достигнутая хиральная избира-
тельность на промежуточных этапах. И, наконец, совсем не
понятно, как поведут себя осевшие брызги, когда океан успо-
коится, ведь второй антипод остается здесь же в растворе.
В конечном счете, в статье цитируемых авторов так много
допущений и домыслов, что статья может служить образцом
обоснования самой невероятной и нереальной гипотезы.
Оставим на совести авторов их гипотезу и перейдем к
другим вопросам предбиологической эволюции, которую
М. Эйген [457, 460] и М. Кальвин [34] обозначили как «хими-
ческую эволюцию». Но возможна ли «химическая эволюция»,
постулируемая или предполагаемая многими авторами [2, 34,
453–462]?
Наиболее обстоятельно и подробно эта проблема изложе-
на в монографии К. Б. Серебровской [455]. Обобщив все име-
ющиеся на то время факты и гипотезы о «химической эво-
люции», якобы предшествовавшей биологической, она, как
и все другие авторы, довольствуется бытующими утвержде-
ниями, не пытаясь вдуматься в сам процесс эволюции, в зако-
ны, управляющие этим процессом. В результате не является
неожиданным вывод, к которому она приходит ([455], с. 173):
«Можно предполагать, что существует какой-то минимум
331
Живая клетка.indb 331 27.10.2009 11:40:17](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-331-320.jpg)
![Возникновение живой клетки
реакций, сопряжение которых приводит к возникновению
такой взаимозависимости (идет речь о взаимозависимости
структуры и функции — прим. автора). Появление ее и обу-
славливает возникновение живого состояния с определен-
ным минимумом атрибутов живого.
Следовательно, живое возникло не единожды, а станов-
ление его, т. е. накопление в большем количестве атрибутов
живого происходило как в период перехода химической эво-
люции в биологическую, так и в ходе всей биологической эво-
люции».
И эти выводы сделаны в начале 70-х гг. XX в., когда уже в
полный голос говорили о потрясающих успехах молекуляр-
ной биологии. А Серебровская доказывает, что живое воз-
никло многократно, накапливая все в большем количестве
«атрибуты живого». Как сохранялись эти атрибуты, можно
только догадываться. Никаких доказательств у этого автора
нет. Вряд ли есть какой-либо смысл во всех этих рассужде-
ниях.
Очевидно, что для осуществления любого процесса, ко-
торый должен привести к определенному заранее заданному
результату, нужна направленность этого процесса, которая
может возникнуть лишь тогда, когда кем-то будет поставлена
соответствующая цель.
Допустим, имело место (хотя это имеет исчезающе ма-
лую вероятность) самопроизвольное возникновение сме-
си веществ, необходимых протоклетке (см. работу Д. Грина
и Р. Гольдбергера [89]). Естественно, эти вещества составят
химическую равновесную систему. Спасет ли положение не-
равновесность, возникающая и исчезающая в поверхностном
слое океанической воды (см. [452])? Вряд ли. Снова повто-
римся, что для начала процесса нужна цель, а ее у химических
систем нет и не может быть. Известный принцип Ле-Шателье
требует от химической системы, чтобы она сохраняла равно-
весное состояние. Однако мы уже видели, что равновесие
смертельно для живой клетки.
332
Живая клетка.indb 332 27.10.2009 11:40:18](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-332-320.jpg)
![Возникновение живой клетки
В конечном счете хотим мы этого или нет, следует согла-
ситься с тем, что живая клетка не могла возникнуть самопро-
извольно из неживой материи в результате несуществующей
«химической эволюции». Сторонникам эволюционного воз-
никновения живой клетки следует признать, что их представ-
ления об эволюционном происхождении живого базируются
на их собственной вере, но не в Творца, а в несуществующую
«эволюцию».
Если мы теперь постараемся вникнуть в смысл десятого
постулата, который обозначен нами как качественная мо-
дель живой клетки, то сразу бросается в глаза взаимосвязь и
взаимозависимость всех свойств структурных компонентов
клетки. Только целостная структура клетки, построенная по
изложенным принципам, может быть живой.
Отсутствие или исчезновение, казалось бы, незначитель-
ного элемента в структуре клетки будет приводить неизбеж-
но к ее гибели. Без участия Творца, который создал именно
такое построение и вдохнул бы жизнь в это создание, не-
возможно представить и обосновать возникновение живой
клетки.
А что же думают биологи на этот счет? К середине XX
в., можно сказать, эволюционная гипотеза стала в науке го-
сподствующей. Наверное, самым лучшим подтверждением
этого тезиса является учебник Ф. Н. Правдина [465] под на-
званием «Дарвинизм», в котором автор излагает историю
учения Ч. Дарвина и обосновывает его эволюционное учение.
В целом эволюционную теорию биологи стали рассматривать
как мерило научности: эволюция не признается — значит
ненаучно. Однако появившиеся в последнее время работы
С. Ю. Вертьянова [463, 464] пробили брешь в этих представ-
лениях. Он убедительно доказывает (уже с точки зрения био-
лога), что эволюция не существует и в вопросе происхожде-
ния жизни отводит роль Творцу.
О Творце пишет и действительный член Академии наук
РФ профессор Ю. П. Алтухов в предисловии к учебнику по
333
Живая клетка.indb 333 27.10.2009 11:40:18](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-333-320.jpg)
![Возникновение живой клетки
биологии Вертьянова ([464], с. 3). Единственное, что не сле-
довало бы делать автору — это рассуждать о Плане, которым
якобы руководствовался Творец, создавая живую субстан-
цию. Был ли План или не был, вряд ли мы полномочны су-
дить. Оставим это Творцу.
Снова обратимся к десятому постулату главы 8. Все на-
правлено на то, чтобы живая клетка обладала неискоренимой
живучестью при абсолютном соответствии и исполнении
всех фундаментальных физических и химических законов.
Эта живучесть заложена в самом построении живой струк-
туры. Благодаря тому, что полимерные молекулы основного
компонента клетки (белка) могут принимать неисчислимое
множество микросостояний как за счет конформационно-
конфигурационных переходов, так и за счет возможности
образования комплексов с различными мономерными моле-
кулами (углеводами, липидами, витаминами, гормонами, ка-
тионами металлов, анионами и т. д.), созданы предпосылки
для внутриклеточного исполнения незыблемого всекосмиче-
ского закона о стремлении всех систем к наиболее вероятно-
му состоянию, согласно закону Больцмана.
В живую клетку гениально вложено, с одной стороны,
стремление к упорядоченному расположению плотно упако-
ванных структур с минимальной свободной энергией Гиббса,
с другой стороны, флуктуации микросостояний белковых
молекул обеспечивают максимальную величину энтропий-
ной составляющей этой энергии.
Не менее захватывающую картину мы наблюдаем, когда
рассматриваем соотношение структуры и функции в живой
клетке. Известно, что ни одна неживая система не обладает
способностью синхронного изменения этих свойств. Измене-
ние живой структуры не может не сопровождаться функцио-
нальным переходом и в то же время функциональный сдвиг
неизбежно ведет к перестройке структуры. Следует учесть,
что эти переходы осуществляются в миллиардные доли
секунды.
334
Живая клетка.indb 334 27.10.2009 11:40:18](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-334-320.jpg)



![Заключение
шего уточнения по мере накопления новых данных, которые
неизбежно будут получаться исследователями, базирующи-
мися на представлении о целостной структуре и о едином со
структурой функциональном состоянии живой клетки.
В каком же направлении, с нашей точки зрения, должны
проводиться дальнейшие исследования живых систем, в том
числе (или главным образом) живых клеток?
По-видимому, используя появившиеся в последнее время
возможности исследования процессов, происходящих в мил-
лиардно- и даже фелитосекундных диапазонах, необходимо
продолжить изучение белков и их комплексов с другими сое-
динениями. При этом структурные и функциональные свой-
ства этих комплексов следует изучать одновременно.
Нецелесообразно ограничиваться изучением свойств вы-
сокоочищенных белков. Следует помнить, что чем чище бе-
лок, тем он дальше отстоит от живого состояния.
Очень заманчивыми представляются методики изучения
отдельных одиночных клеток, хотя не ко всем клеткам они
применимы. Однако, несомненно, такие методики исследова-
ния весьма перспективны.
Мы должны помнить, что главной задачей современной
науки является предотвращение страданий людей от болез-
ней, которые неизбежно будут возникать при игнорирова-
нии вредных факторов, воздействующий на живую клетку.
Поэтому необходимо правильное отношение к построению
живых структур, вложенных в клетку Творцом, вдохнувшим
в нее жизнь.
Литература, касающаяся этого вопроса, весьма обширна.
Мы не будем давать ее полный обзор. Ограничимся ссылкой
на одно издание, с нашей точки зрения, просто и убедительно
помогающее понять то, от чего люди науки сознательно отво-
рачивались многие десятилетия, — от проблемы сотворения
живого мира.
А. В. Фомин [470] составил подробный перечень представ-
лений ученых разных времен, доказывающих невозможность
338
Живая клетка.indb 338 27.10.2009 11:40:18](https://image.slidesharecdn.com/cell-report-110914103501-phpapp01/85/Cell-report-338-320.jpg)





























