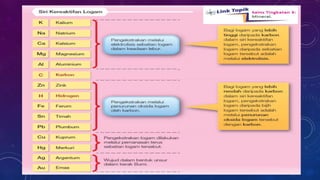
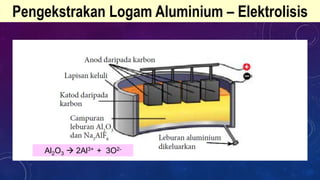
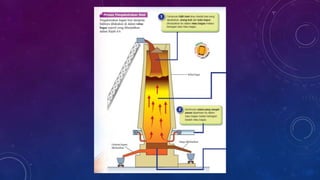
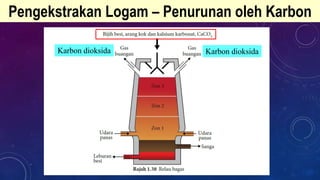
Dokumen ini membahas tentang penulisan persamaan kimia seimbang untuk berbagai reaksi dan proses pengekstrakan logam, termasuk teknik elektrolisis dan penurunan oleh karbon. Pengekstrakan logam reaktif seperti aluminium dan ferum dibahas dengan fokus pada dampak lingkungan dari proses tersebut. Proses pengekstrakan ditentukan oleh posisi logam dalam siri kereaktifan, dengan contoh reaksi kimia dan tantangan seperti penggunaan tenaga tinggi dan pencemaran.