Wegl 7
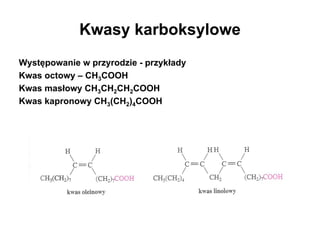
- 1. Kwasy karboksylowe Występowanie w przyrodzie - przykłady Kwas octowy – CH3COOH Kwas masłowy CH3CH2CH2COOH Kwas kapronowy CH3(CH2)4COOH
- 2. Nazewnictwo kwasów karboksylowych Dwa systemy nazewnictwa 1. Kwasy, pochodne alkanów o otwartych łańcuchach – nazwy tworzone poprzez dodanie nazwy kwas i zmianę końcówki nazwy alkanu z –an na –owy. Atom węgla grupy karboksylowej zyskuje nr C1
- 3. Nazewnictwo kwasów karboksylowych cd. 2. Dotyczy głównie kwasów, w których grupa karboksylowa przyłączona jest do pierścienia. Do nazwy systematycznej związku dodaje się słowa kwas … karboksylowy. W tym systemie atom węgla, do którego przyłączona jest grupa karboksylowa oznaczany jest jako C1 COOH Br kwas 3-bromocykloheksanokarboksylowy COOH kwas 1-cyklopentenokarboksylowy
- 4. Nazewnictwo kwasów karboksylowych - przykłady a) CH3 CH CH2 OH COOH 1234 αβγ syst.: kwas 3-hydroksybutanowy (zwycz.: β-hydroksymasłowy) CH2 CH COOH kwas propenowy (kwas akrylowy) b) c) CH2 C COOH CH3 kwas 2-metylopropenowy (kwas metakrylowy) d) COOH kwas cyklopentano- karboksylowy e) COOH kwas naftaleno-1-karboksylowy (kwas α-naftoesowy) f) COOH OH kwas 2-hydroksybenzoesowy (kwas salicylowy) g) CH3 CH2 CH COOH CH2 COOH 1 2 3 4 kwas 2-etylobutanodiowy (kwas etylobursztynowy) h) C C H COOH H COOH kwas but-2-enodiowy (kwas maleinowy) i) H2C C COOHHO H2C COOH COOH kwas 2-hydroksypropano- 1,2,3-trikarboksylowy (kwas cytrynowy) j) CH3 CH COOH OH kwas 2-hydroksypropanowy (kwas mlekowy)
- 5. Struktura kwasów karboksylowych Atom węgla grupy karboksylowej ma hybrydyzację sp2 – z tego powodu grupa ta wykazuje strukturę płaską a kąty pomiędzy wiązaniami mają po około 120o sp2 nukleofilowy atom tlenu R C O O H l l l l kwaśny proton odrywany przez zasady a) Z R C O O l l l l l R C O O l l l l l anion karboksylanowy stabilizowany przez rezonans b) R C O O H RC O OH l l l l ll l l Tak jak w przypadku alkoholi kwasy karboksylowe tworzą wiązania wodorowe. Większość kwasów karboksylowych występuje w postaci cyklicznych dimerów, przez co ich temperatury wrzenia są jeszcze wyższe niż odpowiednich alkoholi
- 6. Metody otrzymywania kwasów karboksylowych a) CH3 CH2 CH2 CH2 OH KMnO4 CH3 CH2 CH2 COOH CH3 CH2 CH2 CHO butan-1-ol kwas masłowy butanal b) CH2 Br -NaBr Na CN bromek benzylu CH2 C N fenyloacetonitryl (cyjanek benzylu) H2O, NaOH CH2 COO Na NH3 fenylooctan sodu c) 1o Br 2o ale: Na CN -NaBr C N nieefektywne! bromek cykloheksylu cyjanek cykloheksylu cyklokeksen 20 % 80 % CH3 CCH3 CH3 Br Mg / Et2O CH3 CCH3 CH3 MgBr CO2 CH3 CCH3 CH3 C O OMgBr H3O CH3 CCH3 CH3 C O OH bromek tert-butylu bromek 2,2-dimetylo- propanian magnezu kwas 2,2-dimetylo- propanowy
- 7. Dysocjacja kwasów karboksylowych Kwasy karboksylowe reagują z zasadami; przykład reakcja z wodorotlenkiem sodu lub wodorowęglanem sodu a) CH3 C O OH NaOH H2OCH3 C O O Na kwas octowy octan sodu b) CH3 CH COOH CH3 2 Mg CH3 CH COO 2Mg CH3 H2 kwas 2-metylopropanowy (kwas izomasłowy) 2-metylopropanian magnezu (izomaślan magnezu) c) COOH KHCO3 COO K H2O CO3 kwas benzoesowy benzoesan potasu d) CH2 COOH NH3 CH2 COO NH4 kwas fenylooctowy fenylooctan amonu e) CH3COO K HCl CH3COOH KCl mocniejszy kwas słabszy kwas
- 8. Kwasowość – porównanie kwasowości alkoholi i kwasów karboksylowych Dla większości kwasów karboksylowych Ka ma wartość około 10-5 Pytanie: jaki jest powód zdecydowanie bardziej kwasowych właściwości kwasów karboksylowych niż alkoholi? Odpowiedź - REZONANS
- 9. Wpływ podstawienia na kwasowość Dysocjacja kwasu jest reakcją odwracalną Każdy czynnik sprzyjający stabilizowaniu struktury jonu karboksylanowego będzie sprzyjał przesunięciu równowagi reakcji w stronę formy zdysocjowanej, a co za tym idzie zwiększał moc kwasu Każdy czynnik destabilizujący anion karboksylanowy będzie zmniejszał kwasowość związku Grupy wyciągające elektrony, przyłączone do atomu węgla grupy karboksylowej stabilizują anion zwiększając moc kwasu Grupy dostarczające elektrony zmniejszają kwasowość
- 10. Względna moc kwasów chlorooctowych Przykład – różnice w kwasowości kwasu octowego i jego chloropochodnych Efekt indukcyjny maleje ze wzrostem odległości podstawnika od grupy karboksylowej – przykład chloropodstawione kwasy butanowe
- 11. Wpływ podstawników na pochodne kwasu benzoesowego Grupy dezaktywujące pierścień aromatyczny w reakcji substytucji elektrofilowej zwiększają moc kwasu Grupy aktywujące (podstawniki 1szego rodzaju) zmniejszają moc kwasu destabilizując anion karboksylanowy
- 13. Redukcja kwasów karboksylowych Kwasy karboksylowe ulegają redukcji za pomocą LiAlH4 – produktem są pierwszorzędowe alkohole. Kwasy nie ulegają redukcji pod wpływem NaBH4. Często stosuje się do redukcji kwasów karboksylowych boran w tetrahydrofuranie.
- 14. Względna reaktywność pochodnych kwasów karboksylowych
- 15. Substytucja nukleofilowa grupy acylowej – reakcje kwasów karboksylowych
- 17. Przekształcanie kwasów karboksylowych w bezwodniki kwasowe Przekształcanie kwasów monokarboksylowych w bezwodniki jest trudne – używany jest w zasadzie bezwodnik octowy oraz cykliczne bezwodniki kwasowe tworzone poprzez dehydratację dikwasów
- 18. Reakcje tworzenia estrów Mechanizm estryfikacja Fischera: COOH CH3OH kat. H COOCH3 H2O hanizm: C O OH mec Ph l l ll H Ph C OH OHl ll Ph C OH OHl ll l HO CH3 ll Ph C OH OH OHCH3 l l ll l -H2O Ph C OH OH H OCH3 l l l l l l l l Ph C OH O CH3 l Ph C OH O CH3l ll -H Ph C O O CH3 l l ll ester metylowy kwasu benzoesowego (benzoesan metylu)
- 19. Tworzenie estrów - przykłady
- 20. Tworzenie amidów
- 21. Reakcja Hella-Volharda-Zielińskiego (HVZ) – bromowanie kwasów karboksylowych w pozycji alfa
- 22. Kwasy tłuszczowe
- 23. Tłuszcze – budowa, hydroliza, zmydlanie H2C HC O H2C O O C O R1 C O R2 C O R3 R1 , R2 , R3 - reszty pochodzące od kwasów tłuszczowych, np CH3(CH2)12 mirystynowego CH3(CH2)16 stearynowego CH(CH2)7CH3(CH2)7CH oleinowego część kwasowa część alkoholowa gliceryny wiązania estrowe O OH kwas oktadekanowy (stearynowy, C17H35COOH) kwas (9Z,12Z)-oktadeka-9,12-dienowy (linolowy, C17H31COOH) 9 12 O OH Z Z H2C HC O H2C O O C O R C O R C O R gliceryd NaOH, H2O H2C HC OH H2C OH OH gliceryna R COO Na3 mydło sodowe (np. stearynian sodu, gdy R = CH3(CH2)16-
- 24. Działanie mydeł i detergentów Na Na Na Na Na Na Na Na Na Na Na Na H2O H2O H2O H2OH2O H2O H2O H2O H2O H2O palmitynian sodu: hydrofobowy ogon hydrofilowa głowa COO-Na+ 4-dodecylobenzenosulfonian sodu: SO3 -Na+ O SO3 - Na+ siarczan(VI) dodecylu sodu (laurylosiarczan sodu):
- 25. Fosfolipidy
- 26. Woski Woski – mieszaniny estrów długołańcuchowych kwasów tłuszczowych i długołańcuchowych alkoholi. Kwas karboksylowy – parzysta zazwyczaj liczba atomów węgla w cząsteczce (16-36), zwykle również parzysta liczba atomów węgla w części alkoholowej (24-36). Przykład: C O O wiązanie estrowe część alkoholowa triakontan-1-olu: HO-(CH2)29CH3część kwasu palmitynowego: CH3(CH2)14COOH
