Recommended
PDF
Storytelling For The Web: Integrate Storytelling in your Design Process
PDF
2024 Trend Updates: What Really Works In SEO & Content Marketing
PPT
PPTX
Wharton Dance Studio Info Session 9/17/12
DOC
PPT
PPTX
DOCX
PDF
Artificial Intelligence, Data and Competition – SCHREPEL – June 2024 OECD dis...
PDF
How to Leverage AI to Boost Employee Wellness - Lydia Di Francesco - SocialHR...
PDF
2024 State of Marketing Report – by Hubspot
PDF
Everything You Need To Know About ChatGPT
PDF
Product Design Trends in 2024 | Teenage Engineerings
PDF
How Race, Age and Gender Shape Attitudes Towards Mental Health
PDF
AI Trends in Creative Operations 2024 by Artwork Flow.pdf
PDF
PDF
PEPSICO Presentation to CAGNY Conference Feb 2024
PDF
Content Methodology: A Best Practices Report (Webinar)
PPTX
How to Prepare For a Successful Job Search for 2024
PDF
Social Media Marketing Trends 2024 // The Global Indie Insights
PDF
Trends In Paid Search: Navigating The Digital Landscape In 2024
PDF
5 Public speaking tips from TED - Visualized summary
PDF
ChatGPT and the Future of Work - Clark Boyd
PDF
Getting into the tech field. what next
PDF
Google's Just Not That Into You: Understanding Core Updates & Search Intent
PDF
How to have difficult conversations
PDF
Introduction to Data Science
PDF
Time Management & Productivity - Best Practices
More Related Content
PDF
Storytelling For The Web: Integrate Storytelling in your Design Process
PDF
2024 Trend Updates: What Really Works In SEO & Content Marketing
PPT
PPTX
Wharton Dance Studio Info Session 9/17/12
DOC
PPT
PPTX
DOCX
Featured
PDF
Artificial Intelligence, Data and Competition – SCHREPEL – June 2024 OECD dis...
PDF
How to Leverage AI to Boost Employee Wellness - Lydia Di Francesco - SocialHR...
PDF
2024 State of Marketing Report – by Hubspot
PDF
Everything You Need To Know About ChatGPT
PDF
Product Design Trends in 2024 | Teenage Engineerings
PDF
How Race, Age and Gender Shape Attitudes Towards Mental Health
PDF
AI Trends in Creative Operations 2024 by Artwork Flow.pdf
PDF
PDF
PEPSICO Presentation to CAGNY Conference Feb 2024
PDF
Content Methodology: A Best Practices Report (Webinar)
PPTX
How to Prepare For a Successful Job Search for 2024
PDF
Social Media Marketing Trends 2024 // The Global Indie Insights
PDF
Trends In Paid Search: Navigating The Digital Landscape In 2024
PDF
5 Public speaking tips from TED - Visualized summary
PDF
ChatGPT and the Future of Work - Clark Boyd
PDF
Getting into the tech field. what next
PDF
Google's Just Not That Into You: Understanding Core Updates & Search Intent
PDF
How to have difficult conversations
PDF
Introduction to Data Science
PDF
Time Management & Productivity - Best Practices
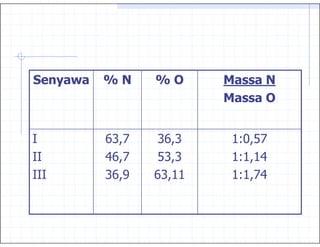
Stoikiometri 2. !
"#$ % ()*
&'
+ ,"+ % -*
&' -
, + "! %
&(.)*
+ " / %
&' 0*
-
+
+ 1 $ " 1# / &(.
% (*
$ "&(&&*
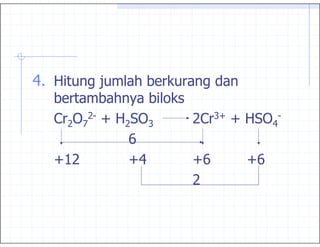
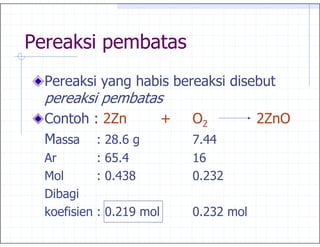
3. 2+ , % 3 3
1
, 45
Hidrogen + Oksigen → Air
6
2g 16 g 18 g
! $ ,
, ,
4. °
Hidrogen +Oksigen → Air ∆H = 12 x10 J
c
6
100 g 900g
E = mc 2
12 x10 = m ( 3 x10
6
)
8 2
12 x106
m= 16
= 1,33 x10−10 kg
9 x10
m = 1,33x10−10 g (kecil sekali)
,, -.
.
5. + ,
2+ , % 3 1
3
% ,45
6
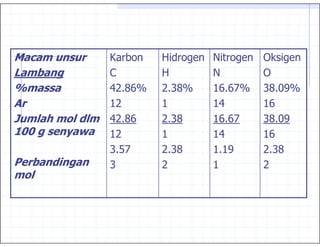
Air mengandung hidrogen 11,19%
1: 8
oksigen 88,81%
6. , +
2 ,
17 % ,
1 %1
17
3 % , 1
45
6
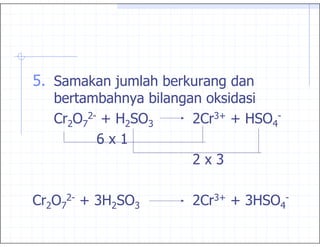
7. :'
)% ):)% & .8
%'
9:'
% 8))% & &%
&9
):-
% : &&
)% & &%9
'
8. +
2;
61
1 6
6% ,
,
6
6 , ,
45
9. 6 karbon + hidrogen → metana
75 g 25 g
karbon + oksigen → karbon monoksida
42,86 g 57,14 g
75
75 g x57,14
42,86
99,99 g
hidrogen + oksigen → air
11,11g 88,89 g
1 : 8
+ 1
' 6
8 08- %-
--
&9
10. 11. +
$
1
( %
1 &%.
.( )88
%
4
12. 1
H 2 + O2 → H 2O
2
↓ ↓ ↓ ↓
biloks 0 0 + 2 -2
1 mol H 2 ≈ 1 mol elektron
1 mol H 2 ≈ 1 ekivalen ∴ massa 1 ekiv H 2 = 1gr
1 mol H 2 = 2 gram
1
mol O2 ≈ 2 ekivalen
2 ∴ massa 1 ekiv O2 = 8 gr
1
mol O2 = 16 gr
2
13. + 1 =
2+ 1
%, $
1 ,
, 1
45
6 Hidrogen + Oksigen → uap air
2 vol 1 vol 2 vol
hidrogen + nitrogen → amonia
3 vol 1 vol 2 vol
14. $
2+ 1 %
$ 1
1
45
6 hidrogen + oksigen → air
2 vol 1 vol 2 vol
2 molekul 1 molekul 2 molekul
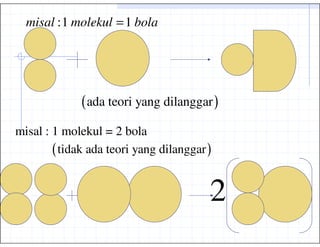
15. misal :1 molekul = 1 bola
( ada teori yang dilanggar )
misal : 1 molekul = 2 bola
( tidak ada teori yang dilanggar )
2
16. !
&4 , 1 ,
4
04
4
)4 ;
17 %,
, 1 4
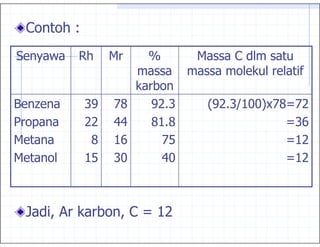
, $
massa molekul relatif = 2 xRapat Uap(Rh )
17. " *
2 &- &
: , ,6 &0
, 45
massa satu atom unsur
Ar =
1
massa satu atom C − 12
12
> %
Ar = massa ekivalen x valensi
18. +
&4 ! , "&(&-*
Ar kira − kira x kalor jenis ≈ 26,8 J
gram.K
atau
Ar kira − kira x kalor jenis ≈ 6,4 kal
gram.K
6
, 1 .09 ?
%
$ )(%
)4 1 , @
19. ;7 27
Ar kira-kira ≈ ≈ 112
0, 24
112
valensi = ≈ 3 (bilangan bulat)
38,3
∴ Ar yang tepat = 3 x 38,3=114,9
04 6 3
3 "&(8(*
2 / A1
, 17
A"/ B *
+
20. 6
17 E 6
3 )- '( -04) "- &. *D (C 0
04)? . ' '
+ , 00 99 (&4( C):
( &: '8 C&0
&8 ). 9. C&0
; % % C &0
6
21. )4 , ,
+
, ,
,
6
:F
- 'F
& ,
)& )&
:E
. 9.E4
F 1 , 60 40
= x69 + x71 = 69.8
100 100
22. massa ( g )
mol =
massa molar (g
mol )
6
G C 9.
G C 9. ?
H 1%& G C 9.
23. ! !
* + + C
=
* + +" C ° + &
.6IC *%$
C 0049 #
6 1 &&4.-
, 7 8 #,
4: +4
@
;7 5.6 L
5.6 L ≈ x1mol = 0.25mol
22.4 L
11.09 g
0.25mol =
massa molar ( g / mol )
11.09
∴ massa molar = = 44 g / mol
0.25
24. " ! !
mol mmol
molar = =
liter mL
6 1
0948 0 9 0# @
;7
24.5 g
mol = = 0.25mol
98 g / mol
0.25mol
CM = = 0.125M
2L
25. ! !
jumlah atom x Ar
% unsur = x 100%
Mr
6
EG G 0 9 " G C 0)I C )0I
C &:*
;7
2 x 23
% Na = x100% = 32.4%
142
26. 17
&4 , ,
/ 17
E ,
1
04 ,
,
27. 6
17
, , %C 04)(EI
6C904(: GC 4: EI C
EI &: ' )(4. E4
-
&: 48
(±.
28. # G
$ 6 G
904(:E 04)(E &: '
4: E )(4. E
-
% &0 & &9 &:
& ! 904(: 04)( &: '
4: )(4.-
'' &0 & &9 &:
)48' 04)( &4&- 04)(
) 0 & 0
!
29. , 6) 0G 0
")D 0D &D 0D * C &: 48
&0J &J &9J &: (±.
0
; % 6: 9G0 9
30. 31. " *
! 17 %
& B BC &
I
17 % I
0 9C .
17 %
I 0 C 0
9
> % I 0 C.
32. " *
> 17
1I 9I
CJ&
, 17 %
J&I 0 9I C 0D C J0
&
, 17 %
04 0 9 I C 9D 0* C (
"
33. 34. 6 ,
&4 ,
6 0 J 6 )J J
0 ' 0 ) 9
04 1
,
60 0 J 6 )J J
' 0 ) 9
J: J9 J) J:
35. )4 1
,
,
6 0 J 06 )J J
0 ' 0 ) 9
J&0 J9 J: J:
36. 94
1
6 0 J 06 )J J
0 ' 0 ) 9
:
J&0 J9 J: J:
0
37. 84
1
6 0 J 0 06 )J J
0 ' ) 9
: D&
0 D)
6 0 J) 06 )J J)
0 ' 0 ) 9
38. :4
J
%
6 0 J) 06 )J J)
0 ' 0 ) 9
0J.C 0 J: L ) C J)
8 J J6 0 J) 06 )J J)
0 ' 0 ) 9
6 0 J) 06 )J J) J8
0 ' 0 ) 9
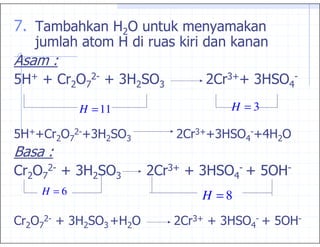
39. '4 0 1
8 J J6 0 J) 06 )JJ )
0 ' 0 ) 9
H = 11 H =3
8 JJ6 0 J) 06 )JJ) J9
0 ' 0 ) 9 0
6 0 J) 06 )J J) J8
0 ' 0 ) 9
H =6 H =8
6 0 J) )J
0 ' 0 )J 0 06 J) 9 J8
40. 41. 6 J J 6
& &
& J C& $
& 6 C& $
& 6 C ):4
8
; % & $ 6 C ):4
8
0 9 0 J J 9
0
& 0
0 J C0 $
& 0 9 C0 $
& 0 9 C- (
; % & $ 0 9 C 9-
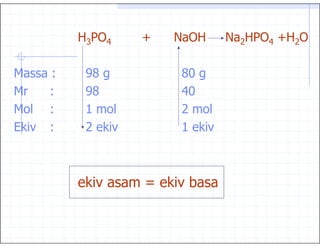
42. )+ 9 J G G 0 +9J 0
-( (.
-( 9.
& 0
$ 0 $ & $
$ C $
43. $
$ 3
1 ,
6 B )J J B 0J
& B )J ≈ & $
$ 3
1 , ,
6 6 6 0J J0
& 6 ≈0
& 6 ≈0 $
44. !
&4; 1 C
1 ,
( J J J8 0J J9
9 0
8B 0J 8B )J J 8
04; $ C
$
.4 $
& 9 C .4
& $B 0J
45. massa 1 mol oksidator
3. massa ekiv oksidator =
jumlah mol elektron yang diterima
=0 8 0=
J&. : J9
=0 8 C &(0
& =0 8 C &(0
& $=0 8 C "&(0?
:*
46. massa 1 mol reduktor
4. massa ekiv reduktor =
jumlah mol elektro yg dilepaskan
B B
. 0 J0
B C 8:
& B C 8:
& $B C "8:?
0*
47. + ,
+ 1
, ,
6 0M J 0 0M
0(4: '499
:849 &:
.49)( .40)0
!
.4
0&- .4
0)0
48. %3 / ,
, , 1
4! M4
; % M C M
C .49)(
M C .49)(":84
9J&:*
C )84:
49. +
massa produk nyata
% hasil = x 100%
massa produk menurut perhitungan
6 60 9 J ) 0 06 0J0 0
)4(: &&4(9
0( )0
.4&)'( .4)'
!
.4
&)'( .4
&0)
50. ; %, , % 0%
,
6 0 C 2 g
x0.37 mol x 44 = 10.85 gram
3 mol
, 6 0 C :4:
-
% 6.96
% hasil = x100% = 64%
10.85