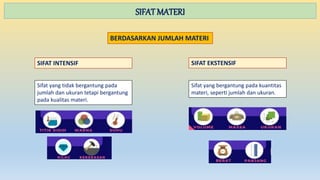
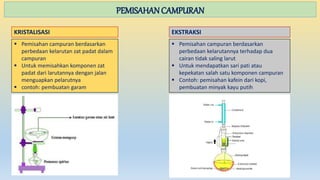
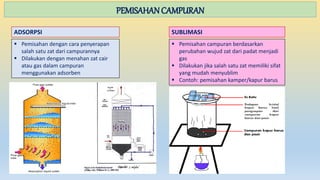
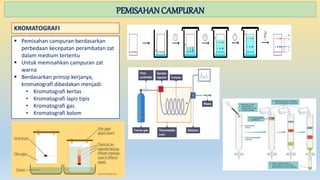
Dokumen ini menjelaskan tentang materi, sifat-sifatnya, dan penggolongannya, termasuk perbedaan antara senyawa dan campuran. Selain itu, juga diuraikan tentang perubahan materi, baik fisika maupun kimia, dan metode pemisahan campuran seperti filtrasi, distilasi, dan kromatografi. Materi dibedakan menjadi unsur, senyawa, dan campuran dengan karakteristik masing-masing.