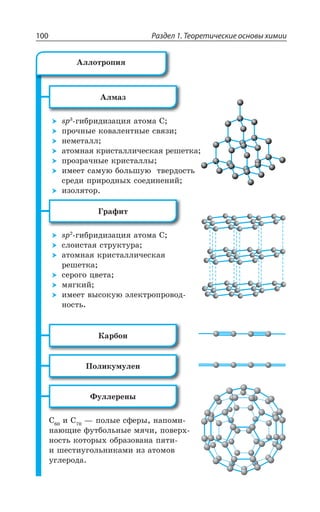
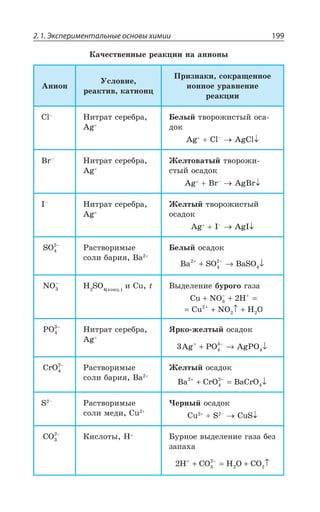
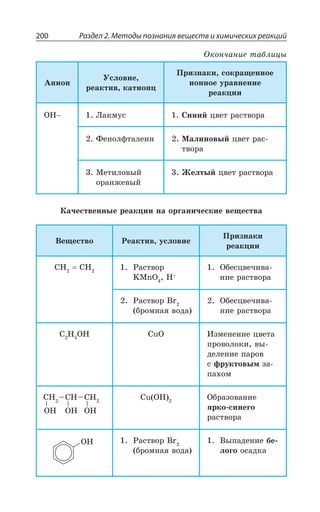
Документ представляет собой научный труд, посвященный основам химии, включая теоретические аспекты, химические элементы, связи и реакции. Он охватывает различные области, такие как неорганическая и органическая химия, и включает в себя ISBN для идентификации. Работа предназначена для углубленного изучения химии и содержит обширное содержание на тему химических процессов.









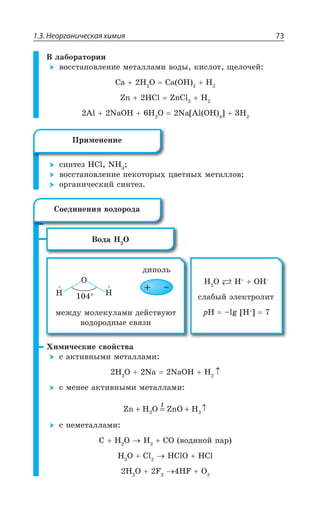
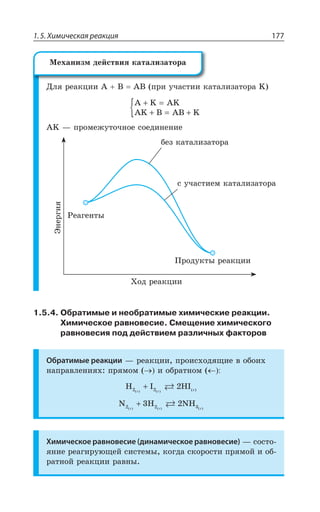
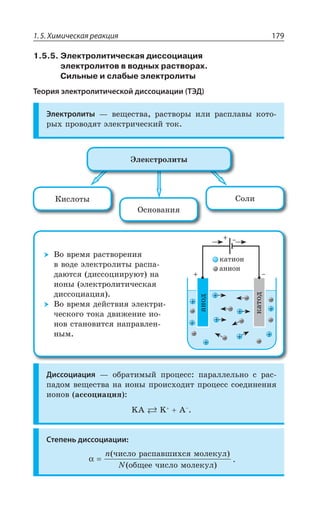
![Раздел 1. Теоретические основы химии26
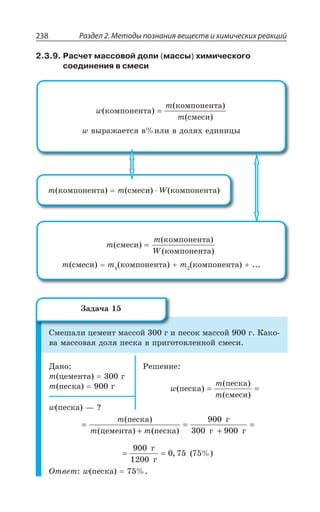
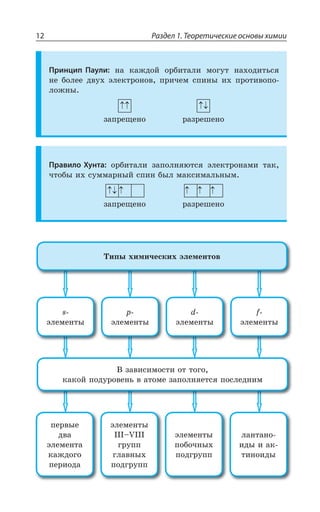
Группы
Периоды а I б а II б а III б а IV б а V б
1
2
3
4
5
6
7
(H)
Li 3
Be 4
B 5
C 6
N 7
Na 11
Mg 12
Al 13
Si 14
P 15
K 19
Ca 20 21
Sc 22
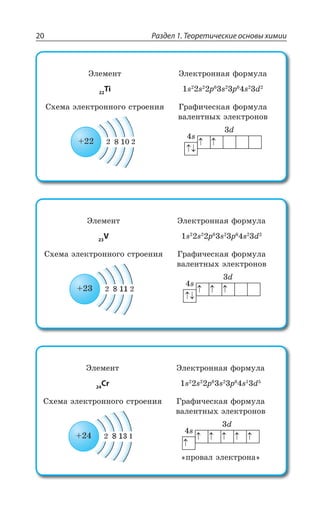
Ti 23
V
29
Cu 30
Zn Ga 31
Ge 32
As 33
Rb 37
Sr 38 39
Y 40
Zr 41
Nb
47
Ag 48
Cd In 49
Sn 50
Sb 51
Cs 55
Ba 56 57 *
La 72
Hf 73
Ta
79
Au 80
Hg Tl 81
Pb 82
Bi 83
Fr 87
Ra 88 89 **
Ac 104
Rf 105
Db
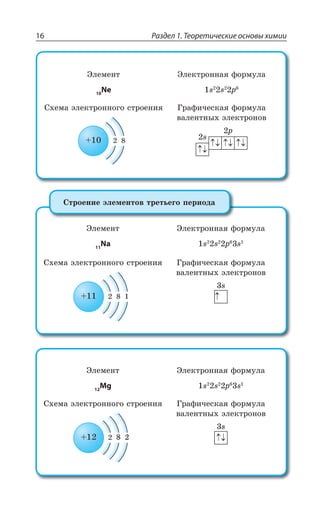
6,941
2s1
9,012
2s2
10,81
2s22p1
12,011
2s22p2
14,0067
2s22p3
22,990
3s1
24,305
3s2
26,981
3s23p1
28,086
3s23p2
30,973
3s23p3
89,098
4s1
40,08
4s2
44,956
3d14s2
47,90
3d24s2
50,941
3d34s2
63,547
3d104s1
65,38
3d104s2
69,72
4s24p1
72,59
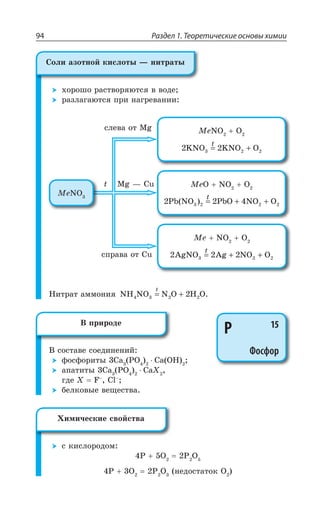
4s24p2
74,921
4s24p3
85,468
5s1
87,62
5s2
88,906
4d15s2
91,22
4d25s2
92,906
4d45s1
107,868
4d105s1
112,40
4d105s2
114,82
5s25p1
118,69
5s25p2
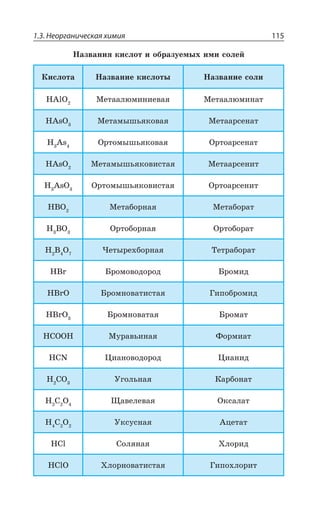
121,75
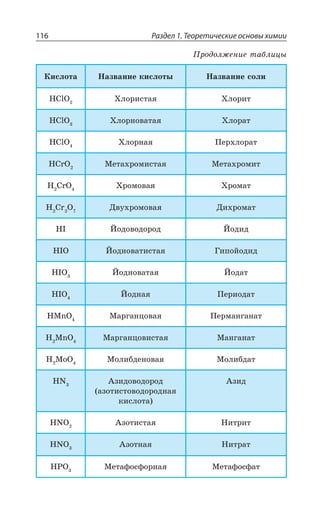
5s25p3
132,905
6s1
137,34
6s2
138,905
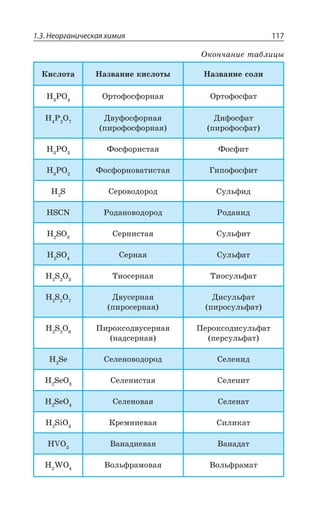
5d16s2
178,49
5d26s2
180,948
5d36s2
196,967
5d106s1
200,59
5d106s2
204,37
6s26p1
207,2
6s26p2
208,980
6s26p3
[223]
7s1
226,025
7s2
[227]
6d17s2
[261]
6d27s2
[262]
6d37s2
1
2 Литий 2
2 Бериллий 3
2 Бор 4
2 Углерод 5
2 Азот
1
8
2 Натрий
2
8
2 Магний
3
8
2 Алюминий
4
8
2 Кремний
5
8
2 Фосфор
1
8
8
2 Калий
2
8
8
2 Кальций
2
9
8
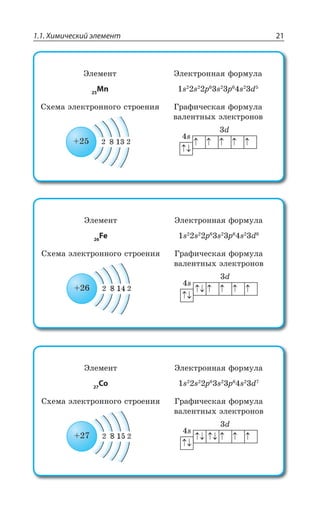
Скандий 2
2
10
8
Титан 2
2
11
8
Ванадий 2
1
18
8
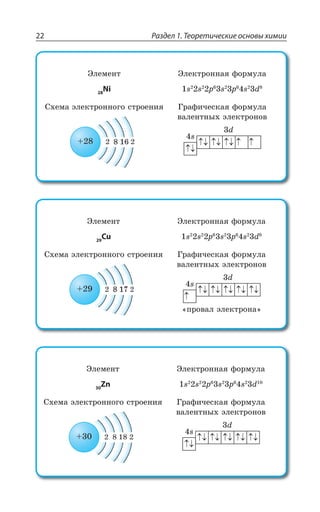
Медь 2
2
18
8
Цинк 2
3
18
8
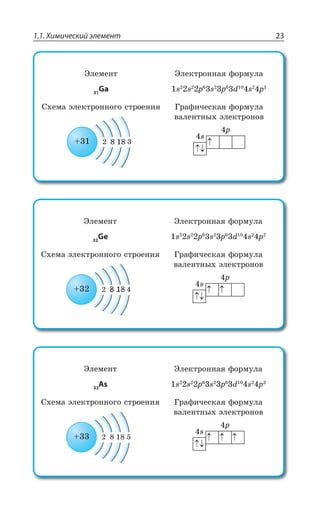
2 Галлий
4
18
8
2 Германий
5
18
8
2 Мышьяк
1
8
18
8
2 Рубидий
2
8
18
8
2 Стронций
2
9
18
8
Иттрий 2
2
10
18
8
Цирконий 2
1
12
18
8
Ниобий 2
1
18
18
8
Серебро 2
2
18
18
8
Кадмий 2
3
18
18
8
2 Индий
4
18
18
8
2 Олово
5
18
18
8
2 Сурьма
1
8
18
18
8
2 Цезий
2
8
18
18
8
2 Барий
2
9
18
18
8
Лантан 2
2
10
32
18
8
Гафний 2
2
11
32
18
8
Тантал 2
1
18
32
18
8
Золото 2
2
18
32
18
8
Ртуть 2
3
18
32
18
8
2 Таллий
4
18
32
18
8
2 Свинец
5
18
32
15
8
2 Висмут
1
8
18
32
18
8
2 Франций
2
8
18
32
18
8
2 Радий
2
9
18
32
18
8
Актиний 2
2
10
32
32
18
8
Резерфордий2
2
11
32
32
18
8
Дубний 2
Лантаноиды
Актиноиды
Периодическая система химических элементов Д.И.Менделеева
58
Ce 59
Pr 60
Nd 61
Pm 62
Sm 63
Eu 64
Gd140,12
4f 15d16s2
140,908
4f 36s2
144,24
4f 46s2
[145]
4f 56s2
150,4
4f 66s2
151,96
4f 76s2
157,25
4f 75d16s2
2
9
19
18
8
Церий 2
2
8
21
18
8
Празеодим2
2
8
22
18
8
Неодим 2
2
9
23
18
8
Прометий 2
2
8
24
18
8
Самарий 2
2
8
25
18
8
Европий 2
2
9
25
18
8
Гадолиний 2
90
Th 91
Pa 92
U 93
Np 94
Pu 95
Am 96
Cm232,038
6d27s2
[231]
5f 26d17s2
238,029
5f 36d17s2
[237]
5f 46d17s2
[244]
5f 67s2
[243]
5f 77s2
[247]
5f 76d17s2
2
10
18
32
18
8
Торий 2
2
9
20
32
18
8
Протактиний2
2
9
21
32
18
8
Уран 2
2
9
22
32
18
8
Нептуний 2
2
8
24
32
18
8
Плутоний 2
2
8
25
32
18
8
Америций 2
2
9
25
32
18
8
Кюрий 2](https://image.slidesharecdn.com/37504-160518025243/85/37504-26-320.jpg)
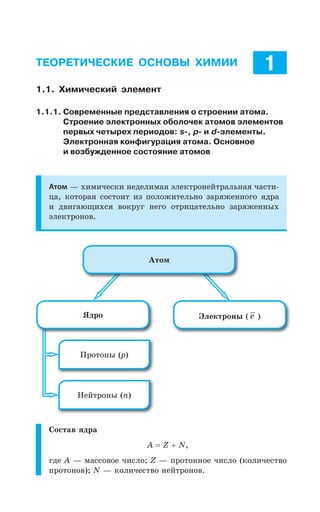
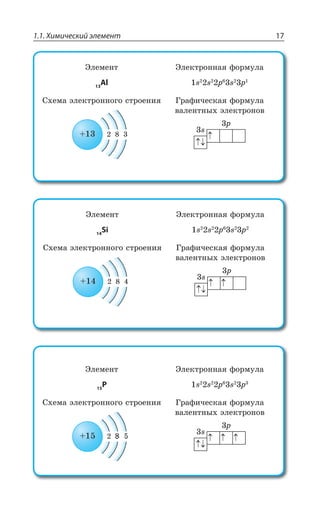
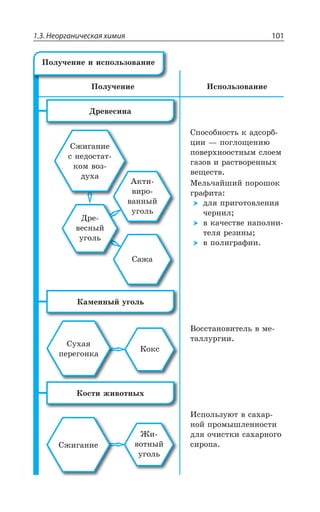
![1.1. Химический элемент 27
а VI б а VII б а VIII б
H 1
He 2
O 8
F 9
Ne 10
S 16
Cl 17
Ar 18
24
Cr 25
Mn 26
Fe 27
Co 28
Ni
Se 34
Br 35
Kr 36
42
Mo 43
Tc 44
Ru 45
Rh 46
Pd
Te 52
I 53
Xe 54
74
W 75
Re 76
Os 77
Ir 78
Pt
Po 84
At 85
Rn 86
106
Sg 107
Bh 108
Hs 109
Mt 110
Ds
Ar 18
1,0079
1s1
4,0026
1s2
15,999
2s22p4
18,998
2s22p5
20,179
2s22p6
32,06
3s23p4
32,453
3s23p5
39,948
3s23p6
51,996
3d54s1
54,938
3d54s2
55,847
3d64s2
58,933
3d74s2
58,70
3d84s2
78,96
4s24p4
79,904
4s24p5
83,80
4s24p6
95,94
4d55s1
98,906
4d55s2
101,07
4d75s1
102,905
4d85s1
106,4
4d10
127,60
5s25p4
126,904
5s25p5
131,30
5s25p6
183,85
5d46s2
186,207
5d56s2
190,2
5d66s2
192,22
5d76s2
195,09
5d96s1
[209]
6s26p4
[210]
6s26p5
[222]
6s26p6
[266]
6d47s2
[267]
6d57s2
[269]
6d67s2
[268]
6d77s2
[271]
6d97s1
39,948
3s23p6
1 Водород 2 Гелий
6
2 Кислород 7
2 Фтор 8
2 Неон
6
8
2 Сера
7
8
2 Хлор
8
8
2 Аргон
1
13
8
Хром 2
2
13
8
Марганец 2
2
14
8
Железо 2
2
15
8
Кобальт 2
2
16
8
Никель 2
6
18
8
2 Селен
7
18
8
2 Бром
8
18
8
2 Криптон
1
13
18
8
Молибден 2
1
13
18
8
Технеций 2
1
15
18
8
Рутений 2
1
16
18
8
Родий 2
18
18
8
Палладий 2
6
18
18
8
2 Теллур
7
18
18
8
2 Иод
8
18
18
8
2 Ксенон
2
12
32
18
8
Вольфрам 2
2
13
32
18
8
Рений 2
2
14
32
18
8
Осмий 2
2
15
32
18
8
Иридий 2
1
17
32
18
8
Платина 2
6
18
32
18
8
2 Полоний
7
18
32
18
8
2 Астат
8
19
32
18
8
2 Радон
2
12
32
32
18
8
Сиборгий 2
2
13
32
32
18
8
Борий 2
2
14
32
32
18
8
Хассий 2
2
15
32
32
18
8
Мейтнерий 2
1
17
32
32
18
8
Дармштадтий 2
8
8
2 Аргон
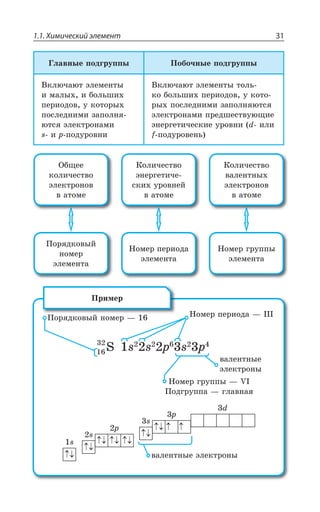
Символ элемента
Атоманая масса
Атомный номер
Название элемента
Распределение электронов по уровням
Распределение электро-
ся подуровням
65
Tb 66
Dy 67
Ho 68
Er 69
Tm 70
Yb 71
Lu158,925
4f 96s2
162,50
4f 106s2
164,93
4f 116s2
167,26
4f 126s2
168,93
4f 136s2
173,04
4f 146s2
174,97
4f 125d16s2
2
8
27
18
8
Тербий 2
2
8
28
18
8
Диспрозий 2
2
8
29
18
8
Гольмий 2
2
8
30
18
8
Эрбий 2
2
8
31
18
8
Тулий 2
2
8
32
18
8
Иттербий 2
2
9
32
18
8
Лютеций 2
97
Bk 98
Cf 99
Es 100
Fm 101
Md 102
No 103
Lr[247]
5f 86d17s2
[251]
5f 107s2
[254]
5f 117s2
[257]
5f 127s2
[258]
5f 127s2
[259]
5f 147s2
[262]
5f 146d17s2
2
9
26
32
18
8
Берклий 2
2
9
27
32
18
8
Калифорний2
2
9
28
32
18
8
Эйнштейний2
2
9
29
32
18
8
Фермий 2
2
9
30
32
18
8
Менделеевий2
2
9
31
32
18
8
Нобелий 2
2
9
32
32
18
8
Лоуренсий2](https://image.slidesharecdn.com/37504-160518025243/85/37504-27-320.jpg)

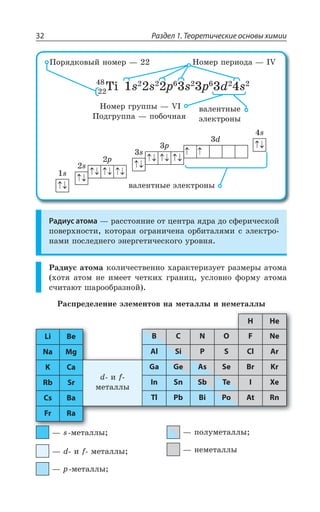
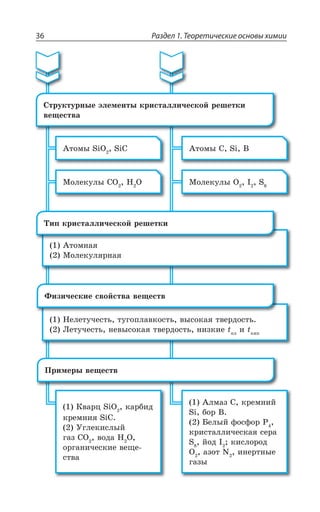


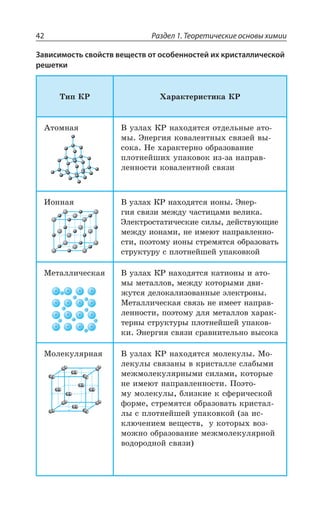

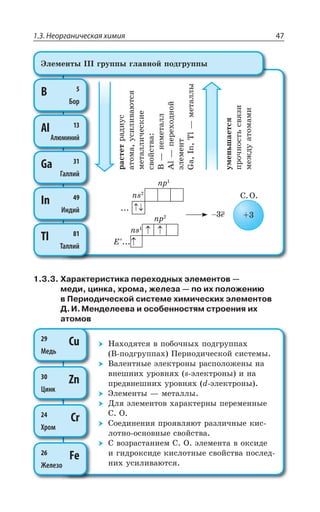
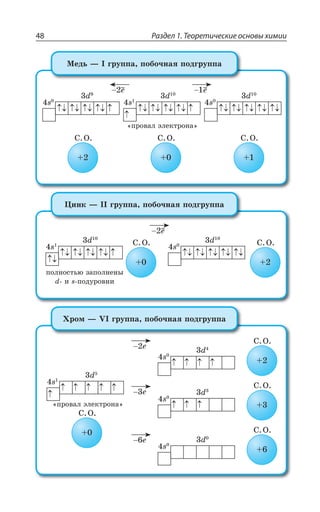
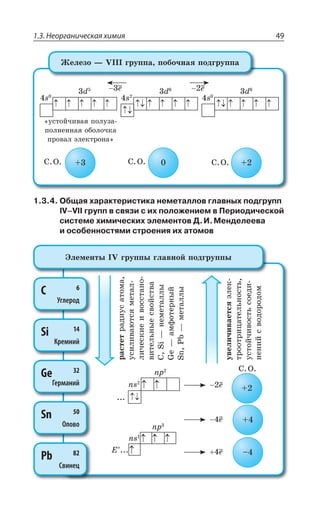
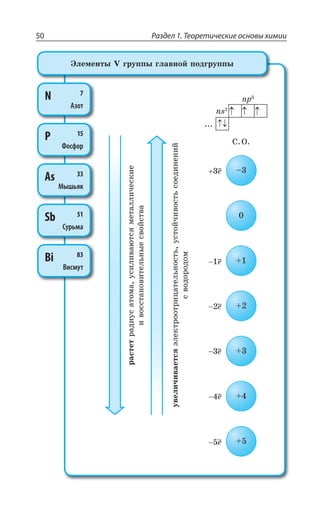
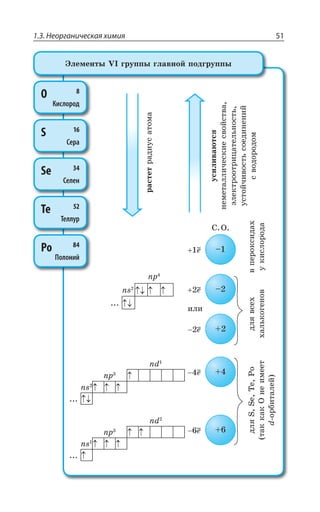















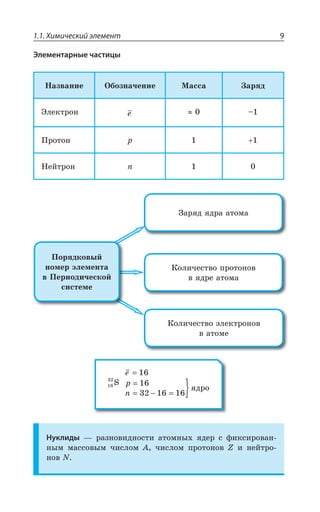
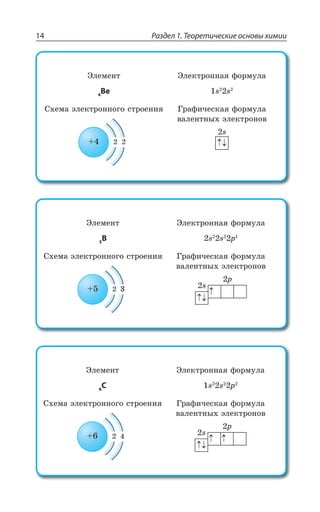
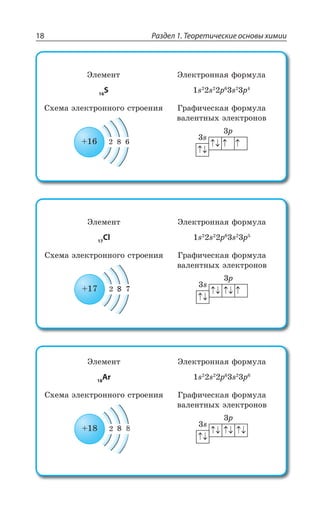
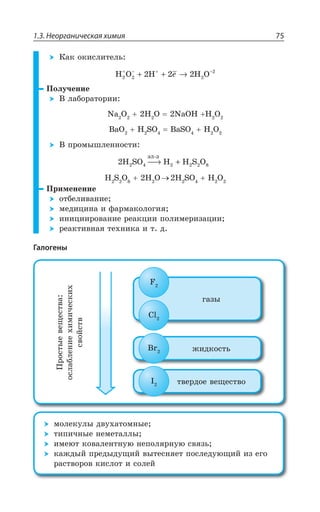
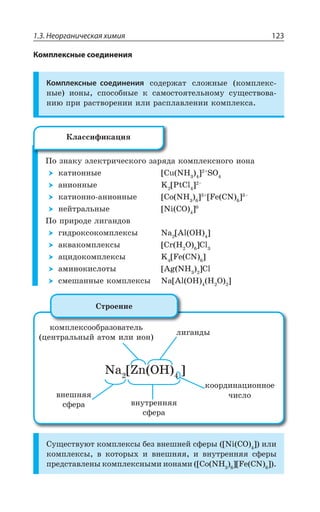
![1.3. Неорганическая химия 69
Ó ÓÊÍÞÏÝÎÊ ÐÌÊÓÍÊÔÇÍáÎÊ z ÆÐ *I
*I 3 *I 3
*I 'P *I'P
*I ,23 *I 23 23 , 3
*I , 73 *I 73 73 , 3
±ÂÓÓÊÄÏÐ Ï ×ÐÍÐÆÇ Ä ÌÐÏØÇÏÔÒÊÒÐÄÂÏÏÝ× ,23 Ê , 73
ÓÇÒÇÃÒÊÓÔÐ ÃÇÍÝË ÎÇÔÂÍÍ
ÄÝÓÐÌÂá ÑÍÂÓÔÊÙÏÐÓÔÞ
XÑÍ
³
ÍÇÅÌÐ ÏÂÎÂÅÏÊÙÊÄÂÇÔÓá Ê ÒÂÉÎÂÅÏÊÙÊÄÂÇÔÓá
*I
*I3 z ÑÐÒÐÚÐÌ ÙÇÒÏÐÅÐ ØÄÇÔÂ
±ÐÍÕÙÇÏÊÇ
Fe OH FeO H O2( )2 = +
X
*I 3 '3 *I3 '3
*I 3, ÊÎÇÇÔ ×ÂÒÂÌÔÇÒ ÐÓÏÐÄÂÏÊá
¬ÂÙÇÓÔÄÇÏÏÝÇ ÒÇÂÌØÊÊ
FeSO NaOH Fe OH Na SO
çåëåíûé îñàäîê
4 2 2 42+ = ↓ +( )
3 22 3 6 3 6 2
FeCl K Fe CN Fe Fe CN
êðàñíàÿ êðîâÿíàÿ ñîëü ñèíå
+ =[ ( ) ] [ ( ) ]
åå îêðàøèâàíèå
KCl+ 6
ÌÐÏØ
X
ÌÐÏØ
X
¶ÊÉÊÙÇÓÌÊÇ ÓÄÐËÓÔÄÂ
³ÐÇÆÊÏÇÏÊá ÈÇÍÇÉÂ](https://image.slidesharecdn.com/37504-160518025243/85/37504-69-320.jpg)
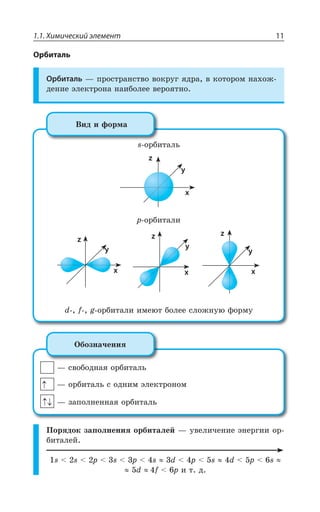
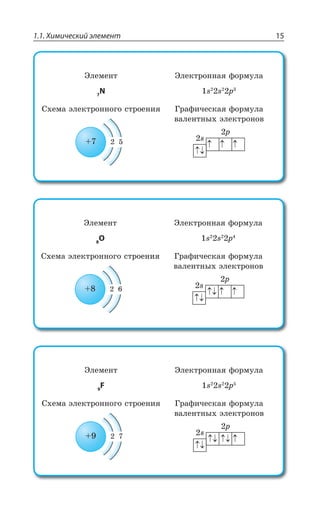
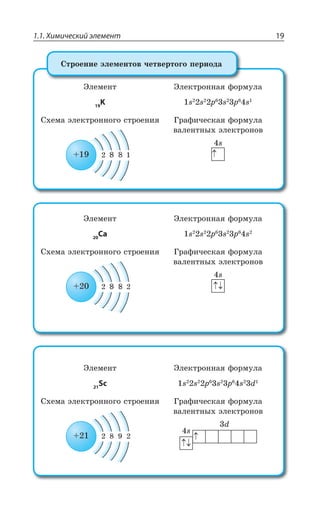
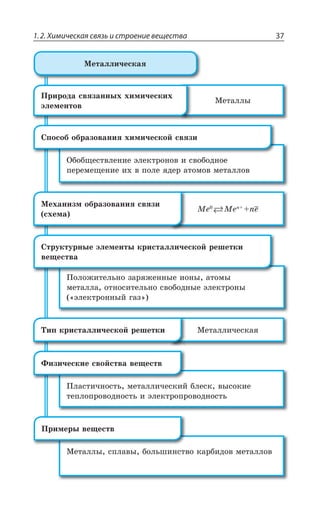
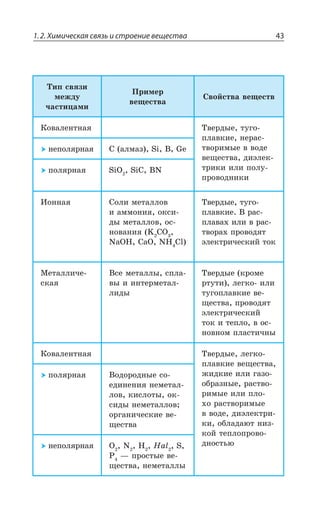
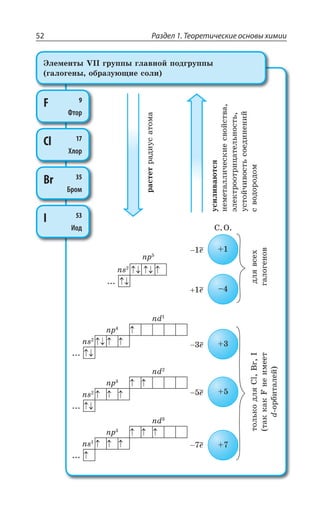
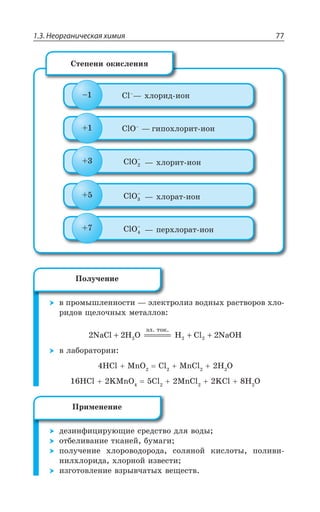
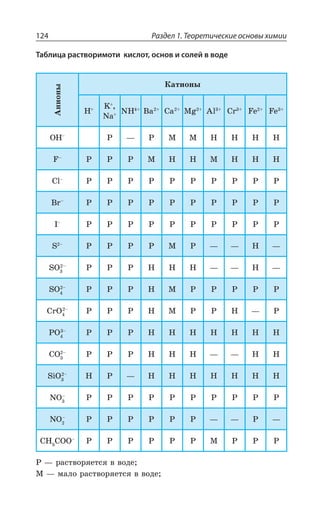
![Раздел 1. Теоретические основы химии70
*I
*I 3 z ÑÐÒÐÚÐÌ ÃÕÒÐÅÐ ØÄÇÔÂ
±ÐÍÕÙÇÏÊÇ
*I 3 *I 3
*I 3, *I 3 , 3
*I7 3 *I 3 73
*I 3, ÊÎÇÇÔ ÓÍÂÃÐ ÄÝÒÂÈÇÏÏÝË ÂÎÖÐÔÇÒÏÝË ×ÂÒÂÌÔÇÒ
¬ÂÙÇÓÔÄÇÏÏÝÇ ÒÇÂÌØÊÊ
FeCl NaOH Fe OH NaCl
áóðûé îñàäîê
3 33 3+ = ↓ +( )
4 33 4 6 4 6 3
FeCl K Fe CN Fe Fe CN
æåëòàÿ êðîâÿíàÿ ñîëü ñèíåå
+ =[ ( ) ] [ ( ) ]
îêðàøèâàíèå
KCl+ 12
FeCl NH CNS Fe CNS NH Cl
ðîäàíèä êðàñíîå îêðàøèâàíèå
3 4 3 43 3+ = +( )
³ÐÇÆÊÏÇÏÊá *I ⎯ →⎯⎯⎯
ëåãêî
ÓÐÇÆÊÏÇÏÊá *I
*I 3, 3 , 3 *I 3, Ï ÄÐÉÆÕ×Ç
*I'P 'P *I'P
°ÓÏÐÄÂÏÐ ÏÂ ÄÐÓÓÔÂÏÐÄÍÇÏÊÊ ÐÌÓÊÆÐÄ ÈÇÍÇÉÂ ÐÌÓÊÆÐÎ ÕÅÍÇ
ÒÐÆÂ ”” Ê ÌÐÌÓÐÎ ÕÅÍÇÒÐÆÐÎ ±ÒÊ ßÔÐÎ ÐÃÒÂÉÕÇÔÓá ÓÑÍÂÄ
ÈÇÍÇÉÂ Ó ÕÅÍÇÒÐÆÐÎ ÆÐ Ê ÆÒÕÅÊÎÊ ÑÒÊÎÇÓáÎÊ 7M 1R
7 4 z ÙÕÅÕÏ
*I 3 '3 *I 3 '3
*I 3 '3 *I3 '3
*I3 '3 *I '3
³ÔÂÍÞ z ÓÑÍÂÄ ÈÇÍÇÉÂ Ó ÕÅÍÇÒÐÆÐÎ ÆÐ ÅÆÇ ÆÒÕÅÊ×
ÑÒÊÎÇÓÇË 7M 1R 7 4 ÎÇÏÞÚÇ ÙÇÎ Ä ÙÕÅÕÏÇ
±ÐÍÕÙÇÏÊÇ ÈÇÍÇÉÂ](https://image.slidesharecdn.com/37504-160518025243/85/37504-70-320.jpg)



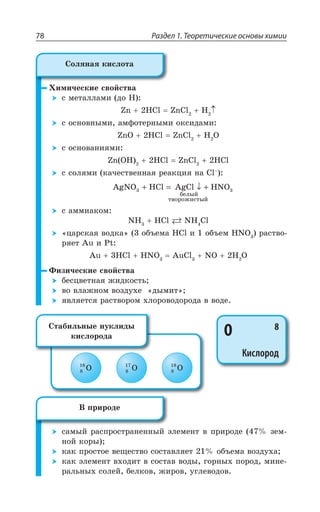




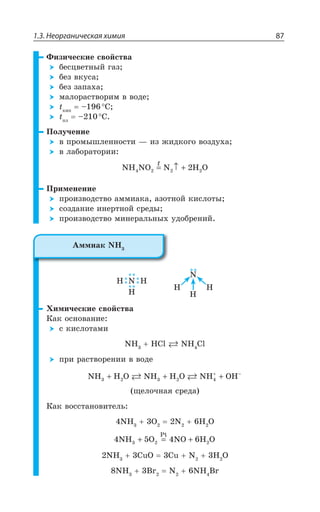

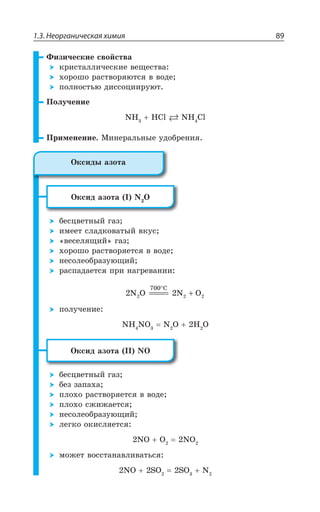
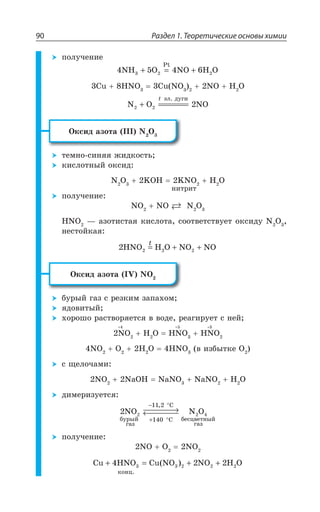

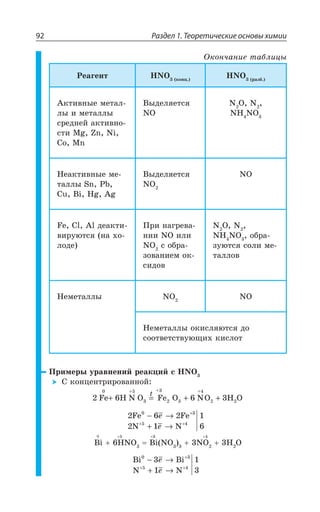




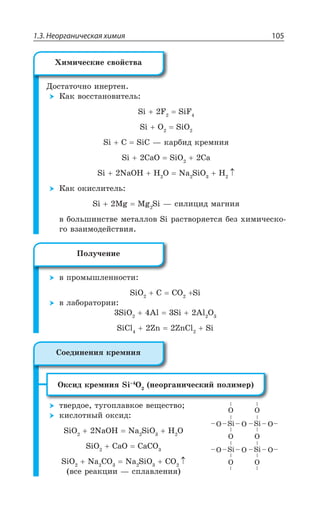










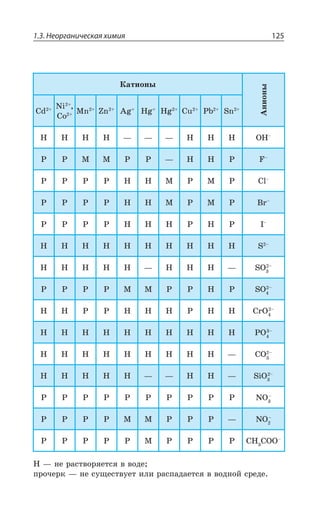

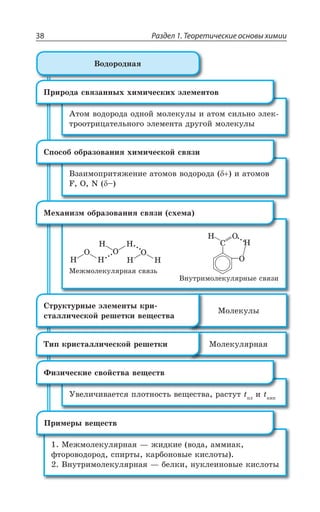
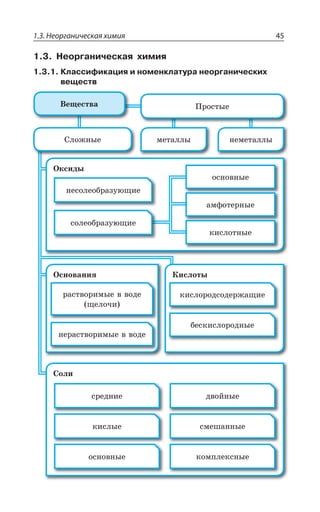
![1.3. Неорганическая химия 127
ÆÊÓÓÐØÊÂØÊá
ÑÇÒÄÊÙÏÂá z ÑÐ ÔÊÑÕ ÓÊÍÞÏÝ× ßÍÇÌÔÒÐÍÊÔÐÄ
2E?%P 3, A 2E ?%P 3, Ay
[ ( ) ] [ ( ) ]Cu NH SO Cu NH SO3 4 4 3 4
2
4
2
→ ++ −
ÄÔÐÒÊÙÏÂá ÆÊÓÓÐØÊÂØÊá ÌÐÎÑÍÇÌÓÏÐÅÐ ÊÐÏÂ z ÑÐ ÔÊÑÕ
ÓÍÂÃÝ× ßÍÇÌÔÒÐÍÊÔÐÄ ÌÒÐÎÇ ÏÇËÔÒÂÍÞÏÝ× ÌÐÎÑÍÇÌÓÐÄ
?%P 3, Ay
%P 3,y
ÔÇÒÎÊÙÇÓÌÐÇ ÒÂÉÍÐÈÇÏÊÇ
2E ?R 3, A 2E R3 , 3
ÒÇÂÌØÊÊ Ä ÌÐÔÐÒÝ× ÐÃÒÂÉÕàÔÓá ÃÐÍÇÇ ÕÓÔÐËÙÊÄÝÇ ÌÐÎ
ÑÍÇÌÓÝ
2E ?R 3, A 'Y73 2E 73 'Y?R 3, A
ÒÇÂÌØÊÊ Ó ÌÊÓÍÐÔÂÎÊ
2E ?R 3, A ,'P 2E'P R 3, , 3 z
Ä ÏÇÃÐÍÞÚÐÎ ÌÐÍÊÙÇÓÔÄÇ ÌÊÓÍÐÔÝ
2E ?R 3, A ,'P 2E'P R'P , 3 z
Ä ÊÉÃÝÔÌÇ ÌÊÓÍÐÔÝ
ÒÇÂÌØÊÊ ÒÂÉÒÕÚÇÏÊá ÌÐÎÑÍÇÌÓÂ ÑÒÊ ÄÄÇÆÇÏÊÊ Ä ÒÂÓÔÄÐÒ
ÊÐÏÐÄ Ó ÌÐÔÐÒÝÎÊ ÊÐÏ ÌÐÎÑÍÇÌÓÐÐÃÒÂÉÐÄÂÔÇÍÞ ÐÃÒÂÉÕÇÔ
ÔÒÕÆÏÐÒÂÓÔÄÐÒÊÎÐÇ ÓÐÇÆÊÏÇÏÊÇ
2E ?R 3, A 2E 7 ! R7 2E3,
ÔÄÇÒÆÝÇ ÄÇÛÇÓÔÄÂ
ÃÐÍÞÚÊÏÓÔÄÐ ÒÂÓÔÄÐÒáÇÔÓá Ä ÄÐÆÇ
·ÊÎÊÙÇÓÌÊÇ ÓÄÐËÓÔÄÂ
¶ÊÉÊÙÇÓÌÊÇ ÓÄÐËÓÔÄÂ](https://image.slidesharecdn.com/37504-160518025243/85/37504-127-320.jpg)

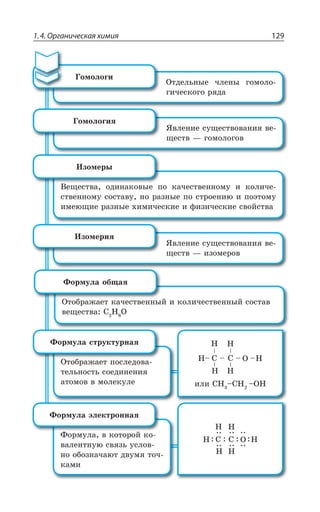
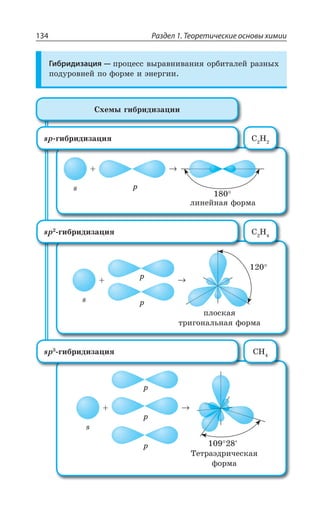
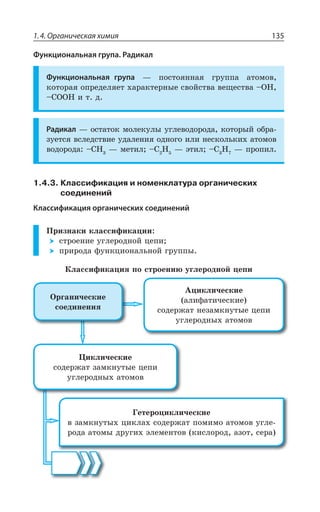
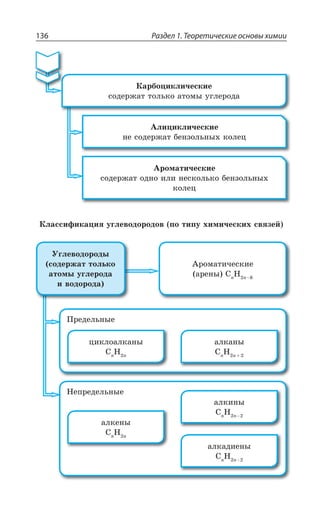
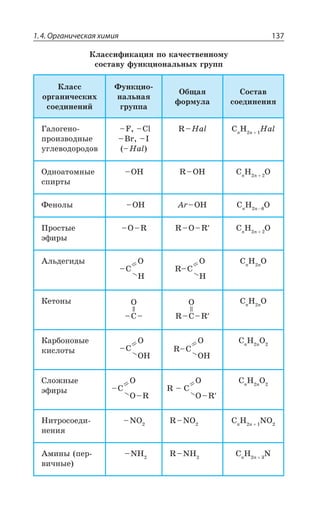
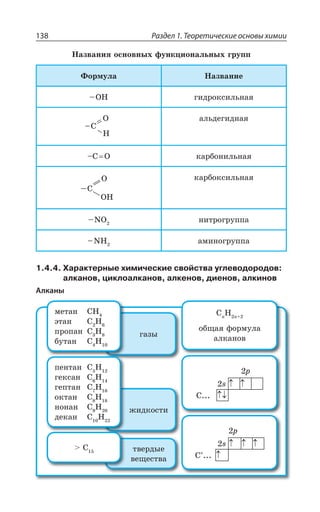
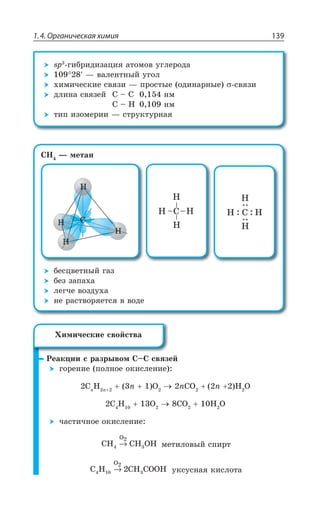


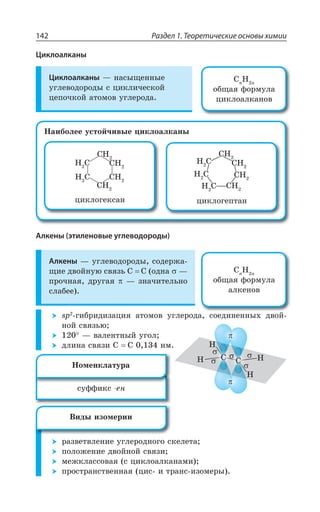
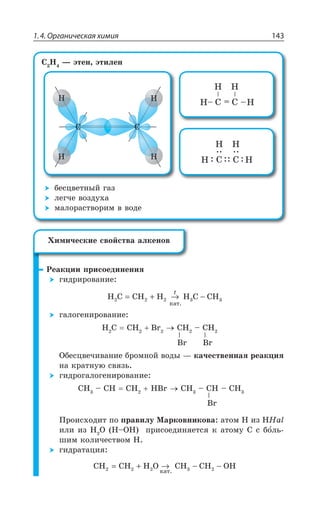
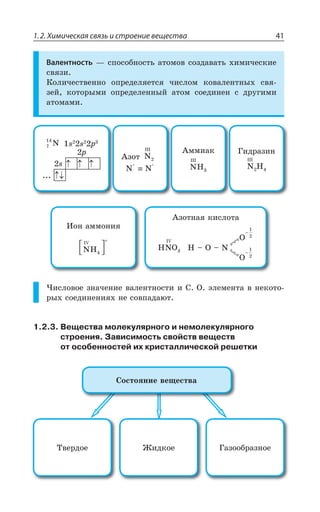
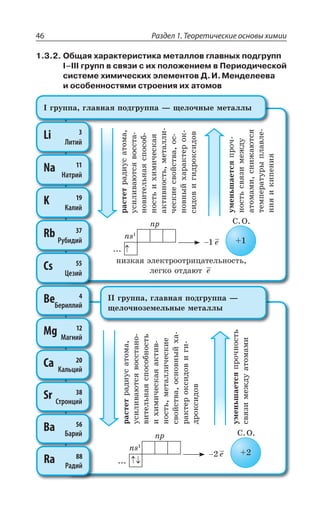
![Раздел 1. Теоретические основы химии144
ÑÐÍÊÎÇÒÊÉÂØÊá
', R
y', y ', yn
t p
CH CH=CH
êàò.3 2− −−→
,
²ÇÂÌØÊÊ ÐÌÊÓÍÇÏÊá
ÏÇÑÐÍÏÐÇ ÐÌÊÓÍÇÏÊÇ ÅÐÒÇÏÊÇ
' , 3 '3 , 3
ÎáÅÌÐÇ ÐÌÊÓÍÇÏÊÇ
3, 3, 3, 3,
', ', , 3 /1R3 ', y ', 1R3 /3,
ÊÍÊ
3, 3,3, 3,
CH CH O H O CH CH2
KMnO
2 2 2 2
4
= + + −−−−→ −[ ]
ßÔÊÍÇÏÅÍÊÌÐÍÞ
°ÃÇÓØÄÇÙÊÄÂÏÊÇ ÒÂÓÔÄÐÒÂ ÑÇÒÎÂÏÅÂÏÂÔÂ ÌÂÍÊá z ÌÂÙÇ
ÓÔÄÇÏÏÂá ÒÇÂÌØÊá Ï ÌÒÂÔÏÕà ÓÄáÉÞ
ÌÒÇÌÊÏÅ ÏÇÖÔÊ
ÔÇÒÎÊÙÇÓÌÊË y ³
ÌÂÔÂÍÊÔÊÙÇÓÌÊË y ³
ÆÇÅÊÆÒÊÒÐÄÂÏÊÇ ÂÍÌÂÏÐÄ
CH CH CH CH +H3
êàò.
− → =3 2 2 2
X
ÆÇÅÊÆÒÐÅÂÍÐÅÇÏÊÒÐÄÂÏÊÇ ÂÍÌÊÍÅÂÍÐÅÇÏÊÆÐÄ
CH CH KOH CH CH KCl H O3
ñïèðò
− + → = + +2 2 2 2
.
X
'P
ÆÇÅÊÆÒÂÔÂØÊá ÓÑÊÒÔÐÄ
CH CH CH CH H O3
H2SO4
− −−−−→ = +2 2 2 2
X
3,
¦ÇÅÊÆÒÂÔÂØÊá Ê ÆÇÅÊÆÒÐÅÂÍÐÅÇÏÊÒÐÄÂÏÊÇ ÑÒÐÊÓ×ÐÆáÔ ÑÐ
ÑÒÂÄÊÍÕ ©ÂËØÇÄ ÂÔÐÎ ÄÐÆÐÒÐÆ ÐÔÛÇÑÍáÇÔÓá ÐÔ ÂÔÐΠ'
Ó ÎÇÏÞÚÊÎ ÌÐÍÊÙÇÓÔÄÐÎ ,
±ÐÍÕÙÇÏÊÇ ÂÍÌÇÏÐÄ](https://image.slidesharecdn.com/37504-160518025243/85/37504-144-320.jpg)
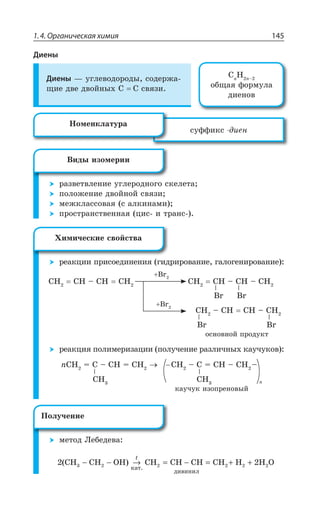
![1.4. Органическая химия 147
²ÇÂÌØÊÊ ÑÒÊÓÐÇÆÊÏÇÏÊá
ÅÊÆÒÊÒÐÄÂÏÊÇ
H C C H H CH CH CH CH
êàò. êàò.
H
− ≡ − + −→ = −−→ −
+
2 2 2 3 3
2X
X,
ÅÂÍÐÅÇÏÊÒÐÄÂÏÊÇ
H C C H Cl CH CH Cl CH CH Cl
Cl
− ≡ − + → = −−→ − − −
+
2
2X
'P 'P 'P 'P
ÅÊÆÒÂÔÂØÊá ÒÇÂÌØÊá ¬ÕÙÇÒÐÄÂ
,
3
H C C H H O CH C
Hg2+
− ≡ − + −−→ −2 3
X
ÕÌÓÕÓÏÝË ÂÍÞÆÇÅÊÆ
ÌÇÔÐÏ
′− ≡ − + −−→ ′− −R C C H H O R C CH
Hg2+
2 3
X
3
±ÒÐÊÓ×ÐÆÊÔ ÑÐ ÑÒÂÄÊÍÕ ®ÂÒÌÐÄÏÊÌÐÄÂ
ÅÊÆÒÐÅÂÍÐÅÇÏÊÒÐÄÂÏÊÇ
H C C H HCl CH CH CH CH Cl
HCl
− ≡ − + → = −−→ − −
+
2 3
'P 'P
²ÇÂÌØÊÊ ÉÂÎÇÛÇÏÊá , ÄÐÉÍÇ ÔÒÐËÏÐË ÓÄáÉÊ
Ó ÓÐÍáÎÊ ÓÇÒÇÃÒÂ
H C C H Ag NH OH Ag C C Ag NH
àöåòèëåíèä áåëûé
îñàäîê
− ≡ − + → − ≡ − ↓ +2 43 2[( ) ] 33 2+ H O2
Ó ÓÐÍáÎÊ ÎÇÆÊ ”
H C C H Cu NH OH Cu C C Cu
àöåòèëåíèä
êðàñíîêîðè÷íåâûé
− ≡ − + → − ≡ −2 3 2[ ( ) ]
îîñàäîê
NH H O2+ +4 23
²ÇÂÌØÊÊ ÑÐÍÊÎÇÒÊÉÂØÊÊ
ØÊÌÍÊÙÇÓÌÂá ÔÒÊÎÇÒÊÉÂØÊá
3CH CH
C .
≡ −−→
X
êàò
ÃÇÏÉÐÍ
·ÊÎÊÙÇÓÌÊÇ ÓÄÐËÓÔÄÂ](https://image.slidesharecdn.com/37504-160518025243/85/37504-147-320.jpg)
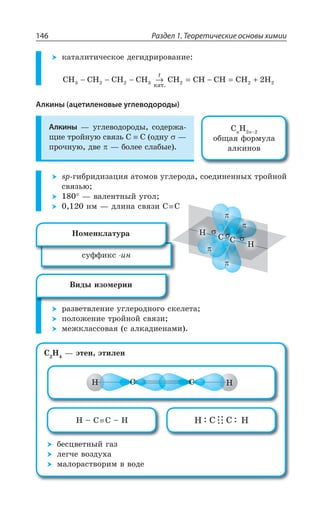
![Раздел 1. Теоретические основы химии148
ÍÊÏÇËÏÂá ÆÊÎÇÒÊÉÂØÊá
2 2CH CH CH CH C CH
êàò.
âèíèëàöåòèëåí
≡ → = − ≡
²ÇÂÌØÊÊ ÐÌÊÓÍÇÏÊá
ÑÐÍÏÐÇ ÐÌÊÓÍÇÏÊÇ ÅÐÒÇÏÊÇ
' , 3 '3 , 3
ÂØÇÔÊÍÇÏ Ï ÄÐÉÆÕ×Ç ÅÐÒÊÔ ÌÐÑÔáÛÊÎ ÑÍÂÎÇÏÇÎ
ÙÂÓÔÊÙÏÐÇ ÐÌÊÓÍÇÏÊÇ ÐÃÇÓØÄÇÙÊÄÂÏÊÇ ÒÂÓÔÄÐÒÂ /1R3
CH CH O
KMnO
≡ + ⎯ →⎯⎯⎯[ ]
4
±ÐÍÕÙÇÏÊÇ
'E' , 3 'E 3, ' ,
2 34 2 2CH C H H2→ +
X
CH CHBr KOH KBr H O C H
ñïèðò.
2 23 2 22 2 2− + → + +
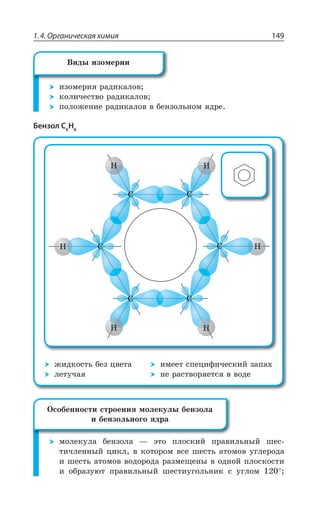
1.4.5. Характерные химические свойства ароматических
углеводородов: бензола и толуола
Ароматические углеводороды z
ÕÅÍÇÄÐÆÐÒÐÆÝ ÓÐÆÇÒÈÂÛÊÇ ÂÒÐ
ÎÂÔÊÙÇÓÌÕà ÓÄáÉÞ
WT ÅÊÃÒÊÆÊÉÂØÊá ÂÔÐÎÐÄ ÕÅÍÇÒÐÆÂ
z ÄÂÍÇÏÔÏÝË ÕÅÐÍ
ÆÍÊÏ ÓÄáÉÊ 'y' ÏÎ
' , z ÃÇÏÉÐÍ
ÅÐÎÐÍÐÅÊ ÃÇÏÉÐÍÂ z ÉÂÎÇ
ÛÇÏÏÝÇ ÑÒÐÊÉÄÐÆÏÝÇ ÃÇÏ
ÉÐÍÂ ÎÇÔÊÍÃÇÏÉÐÍ ßÔÊÍ
ÃÇÏÉÐÍ
¯ÐÎÇÏÌÍÂÔÕÒÂ
ÛÂÄÇÍÇÄÂá ÌÊÓÍÐÔÂ
'R
, Ry
ÐÃÛÂá ÖÐÒÎÕÍÂ
ÂÒÐÎÂÔÊÙÇÓÌÊ×
ÕÅÍÇÄÐÆÐÒÐÆÐÄ](https://image.slidesharecdn.com/37504-160518025243/85/37504-148-320.jpg)

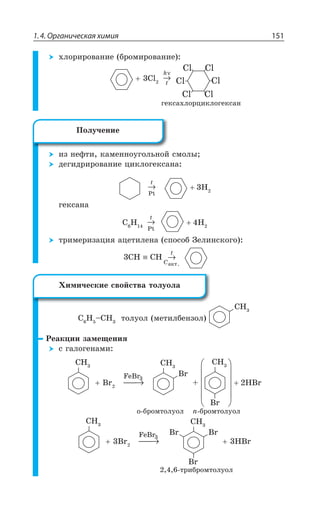
![Раздел 1. Теоретические основы химии152
Ó ÂÉÐÔÏÐË ÌÊÓÍÐÔÐË
',
,23 −−−−−−−−−→
H SO конц.2 4 ( )
',
23
',
23
, 3
',
,23 −−−−−−−−−→
H SO конц.2 4 ( )
',
233 2
23
, 3
²ÇÂÌØÊÊ ÐÌÊÓÍÇÏÊá
ÑÒÐÔÇÌÂàÔ ÍÇÅÌÐ Ä ÐÔÍÊÙÊÇ ÐÔ ÃÇÏÉÐÍÂ
ÐÌÊÓÍÊÔÇÍÊ z /1R3 3 / 'V 3
',
→
[ ]3
'33,
, 3
1.4.6. Характерные химические свойства предельных
одноатомных и многоатомных спиртов; фенола
Спирты
Спирты 6 y 3, z ÓÐÆÇÒÈÂÔ
ÐÆÏÕ ÊÍÊ ÏÇÓÌÐÍÞÌÐ ÅÊÆÒÐ
ÌÓÊÍÞÏÝ× ÅÒÕÑÑ 3 ,
3, 3,
', y ',
ßÔÂÏÆÊÐÍ ßÔÊÍÇÏÅÍÊÌÐÍÞ z ÑÒÇÆÇÍÞÏÝË ÆÄÕ×ÂÔÐÎÏÝË ÓÑÊÒÔ
Ð ÏÊÔÒÐÔÐÍÕÐÍ R ÏÊÔÒÐÔÐÍÕÐÍ
ÔÒÊÏÊÔÒÐÔÐÍÕÐÍ
ÔÒÐÔÊÍ
ÃÇÏÉÐËÏÂá
ÌÊÓÍÐÔÂ
'R
, R
3 ÊÍÊ 'R
, R
3,
°ÃÛÊË ÓÐÓÔÂÄ ÑÒÇ
ÆÇÍÞÏÝ× ÐÆÏÐÂÔÐÎÏÝ×
ÓÑÊÒÔÐÄ
®ÏÐÅÐÂÔÐÎÏÝÇ ÓÑÊÒÔÝ](https://image.slidesharecdn.com/37504-160518025243/85/37504-152-320.jpg)

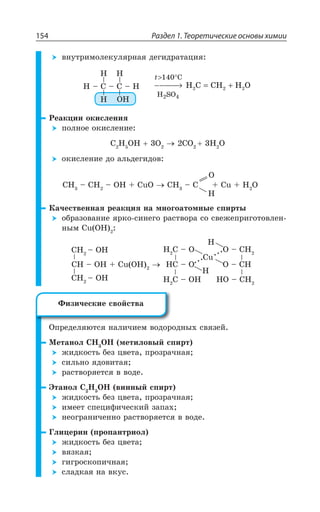
![1.4. Органическая химия 155
C H C H Cl C H OH
Cl
H O
+NaOH
2
n n n n n n
h
2 2 2 1 2 1
2
+ + +→ →
+
ν
,
3
C H C +H C H CH OH2 2
êàò.n n n n2 1 2 1+ +− → − −
t
ÂÍÞÆÇÅÊÆ
CH CH CH CH OH
O
3 3 3 2− → − −
[ ]
CH CH H O CH CH OH2
H SO2
2 2 3 2
4
= + −−−→ −
X
C H O C H OH CO
ãëþêîçà
äðîææè
6 12 6 2 5 22 2→ +
CO H CH OH
êàò.
+ →2 2 3
T
Фенолы
Фенолы z ÑÒÐÊÉÄÐÆÏÝÇ ÂÒÐÎÂÔÊÙÇ
ÓÌÊ× ÕÅÍÇÄÐÆÐÒÐÆÐÄ Ä ÌÐÔÐÒÝ× ÐÆÊÏ
ÊÍÊ ÏÇÓÌÐÍÞÌÐ ÂÔÐÎÐÄ ÄÐÆÐÒÐÆÂ ÏÇÑÐ
ÓÒÇÆÓÔÄÇÏÏÐ ÓÄáÉÂÏÏÏÝ× Ó ÂÒÐÎÂÔÊÙÇ
ÓÌÊÎ ÌÐÍÞØÐÎ ÉÂÎÇÛÇÏÝ ÅÊÆÒÐÌÓÊÍÞ
ÏÝÎÊ ÅÒÕÑÑÂÎÊ
°ÃÕÓÍÐÄÍÇÏÏÝÇ y3, ÅÒÕÑÑÐË
Ó ÂÌÔÊÄÏÝÎÊ ÎÇÔÂÍÍÂÎÊ
2 2 2 2C H OH Na C H ONa H6 5 6 5
íàòðèÿ
ôåíîëÿò
+ → +
±ÐÍÕÙÇÏÊÇ
' , 3,
ÊÍÊ
3,
·ÊÎÊÙÇÓÌÊÇ ÓÄÐËÓÔÄÂ](https://image.slidesharecdn.com/37504-160518025243/85/37504-155-320.jpg)
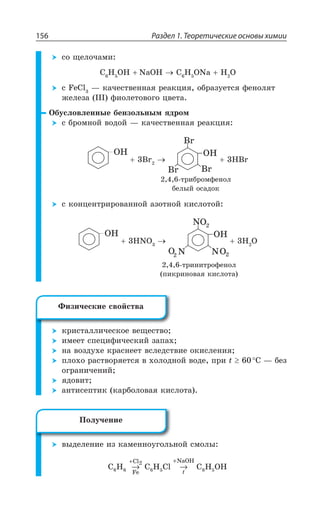





![Раздел 1. Теоретические основы химии170
¬ÒÂ×ÎÂÍ
ÌÐÍÊÙÇÓÔÄÐ ÊÉÐÎÇÒÐÄ z ÏÇÓÌÐÍÞÌÐ ÔÝÓáÙ
ÎÐÍÇÌÕÍÝ ÃÝÄÂàÔ ÍÊÏÇËÏÝÎÊ Ê ÒÂÉÄÇÔÄÍÇÏÏÝÎÊ
ÃÇÍÝË ÂÎÐÒÖÏÝË ÑÐÒÐÚÐÌ
ÏÇ ÒÂÓÔÄÐÒáÇÔÓá Ä ×ÐÍÐÆÏÐË ÄÐÆÇ Ä ÅÐÒáÙÇË ÐÃÒÂÉÕÇÔ
ÌÍÇËÓÔÇÒ
ÑÐÆÄÇÒÅÂÇÔÓá ÅÊÆÒÐÍÊÉÕ
' , 3 R
→
H O2
ÒÂÓÔÄÐÒÊÎÝË ÌÒÂ×ÎÂÍ
→ → →( )C H O C H O C H O6 10 12 22 6 12
äåêñòðèíû ìàëüòîçà ãëþêîçà
5 11 6
2
x
n
n
ÑÒÊ ÄÐÉÆÇËÓÔÄÊÊ ËÐÆ Ï ÌÒÂ×ÎÂÍ ÐÃÒÂÉÕÇÔÓá ÄÇÛÇÓÔÄÐ
ÓÊÏÇÅÐ ØÄÇÔÂ
¸ÇÍÍàÍÐÉÂ
ÌÐÍÊÙÇÓÔÄÐ ÊÉÐÎÇÒÐÄ z ÆÐ ÎÊÍÍÊÐÏÂ
ÎÐÍÇÌÕÍÝ ÊÎÇàÔ ÔÐÍÞÌÐ ÍÊÏÇËÏÕà ÓÔÒÕÌÔÕÒÕ
ÃÇÍÐÇ ÄÐÍÐÌÏÊÓÔÐÇ ÄÇÛÇÓÔÄÐ
ÏÇ ÒÂÓÔÄÐÒáÇÔÓá ÏÊ Ä ÄÐÆÇ ÏÊ Ä ÐÒÅÂÏÊÙÇÓÌÊ× ÒÂÓÔÄÐÒÊ
ÔÇÍá×
ÑÐÆÄÇÒÅÂÇÔÓá ÅÊÆÒÐÍÊÉÕ
' , 3 R
R, 3 R' , 3
ÒÇÂÌØÊá ÅÐÒÇÏÊá
' , 3 R
R3 R'3 R, 3
ÑÒÊ ÏÂÅÒÇÄÂÏÊÊ ÃÇÉ ÆÐÓÔÕÑ ÄÐÉÆÕ× ÒÂÉÍÂÅÂÇÔÓá Ï ÆÒÇ
ÄÇÓÏÝË ÕÅÐÍÞ Ê ÍÇÔÕÙÊÇ ÐÒÅÂÏÊÙÇÓÌÊÇ ÄÇÛÇÓÔÄÂ ÎÇÔÂ
ÏÐÍ ÕÌÓÕÓÏÕà ÌÊÓÍÐÔÕ Ê ÆÒ
ÒÇÂÌØÊá ßÔÇÒÊÖÊÌÂØÊÊ
[ ( ) ] [ ( ) ]C H O OH HNO C H O ONO6 7 6 7
òðèíèòðàò öåëëþëîçû
(
2 3 3 2 2 33R RR+ →
ïïèðîêñèëèí)
H O2+ 3R
[ ( ) ] [ ( ) ]C H O OH CH COOH C H O OCOCH6 7 6 7
òðèàöåòàò öåëëþ
2 3 3 2 3 33R RR+ →
ëëîçû
H O2+ 3R](https://image.slidesharecdn.com/37504-160518025243/85/37504-170-320.jpg)






![Раздел 1. Теоретические основы химии178
¦Íá ÒÇÂÌØÊÊ
E% F G' H(
ZÑÒ
OÑÒ
?%AE
?AF
ZÐÃ
OÐÃ
?'AG
?(AH
ZÑÒ
ZÐÃ
OÑÒ
?%AE
?AF
OÐÃ
?'AE
?(AH
k
k
c d
a b
ïð
îá
C D
A B
=
[ ] [ ]
[ ] [ ]
ÊÍÊ K
c d
a bð
[ ] [ ]
[ ] [ ]
=
C D
A B
?%A ?A ?'A ?(A z ÒÂÄÏÐÄÇÓÏÝÇ ÌÐÏØÇÏÔÒÂØÊÊ ÄÇÛÇÓÔÄ %
' (
Смещение химического равновесия z ÑÇÒÇ×ÐÆ ÊÉ ÐÆÏÐÅÐ
ÒÂÄÏÐÄÇÓÏÐÅÐ ÓÐÓÔÐáÏÊá Ä ÆÒÕÅÐÇ
Принцип Ле Шателье z ÇÓÍÊ Ï ÓÊÓÔÇÎÕ ÏÂ×ÐÆáÛÕàÓá
Ä ÓÐÓÔÐáÏÊÊ ×ÊÎÊÙÇÓÌÐÅÐ ÒÂÄÏÐÄÇÓÊá ÐÓÕÛÇÓÔÄÍáÇÔÓá
ÄÐÉÆÇËÓÔÄÊÇ ÊÉÎÇÏáÇÔÓá ÔÇÎÑÇÒÂÔÕÒ ÆÂÄÍÇÏÊÇ ÊÍÊ ÌÐÏ
ØÇÏÔÒÂØÊá ÄÇÛÇÓÔÄ ÔÐ Ä ÑÇÒÄÕà ÐÙÇÒÇÆÞ ÑÒÐÊÓ×ÐÆÊÔ ÔÂ
ÒÇÂÌØÊá ÌÐÔÐÒÂá ÕÎÇÏÞÚÂÇÔ ßÔÐ ÄÐÉÆÇËÓÔÄÊÇ
§ÓÍÊ ÆÂÄÍÇÏÊÇ ÒÂÓÔÇÔ ÒÂÄÏÐÄÇÓÊÇ ÓÎÇÛÂÇÔÓá Ä ÓÔÐ
ÒÐÏÕ ÕÎÇÏÞÚÇÏÊá ÐÃÜÇÎÂ ÒÇÂÅÊÒÕàÛÇË ÓÊÓÔÇÎÝ
§ÓÍÊ ÆÂÄÍÇÏÊÇ ÓÏÊÈÂÇÔÓá ÒÂÄÏÐÄÇÓÊÇ ÓÎÇÛÂÇÔÓá
Ä ÓÔÐÒÐÏÕ ÕÄÇÍÊÙÇÏÊá ÐÃÜÇÎÂ ÒÇÂÅÊÒÕàÛÇË ÓÊÓÔÇÎÝ
²
§ÓÍÊ ÔÇÎÑÇÒÂÔÕÒÂ ÒÂÓÔÇÔ ÒÂÄÏÐÄÇÓÊÇ ÓÎÇÛÂÇÔÓá
Ä ÓÔÐÒÐÏÕ ßÏÆÐÔÇÒÎÊÙÇÓÌÐË ÒÇÂÌØÊÊ
§ÓÍÊ ÔÇÎÑÇÒÂÔÕÒÂ ÓÏÊÈÂÇÔÓá ÒÂÄÏÐÄÇÓÊÇ ÓÎÇÛÂÇÔ
Óá Ä ÓÔÐÒÐÏÕ ßÌÉÐÔÇÒÎÊÙÇÓÌÐË ÒÇÂÌØÊÊ
´
§ÓÍÊ ÒÂÓÔÇÔ ÌÐÏØÇÏÔÒÂØÊá ÐÆÏÐÅÐ ÊÉ ÒÇÂÅÇÏÔÐÄ ÒÂÄ
ÏÐÄÇÓÊÇ ÓÎÇÛÂÇÔÓá Ä ÓÔÐÒÐÏÕ ÑÒáÎÐË ÒÇÂÌØÊÊ
§ÓÍÊ ÓÏÊÈÂÇÔÓá ÌÐÏØÇÏÔÒÂØÊá ÐÆÏÐÅÐ ÊÉ ÒÇÂÅÇÏÔÐÄ
ÒÂÄÏÐÄÇÓÊÇ ÓÎÇÛÂÇÔÓá Ä ÓÔÐÒÐÏÕ ÐÃÒÂÔÏÐË ÒÇÂÌØÊÊ
³
¬ÐÏÓÔÂÏÔ ÒÂÄÏÐÄÇÓÊá](https://image.slidesharecdn.com/37504-160518025243/85/37504-178-320.jpg)

![Раздел 1. Теоретические основы химии182
R 3,y
R 3, , 3 ?R 3, A y
,
¦ÊÓÓÐØÊÊÒÕàÔ ÌÂÌ ÌÊÓÍÐÔÝ Ê ÌÂÌ ÐÓÏÐÄÂÏÊá ÑÐßÔÐÎÕ ÓÑÐ
ÓÐÃÏÝ ÒÇÂÅÊÒÐÄÂÔÞ Ê Ó ÐÓÏÐÄÂÏÊáÎÊ Ê Ó ÌÊÓÍÐÔÂÎÊ
, 3 , 3,y
µÓÔÂÏÐÄÍÇÏÐ ÐÑÝÔÏÝÎ ÑÕÔÇÎ Ä Í ÄÐÆÝ ÑÒÊ X ³ ÆÊÓ
ÓÐØÊÊÒÕàÔ y
ÎÐÍÞ Í ÎÐÍÇÌÕÍ ÄÐÆÝ ÐÃÒÂÉÕÇÔÓá
y
ÎÐÍÞ Í , Ê y
ÎÐÍÞ Í 3,y
?, A ?3,y
A y
ÎÐÍÞ Í
?, A ?3,y
A z ÒÂÄÏÐÄÇÓÏÝÇ ÌÐÏØÇÏÔÒÂØÊÊ ÊÐÏÐÄ ÄÐÆÐÒÐÆÂ
Ê ÅÊÆÒÐÌÓÊÆ ÊÐÏÐÄ
K
H OH
H O2
=
+ −
[ ][ ]
[ ]
/[
?, A ?3,y
A y y y
/[
z ÊÐÏÏÐÇ ÑÒÐÊÉÄÇÆÇÏÊÇ ÄÐÆÝ
T, yPK?, A ÊÍÊ ?, A yT,
T, z ÄÐÆÐÒÐÆÏÝË ÑÐÌÂÉÂÔÇÍÞ z ÆÇÓáÔÊÙÏÝË ÍÐÅÂÒÊÖÎ
ÌÐÏØÇÏÔÒÂØÊÊ ÊÐÏÐÄ ÄÐÆÐÒÐÆÂ ÄÉáÔÝË Ó ÑÒÐÔÊÄÐÑÐÍÐÈÏÝÎ
ÉÏÂÌÐÎ
?, A ?3,y
A ÌÊÓÍÂá ÓÒÇÆÂ
T, ?, A ?3,y
A ÏÇËÔÒÂÍÞÏÂá ÓÒÇÆÂ
?, A ?3,y
A ÛÇÍÐÙÏÂá ÓÒÇÆÂ
1.5.6. Реакции ионного обмена
Реакции ионного обмена z ÒÇÂÌØÊÊ ÎÇÈÆÕ ÊÐÏÂÎÊ Ä ÄÐÆÏÝ×
ÒÂÓÔÄÐÒÂ× ßÍÇÌÔÒÐÍÊÔÐÄ
µÓÍÐÄÊá
ÄÝÑÂÆÇÏÊÇ ÐÓÂÆÌÂ
ÄÝÆÇÍÇÏÊÇ ÅÂÉÂ
ÐÃÒÂÉÐÄÂÏÊÇ ÓÍÂÃÝ× ßÍÇÌÔÒÐÍÊÔÐÄ
¦ÊÓÓÐØÊÂØÊá ÂÎÖÐÔÇÒÏÝ× ßÍÇÌÔÒÐÍÊÔÐÄ
¦ÊÓÓÐØÊÂØÊá ÄÐÆÝ](https://image.slidesharecdn.com/37504-160518025243/85/37504-182-320.jpg)






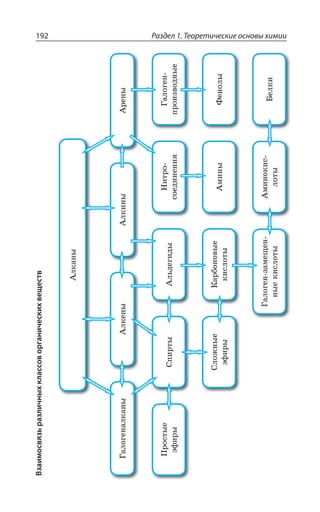


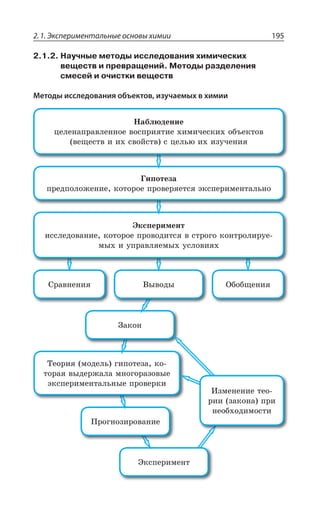

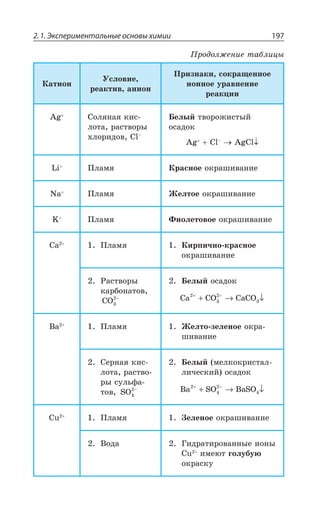
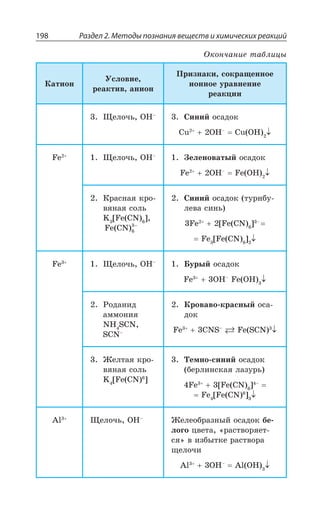





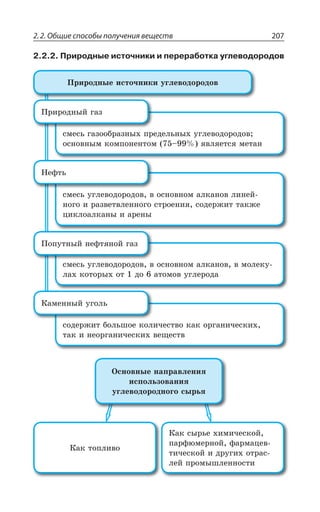

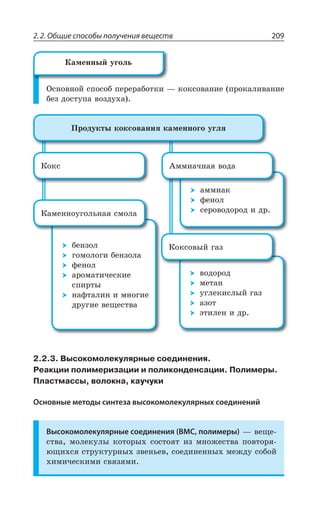




![2.2. Общие способы получения веществ 215
C H O C H OH CO
ãëþêîçà
äðîææè
ýòàíîë
6 12 6 2 5 22 2⎯ →⎯⎯⎯⎯⎯⎯ +
CH CH
àëêàí
O
3 3− →
[ ]
', y ', y 3,
CO H CH OH
êàò ìåòàíîë
+ →2 2 3
.
T
ÄÝÆÇÍÇÏÊÇ ÊÉ ÌÂÎÇÏÏÐÕÅÐÍÞÏÐË ÓÎÐÍÝ
C H C H Cl C H OH
Fe
Cl NaOH
6 6 6 5 6 5
2
−−→ −−−−→
+ +
ÐÌÊÓÍÇÏÊÇ ÑÇÒÄÊÙÏÝ× ÓÑÊÒÔÐÄ
', y ', y 3, 'Y3 →
t
', y'
3
3,
'Y , 3
ÆÇÅÊÆÒÊÒÐÄÂÏÊÏÇ ÑÇÒÄÊÙÏÝ× ÓÑÊÒÔÐÄ
', y ', y 3, ⎯ →⎯⎯
Cu, t
', y'
3
,
,
ÒÇÂÌØÊá ¬ÕÙÇÒÐÄÂ ÑÐÍÕÙÇÏÊÇ ßÔÂÏÂÍá
', ', , 3 →
+
t
Hg2
', y'
3
,
ÐÌÊÓÍÇÏÊÇ ÄÔÐÒÊÙÏÝ× ÓÑÊÒÔÐÄ
', y ', y ', −→
[ ]O
', y ' y ', , 3
33,
±ÐÍÕÙÇÏÊÇ ÖÇÏÐÍÂ
±ÐÍÕÙÇÏÊÇ ÂÍÞÆÇÅÊÆÐÄ
±ÐÍÕÙÇÏÊÇ ÌÇÔÐÏÐÄ](https://image.slidesharecdn.com/37504-160518025243/85/37504-215-320.jpg)
![Раздел 2. Методы познания веществ и химических реакций216
ÆÇÅÊÆÒÊÒÐÄÂÏÊÇ ÄÔÐÒÊÙÏÝ× ÓÑÊÒÔÐÄ
33,
', y ', y ', ⎯ →⎯⎯
Cu, t
', y ' y ', , 3
ÑÊÒÐÍÊÉ ÌÂÍÞØÊÇÄÝ× ÓÐÍÇË ÌÂÒÃÐÏÐÄÝ× ÌÊÓÍÐÔ
', y'
3
3
'E →
t
', y ' y ', 'E'3
', y'
3
3
3
ÅÊÆÒÂÔÂØÊá ÅÐÎÐÍÐÅÐÄ ÂØÇÔÊÍÇÏÂ ÂÍÌÊÏÐÄ
3
', y ' ', , 3 −⎯ →⎯⎯
+
Hg ,2
t
', y ' y ',
ÐÌÊÓÍÇÏÊÇ ÏÂÓÝÛÇÏÏÝ× ÕÅÍÇÄÐÆÐÒÐÆÐÄ ÄÐÉÆÕ×ÐÎ ÊÍÊ
ÌÊÓÍÐÒÐÆÐÎ Ä ÑÒÊÓÕÔÓÔÄÊÊ ÌÂÔÂÍÊÉÂÔÐÒÐÄ ÆÂÄÍÇÏÊá
Ê ÄÝÓÐÌÐË ÔÇÎÑÇÒÂÔÕÒÝ
', y ', y ', y ', −→
[ ]O
', '33, , 3
ÐÌÊÓÍÇÏÊÇ ÑÇÒÄÊÙÏÝ× ÓÑÊÒÔÐÄ Ê ÂÍÞÆÇÅÊÆÐÄ
6 y ', y 3, −−→
−H O
O
2
[ ]
6 y'
3
,
−→
[ ]O
6 y'
3
3,
ÅÊÆÒÐÍÊÉ ÑÒÐÊÉÄÐÆÏÝ× ÌÂÒÃÐÏÐÄÝ× ÌÊÓÍÐÔ ÏÂÑÒÊÎÇÒ
ÓÍÐÈÏÝ× ßÖÊÒÐÄ
6 y'
3
3 y 6
, 3
H SO конц.
⎯ →⎯⎯⎯⎯← ⎯⎯⎯⎯⎯
2 4( )
6 y'
3
3,
6 y 3,
ÓÑÇØÊÖÊÙÇÓÌÊË ÓÑÐÓÐÃ ÆÍá ÎÕÒÂÄÞÊÏÐË ÌÊÓÍÐÔÝ
'3 2E3, →
t p,
,'332E
,'332E ,'P ,'33, 2E'P
±ÐÍÕÙÇÏÊÇ ÌÂÒÃÐÏÐÄÝ× ÌÊÓÍÐÔ](https://image.slidesharecdn.com/37504-160518025243/85/37504-216-320.jpg)



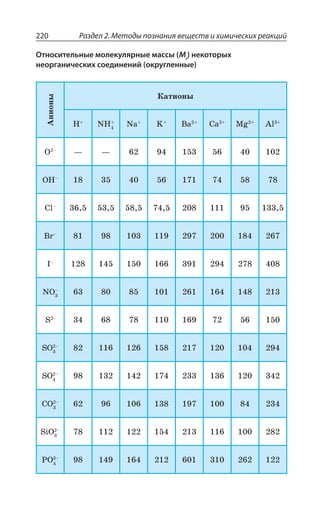
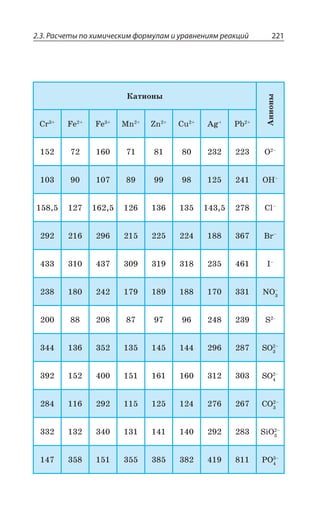











![Раздел 2. Методы познания веществ и химических реакций234
¦ÂÏÐ
Q Ò ÒÂ Å
: , 73
²ÇÚÇÏÊÇ
²ÇÚÂÔÞ ÂÏÂÍÐÅÊÙÏÐ ÉÂÆÂÙÇ
®ÂÓÓÕ ÃÇÉÄÐÆÏÐË ÙÊÓÔÐË ÌÊÓÍÐÔÝ
ÏÂËÔÊ ÑÐ ÖÐÒÎÕÍÇ
Q , 73 Q Ò ÒÂ ; , 73
Å Å
R '3 z #
Q '3 z #
: '3 z #
2.3.7. Нахождение молекулярной формулы вещества
Простейшая формула (эмпирическая) z ÐÔÐÃÒÂÈÂÇÔ ÓÐÐÔÏÐ
ÚÇÏÊÇ ÌÐÍÊÙÇÓÔÄÂ ÂÔÐÎÐÄ ÊÍÊ ÊÐÏÐÄ Ä ÓÐÇÆÊÏÇÏÊÊ
Истинная формула z ÑÐÌÂÉÝÄÂÇÔ ÆÇËÓÔÄÊÔÇÍÞÏÝË ÓÐÓÔÂÄ
ÎÐÍÇÌÕÍÝ
¤ÝÄÇÆÊÔÇ ÑÒÐÓÔÇËÚÕà ÖÐÒÎÕÍÕ ÓÐÇÆÊÏÇÏÊá Ä ÌÐÔÐÒÐÎ
ÎÂÓÓÐÄÝÇ ÆÐÍÊ ÕÅÍÇÒÐÆÂ ÄÐÆÐÒÐÆÂ Ê ÌÊÓÍÐÒÐÆÂ ÓÐÐÔÄÇÔ
ÓÔÄÇÏÏÐ ÒÂÄÏÝ Ê
¦ÂÏÐ
; '
; ,
; 3
²ÇÚÇÏÊÇ
¯ÂËÔÊ ÎÐÍáÒÏÐÇ ÓÐÐÔÏÐÚÇÏÊÇ
ÎÇÈÆÕ ÂÔÐÎÂÎÊ ÕÅÍÇÒÐÆÂ ÄÐÆÐÒÐ
ÆÂ Ê ÌÊÓÍÐÒÐÆÂ
±ÕÓÔÞ ÎÂÓÓÂ ÄÇÛÇÓÔÄÂ '
,]
3^
z
Å ÔÐÅÆÂ'
,]
3^
z #
Q ' Å Q , Å Q 3 Å
x y z n n n
m
M
m
M
m
M
: : ( ) : ( ) : ( )
( )
( )
:
( )
( )
:
( )
( )
= = =C H O
C
C
H
H
O
O
,
/
=
ã
ã
39 98
12 ììîëü
ã
ã ìîëü
ã
ã ìîëü
:
,
/
:
,
/
6 6
1
53 2
16
=
ìîëü ìîëü ìîëü, : , : ,3 3 6 6 3 3=
©ÂÆÂÙÂ](https://image.slidesharecdn.com/37504-160518025243/85/37504-234-320.jpg)
![2.3. Расчеты по химическим формулам и уравнениям реакций 235
±ÒÊÄÇÓÔÊ Ì ØÇÍÝÎ ÙÊÓÍÂÎ ÎÐÍáÒÏÐÇ ÓÐÐÔÏÐÚÇÏÊÇ ÂÔÐ
ÎÐÄ ÕÅÍÇÒÐÆÂ ÄÐÆÐÒÐÆÂ Ê ÌÊÓÍÐÒÐÆÂ
x y z: : , : , : ,
,
,
:
,
,
:
,
,
: := = = ⇒3 3 6 6 3 3
3 3
3 3
6 6
6 6
3 3
3 3
1 2 1 2CH O
°ÔÄÇÔ ', 3
°ÑÒÇÆÇÍÊÔÇ ÎÐÍÇÌÕÍáÒÏÕà ÖÐÒÎÕÍÕ ÄÇÛÇÓÔÄÂ Ä ÌÐÔÐÒÐÎ
ÎÂÓÓÐÄÂá ÆÐÍá ÕÅÍÇÒÐÆÂ ÎÂÓÓÐÄÂá ÆÐÍá ÄÐÆÐÒÐÆÂ
 ÎÐÍáÒÏÂá ÎÂÓÓ ÄÇÛÇÓÔÄ ÒÂÄÏ ŠÎÐÍÞ
¦ÂÏÐ
; '
; ,
1 '
,]
Å ÎÐÍÞ
²ÇÚÇÏÊÇ
·ÐÆ ÒÇÚÇÏÊá Ä ÑÕÏÌÔÂ× z ÓÐÐÔ
ÄÇÔÓÔÄÕÇÔ ÉÂÆÂÙÇ
¯ÂËÔÊ ÎÐÍáÒÏÐÇ ÓÐÐÔÏÐÚÇÏÊÇ
ÎÇÈÆÕ ÂÔÐÎÂÎÊ ÕÅÍÇÒÐÆÂ Ê ÄÐ
ÆÐÒÐÆÂ'
,]
z #
±ÕÓÔÞ ÎÂÓÓÂ ÄÇÛÇÓÔÄÂ '
,]
z Å ÔÐÅÆÂ
Q ' Å Q , Å
x y n n
m
M
m
M
: ( ) : ( )
( )
( )
( )
( )
,
/
:
,
/
= = = =C H
C
C
H
H
ã
ã ìîëü
ã
ã ìîëü
85 7
12
14 3
1
==
= 7 14 14 3, : ,ìîëü ìîëü
±ÒÊÄÇÓÔÊ Ì ØÇÍÝÎ ÙÊÓÍÂÎ ÎÐÍáÒÏÐÇ ÓÐÐÔÏÐÚÇÏÊÇ ÂÔÐ
ÎÐÄ ÕÅÍÇÒÐÆÂ Ê ÄÐÆÐÒÐÆÂ
x y z: : , : ,
,
,
:
,
,
:= = = ⇒7 14 14 3
7 14
7 14
14 3
7 14
1 2 2CH z
ÑÒÐÓÔÇËÚÂá ÖÐÒÎÕÍÂ
¯ÂËÔÊ ÎÐÍáÒÏÕà ÎÂÓÓÕ ÑÒÐÓÔÇËÚÇË ÖÐÒÎÕÍÝ
1 ', Å ÎÐÍÞ
¯ÂËÔÊ ÓÐÐÔÏÐÚÇÏÊÇ ÎÇÈÆÕ ÄÇÍÊÙÊÏÂÎÊ ÊÓÔÊÏÏÐË ÎÐ
ÍáÒÏÐË ÎÂÓÓÝ Ê ÎÐÍáÒÏÐË ÎÂÓÓÝ ÑÒÐÓÔÇËÚÇË ÖÐÒÎÕÍÝ
M
M
x y( )
( )
/
/
C H
CH
ã ìîëü
ã ìîëü2
84
14
6= =
©ÂÆÂÙÂ](https://image.slidesharecdn.com/37504-160518025243/85/37504-235-320.jpg)
![Раздел 2. Методы познания веществ и химических реакций236
µÓÔÂÏÐÄÊÔÞ ÊÓÔÊÏÏÕà ÖÐÒÎÕÍÕ ÓÐÇÆÊÏÇÏÊá
', ' ,
°ÔÄÇÔ ' ,
°ÑÒÇÆÇÍÊÔÇ ÎÐÍÇÌÕÍáÒÏÕà ÖÐÒÎÕÍÕ ÄÇÛÇÓÔÄÂ Ä ÌÐÔÐ
ÒÐÎ ÎÂÓÓÐÄÂá ÆÐÍá ÕÅÍÇÒÐÆÂ ÎÂÓÓÐÄÂá ÆÐÍá ÄÐÆÐÒÐ
ÆÂ ÇÓÍÊ ÐÔÏÐÓÊÔÇÍÞÏÂá ÑÍÐÔÏÐÓÔÞ ÓÐÇÆÊÏÇÏÊá ÑÐ ÄÐ
ÆÐÒÐÆÕ
¦ÂÏÐ
; '
; ,
D x yH C H2
15( ) =
²ÇÚÇÏÊÇ
¢ÍÅÐÒÊÔÎ ÒÇÚÇÏÊá ÉÂÆÂÙÊ ÂÏÂÍÐÅÊ
ÙÇÏ ÂÍÅÐÒÊÔÎÕ ÉÂÆÂÙÊ ÐÆÏÂÌÐ ÆÍá
ÏÂ×ÐÈÆÇÏÊá ÊÓÔÊÏÏÐË ÎÐÍáÒÏÐË ÎÂÓ
ÓÝ ÄÇÛÇÓÔÄ ÏÇÐÃ×ÐÆÊÎÐ ÄÐÓÑÐÍÞÉÐ
ÄÂÔÞÓá ÖÐÒÎÕÍÐË ÐÔÏÐÓÊÔÇÍÞÏÐË ÑÍÐÔ
ÏÐÓÔÊ
'
,]
z #
D
M
M
M D Mx y
x y
x y x yH HC H
C H
H
C H C H H
ã ìîëü
2 2
2
2
15 2
( )
( )
( )
( ) ( ) ( )
/
= ⇒ = ⋅ =
= ⋅ == 30 ã ìîëü/
2.3.8. Расчет массовой или объемной доли
выхода продукта реакции от теоретически
возможного
η = = =
m
m
V
V
n
n
ïðàêò.
òåîð
ïðàêò.
òåîð
ïðàêò.
òåîð. . .
¤Ý×ÐÆ ÄÇÛÇÓÔÄÂ
¤ÝÒÂÈÂÇÔÓá Ä ÊÍÊ ÆÐÍá× ÇÆÊÏÊØÝ
¤ ÒÇÉÕÍÞÔÂÔÇ ÑÒÐÑÕÓÌÂÏÊá ßÔÂÏÐÍÂ ÎÂÓÓÐË Å ÏÂÆ ÌÂ
ÔÂÍÊÉÂÔÐÒÐÎ ÑÐÍÕÙÊÍÊ ßÔÊÍÇÏ ÎÂÓÓÐË Å ²ÂÓÓÙÊÔÂËÔÇ
ÎÂÓÓÐÄÕà ÆÐÍà ÄÝ×ÐÆ ßÔÊÍÇÏÂ
©ÂÆÂÙÂ
©ÂÆÂÙÂ](https://image.slidesharecdn.com/37504-160518025243/85/37504-236-320.jpg)