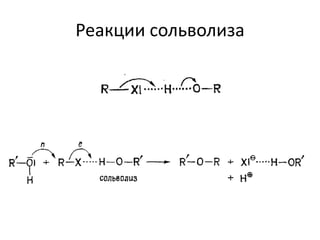
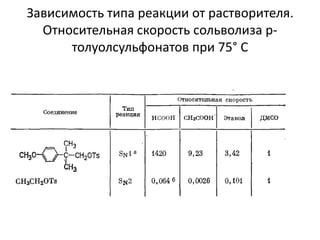
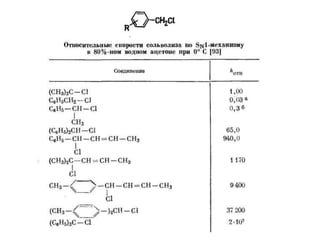
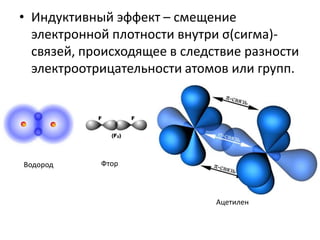
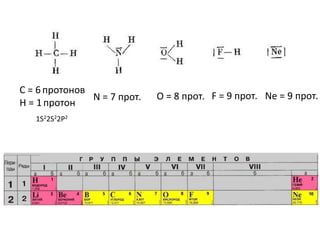
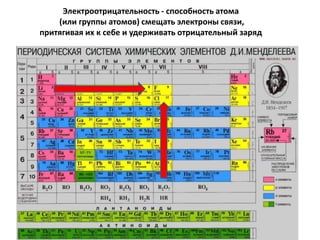
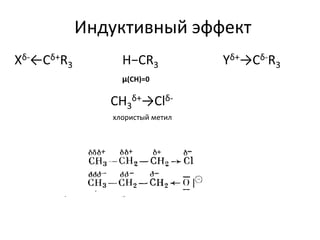
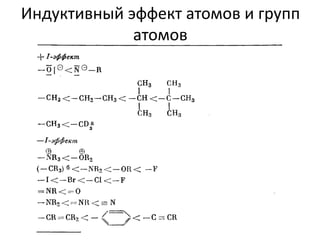
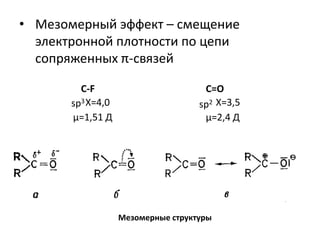
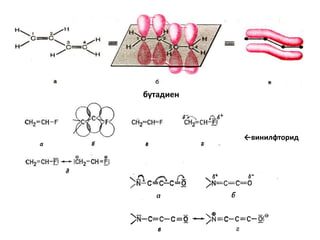
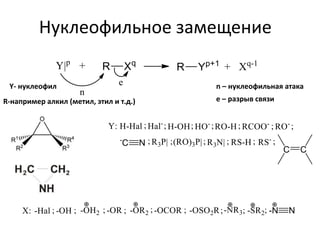
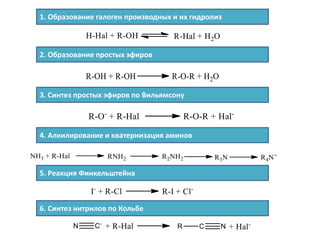
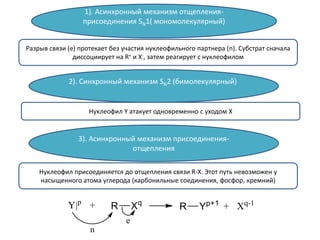
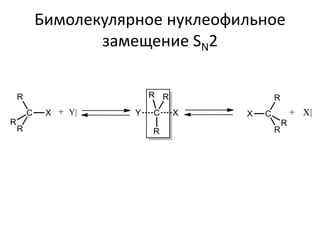
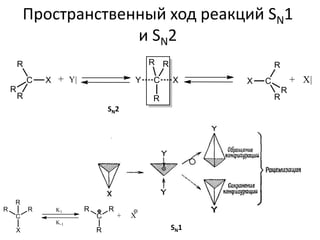
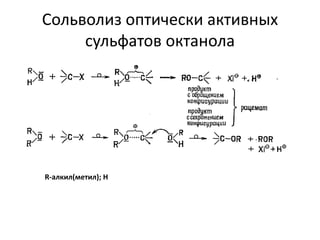
Документ рассматривает индуктивный и мезомерный эффекты в контексте реакций нуклеофильного замещения на насыщенных атомах углерода. Описываются основы индуктивного эффекта, его зависимость от свойств заместителей и влияние мезомерного эффекта. Также приводятся различные типы реакций нуклеофильного замещения, механизмы SN1 и SN2, и особенности взаимодействия нуклеофилов и электрофилов в зависимости от типов растворителей.







![Особенности SN1 реакций
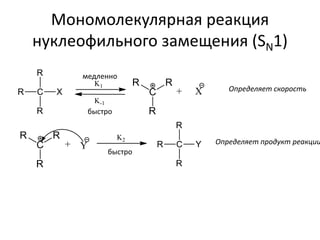
1. В переходном состоянии стадии, определяющей скорость (образование
карбкатиона), участвует только компонент R—X. Начальный период
реакции подчиняется кинетическому закону реакции первого порядка,
V= k*[RX] (V-скорость, [RX] – концентрация субстрата, k – константа)
2. Карбкатион — это реально существующее, богатое энергией
промежуточное соединение, которое можно распознать по типичным
продуктам его реакций — продуктам замещения, отщепления,
перегруппировок.
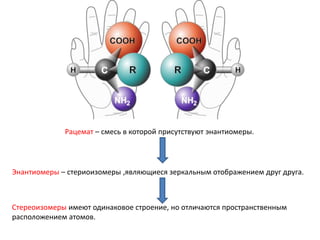
3. Соединения с оптической активностью у реакционного центра обычно в
большей или меньшей степени рацемизуются.
4. Скорость реакции возрастает по мере увеличения стабильности
образующегося карбкатиона, обусловленной внутренними влияниями
(полярными и пространственными эффектами заместителей) или
внешними воздействиями (сольватацией).](https://image.slidesharecdn.com/22-161111143206/85/slide-20-320.jpg)
![Критерии определения SN2-реакции
1. Нуклеофил участвует в стадии, определяющей скорость
реакции; эта же стадия определяет состав продуктов
превращения. В идеальном случае реакция идет по
кинетическому закону второго порядка V= k*[RX] *[Y]. Это
означает, что экспериментально наблюдаемая скорость
возрастает с повышением концентрации нуклеофила
2. У соединений с оптически активным реакционным
центром активность, как правило, сохраняется, но
происходит обращение конфигурации (инверсия,
вальденовское обращение).
3. Данные реакции менее эндотермичны, нежели SN1, но
более требовательны к пространственным ограничениям
4. Электроноакцепторные заместители в общем несколько
ускоряют SN2-реакции](https://image.slidesharecdn.com/22-161111143206/85/slide-23-320.jpg)
![Относительные скорости этанолиза
циклических соединений,
замещенных в голове мостика
Трет-бутил Адамантил Бицикло[2,2,1]гептанилБицикло[2,2,2]октанил](https://image.slidesharecdn.com/22-161111143206/85/slide-26-320.jpg)


![Классификация растворителей.
• Растворители, одновременно проявляющие
нуклеофильные и электрофильные свойства
(протонные растворители). [вода, спирты, кислоты]
• Растворители с нуклеофильными свойствами
(апротонные растворители). [ДМСО, ДМФА,
ацетон, ацетонитрил].
• Растворители с электрофильными свойствами.
[двуокись серы, тригалогениды бора и др].
• Растворители без заметной нуклеофильности или
электрофильных свойств.](https://image.slidesharecdn.com/22-161111143206/85/slide-29-320.jpg)