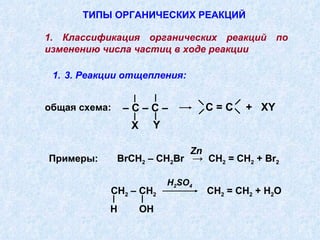
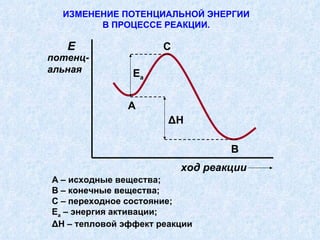
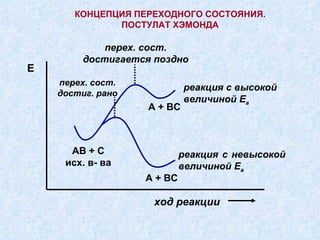
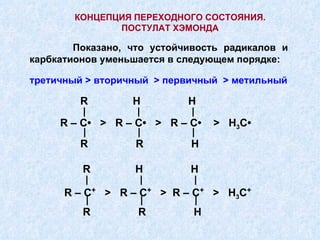
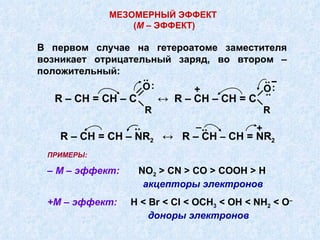
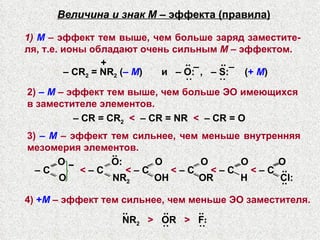
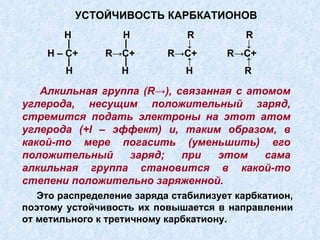
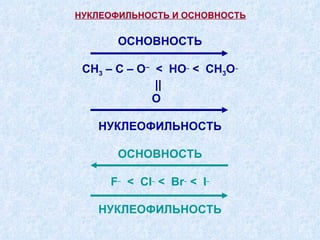
Документ представляет подробную классификацию органических реакций, включая деления по электронной природе реагентов, изменениям числа частиц, механизмам элементарных стадий и частным признакам. Описаны реакции замещения, присоединения и отщепления, а также роль радикалов и ионов в этих процессах. Документ также разбирает концепцию переходного состояния и факторы, влияющие на реакционную способность и ориентацию реакций.