More Related Content
DOC
PDF
เอกสารประกอบการเรียน เรื่อง อัตราการเกิดปฏิกิริยาเคมี PPS
DOC
อัตราการเกิดปฎิกิริยาเคมี PDF
ทฤษฎีและพลังงานกับการเกิดปฏิกิริยาเคมี PDF
จลนศาสตร์ของปฏิกิริยา และความคงตัวของเภสัชภัณฑ์ PDF
1 ความหมายอัตราการเกิดปฏิกิริยาเคมี PPT
อัตราการเกิดปฏิกิริยาเคมี (Rate of reaction What's hot
PPT
2 กฎอัตราและอันดับของปฏิกิริยา PDF
PDF
อัตราการเกิดปฏิกิริยาเคมี PDF
5 ปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยาเคมี DOC
PPT
PPT
ปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยา PDF
สื่อการสอน Chemical equilibrium PPT
PDF
PDF
การเปลี่ยนแปลงพลังงานและการเกิดปฏิกิริยาเคมี PPT
PDF
บทที่ 6 อัตราการเกิดปฏิกิริยา DOCX
อัตราการเกิดปฏิกิริยาเคมี PPT
อัตราการเกิดปฏิกิริยาเคมี DOC
Viewers also liked
DOC
PDF
Thesis. sustainability benchmarking DOC
PDF
Чисте місто: національний проект PDF
Thesis- Predictive Models PDF
DOC
Графік проведення зборів #chernivtsi PPT
PPT
PPT
PDF
"LtechIndia : Dare to Miss the Revolution NEXT? The MOBILE Revolution" DOC
DOC
Similar to อัตราการเกิดปฏิกริยาเคมี
DOC
DOC
PPT
DOC
DOC
DOC
DOC
DOC
DOC
DOC
PPT
PDF
PDF
PDF
PDF
PDF
PPT
PDF
แบบฝึกหัดอัตราการเกิดปฏิกิริยาเคมี DOC
DOC
อัตราการเกิดปฏิกริยาเคมี
- 1.
1
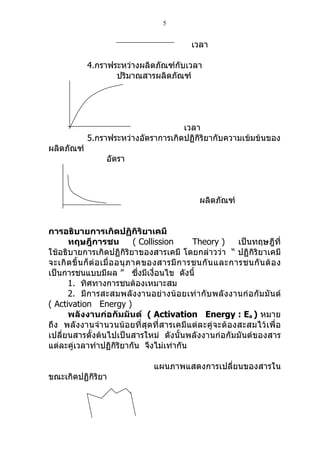
1. การเปลี่ยนแปลงของสารในขณะเกิดปฏิกิริยา
ในขณะที่เกิดปฏิกิริยา ส า ร ตั้ ง ต้ น
ผลิตภัณฑ์
สารตั้ ง ต้ น จะลดลงส่ ว นสารผลิ ตภั ณ ฑ์ จ ะเพิ่ ม ขึ้ น สมมติ
ปฏิกิริยา
٢A + B c + 2D ปริ ม าณสารมี ก าร
เปลียนแปลงดังกราฟ
่
ปริมาณสาร
สารผลิตภัณฑ์
สารตั้งต้น
เวลา
ข้ อ สั ง เกต การเปลี่ ย นแปลงของสารตั้ ง ต้ น และผลิ ต ภั ณ ฑ์ ต อน
แรกจะเปลี่ยนแปลงอย่างรวดเร็ว แล้วจะค่อยช้าลงเมื่อเวลาผ่านไป
นานขึ้น
การวัดอัตราการเกิดปฏิกิริยา
เนื่องจากในขณะเกิดปฏิกิริยาปริมาณสารตั้งต้นจะลดลง ส่วน
ปริ มาณของสารผลิตภั ณ ฑ์ จ ะเพิ่ ม ขึ้ น ดั ง นั้ น การวั ดอั ตราการเกิ ด
ปฏิกิริยาอาจทำาได้โดย
1. วัดจากอัตราการลดลงของสารตั้งต้น
ปริมาณสารต ังต้นท่ีล ดลง
้
R = เวลาท่ใช้ ในการเกิดป ฏิกิร ิยา
ี
2. วัดจากอัตราการเพิ่มขึ้นของสารผลิตภัณฑ์
ปริมาณสารผ ลิตภัณฑ์ที ่เพ่ิมขึน
้
R = เวลาท่ีใช้ ในการเกิดป ฏิกิร ิยา
โดยปริมาณสารที่เปลี่ยนไปอาจหมายถึง มวลสาร ปริมาณ
ของสาร ความเข้ ม ข้ น ของสาร นอกจากนี้ ส มบั ติ ที่ เ ปลี่ ย นไปบาง
ประการของสารก็สามารถนำามาใช้ในการวัดอัตราการเกิดปฏิกิริยาได้
เช่น ความเข้มของสี ค่า pH การนำาไฟฟ้าก็ได้
ถ้ า สมการทั่ ว ไปเป็ น ดั ง นี้ aA + bB
cC + dD
อัตราการเกิดปฏิกิริยามีค่าดังนี้
- 2.
2
1 ∆[ A ] 1 ∆[B ] 1 ∆[C ] 1 ∆[D ]
R= −
a ∆t
=−
b ∆t
=
c ∆t
=
d ∆t
1 d [ A] 1 d [B ] 1 d [C ] 1 d [D ]
หรือ R = −
a dt
=−
b dt
=
c dt
=
d dt
1 1 1 1
R= −
a
R A = − R B = RC = R D
b c d
อัตราการเกิดปฏิกิริยาเฉลี่ย
อัตราการเกิดปฏิกิริยาช่วงเวลาหนึ่งเราสามารถหาอัตราเร็ว
เฉลี่ยได้จากความสัมพันธ์ดังนี้
ปริมาณสารท ี่เปล่ียนแ ปลงทังหมด
้
อัตราเร็วเฉลีย =
่
เวลาท่ีใช้ ทังหมด
้
อัตราปฏิกิริยาเคมี ณ เวลาใดเวลาหนึ่ง
การหาอัตรา ณ เวลาหนึ่งๆ จะต้องคิดจากกราฟโดยสร้างกราฟ
ตามข้อมูลระหว่างปริมาณสารกับเวลา แล้วหาค่าความชัน ( slop )
ณ เวลาหนึ่งๆ ซึ่งค่าความชันนี้คือค่าของอัตรา ณ เวลานั้นๆ
จากการศึกษาของนักเคมีพบว่า อัตราการเกิดปฏิกิริยาเคมีจะ
ขึ้นอยู่กับความเข้มข้นของสารตั้งต้น ซึ่งแสดงได้ดังสมการต่อไปนี้
AA+bB cC+ dD
จะได้วา่ R α [A]m[B]n
R = K [A]m[B]n เรียกสมการนี้วา กฎอัตรา (Rate Law)
่
เมื่อ K คือ ค่าคงที่ของอัตรา
[] คือ ความเข้มข้นในหน่วย mol/dm3
m ,n เป็นตัวเลขใด ๆ ก็ได้ซึ่งหาได้จากผลการทดลองเท่านั้น
ซึ่งอาจเท่ากับ a ,b หรือไม่เท่าก็ได้
m +n เรียกว่า อันดับของปฏิกิริยา (Order of Reaction)
ถ้ า เลขยกกำา ลั ง ของสารใดเป็ น ٠ แสดงว่ า อั ต ราการเกิ ด
ปฏิกิริยาไม่ขึ้นกับความเข้มข้นของสารนั้น
ข้อสังเกตการนำากฎอัตราไปใช้
1. ต้องมีข้อมูลเป็นผลการทดลองมาให้โดยการกำา หนดความเข้ม
ข้ น / ปริ ม าณสารตั้ ง ต้ น มาให้ และกำา หนดอั ต ราการเกิ ด
ปฏิกิริยาจากการทดลองแต่ละครั้งมาให้ ( ถ้าไม่กำา หนดอัตรา
- 3.
3
มาให้อ าจต้ อ งคำา นวณหาเอง โดยคิ ด จากปริ ม าณสารที่
เปลียนแปลงในหนึ่งหน่วยเวลา )
่
2.เขียนสมการแสดงอัตราการเกิดปฏิกิริยาในรูปของกฎอัตราโดย
คิดค่าเลขยกกำาลังคือค่าของ m , n ไว้
3.หาค่า m , n โดยนำา ข้ อมูล แสดงการทดลองจากข้ อ 1 มา
คำานวณหา
4.ถ้าโจทย์ต้องการให้หาอัตราการเกิดปฏิกิริยาจากข้อมูลใหม่ที่
กำาหนดซึ่งไม่ใช่ผลการทดลองที่มีอยู่เดิม ให้หาค่า K แล้วนำา
ไปแทนค่ า ในสมการกฎอั ต ราในข้ อ 2 ( เพื่ อ หาอั ต ราตาม
เงื่อนไขใหม่ตามที่โจทย์กำาหนด
ตัวอย่าง ปฏิกิริยาระหว่างสารละลาย A กับสารละลาย B เป็น
ดังนี้ A + B C
ความเข้มข้นของสารละลาย อัตราการเกิด
การทดลอง
( mol/dm3 ) ปฏิกิริยา
ครั้งที่
สาร A สาร B mol/dm3.s
1 0.1 0.1 0.5
2 0.1 0.2 1.0
3 0.2 0.2 2.0
١. จงเขียนสมการแสดงอัตราการเกิดปฏิกิริยานี้
2.ถ้าสาร A และสาร B เข้ม ข้ น 0.3 และ 0.4 mol/dm3 ตาม
ลำาดับอัตราการเกิดปฏิกิริยานี้จะเป็นเท่าไร
วิธีคิด
จากการทดลองที่ 1 และ 2 ความเข้มข้นของสาร A คงที่ แต่
ความเข้ ม ข้ น ของสาร B เพิ่ ม ขึ้ น เป็ น 2 เท่ า อั ต ราก็ เ พิ่ ม ขึ้ น จาก
เดิ ม 2 เท่ า แสดงว่ า อั ต ราขึ้ น กั บ ความเข้ ม ข้ น ของสาร B ยก
กำาลัง 1
จากการทดลองที่ 2 และ 3 ความเข้มข้นของสาร B คงที่ แต่
ความเข้ ม ข้ น ของสาร A เพิ่ ม ขึ้ น เป็ น 2 เท่ า อั ตราก็ เ พิ่ ม ขึ้ น จาก
เดิ ม 4 เท่ า แสดงว่ า อั ต ราขึ้ น กั บ ความเข้ ม ข้ น ของสาร A ยก
กำาลัง 2
ดังนั้นจะได้วา R = K[A]2 [B]
่
- 4.
4
จากการทดลองที่ 1 เมื่ อ นำา ความเข้ ม ข้ น ของสาร A สาร B
และอัตราการเกิดปฏิกิริยามาแทนในสมการที่
ดังนั้น K = 500
เมื่อนำา ความเข้ มข้ นของสาร A และสาร B แทนลงในสมการ
แสดงอัตราการเกิดปฏิกิริยาจะได้อัตราการเกิดปฏิกิริยาใหม่ดังนี้ R
= 500[0.3]2 [0.4]
= 18.0 mol/dm3.s
รูปกราฟที่น่าสนใจ
1.กราฟแสดงอัตราการเกิดปฏิกิริยาคงที่
อัตรา
เวลา
2.กราฟแสดงอัตราการเกิดปฏิกิริยาไม่ขึ้นกับความเข้มข้น
ของสารตั้งตั้น
ความเข้มข้นของสารตั้งต้น
เวลา
3.กราฟแสดงอั ตราการเกิ ดปฏิ กิ ริ ย าขึ้ น กั บ ความเข้ ม ข้ น
ของสารตั้ ง ต้ น (มี ก ารเปลี่ ย นแปลงเมื่ อ ความเข้ ม ข้ น ของสารตั้ ง ต้ น
เปลียนไป)
่
ปริมาณสารตั้งต้น
- 5.
5
เวลา
4.กราฟระหว่างผลิตภัณฑ์กับเวลา
ปริมาณสารผลิตภัณฑ์
เวลา
5.กราฟระหว่างอัตราการเกิดปฏิกิริยากับความเข้มข้นของ
ผลิตภัณฑ์
อัตรา
ผลิตภัณฑ์
การอธิบายการเกิดปฏิกิริยาเคมี
ทฤษฎีการชน ( Collission Theory ) เป็นทฤษฎีที่
ใช้อธิบายการเกิดปฏิกิริยาของสารเคมี โดยกล่าวว่า “ ปฏิกิริยาเคมี
จะเกิ ด ขึ้ น ก็ ต่ อ เมื่ อ อนุ ภ าคของสารมี ก ารชนกั น และการชนกั น ต้ อ ง
เป็นการชนแบบมีผล ” ซึ่งมีเงื่อนไข ดังนี้
1. ทิศทางการชนต้องเหมาะสม
2. มีการสะสมพลังงานอย่ างน้ อ ยเท่ า กั บ พลัง งานก่ อ กั ม มั น ต์
( Activation Energy )
พลังงานก่อกัมมันต์ ( Activation Energy : Ea ) หมาย
ถึง พลังงานจำา นวนน้อยที่สุดที่สารเคมีแต่ละคู่จะต้องสะสมไว้เพื่อ
เปลี่ยนสารตั้งต้นไปเป็นสารใหม่ ดังนั้นพลังงานก่อกัมมันต์ของสาร
แต่ละคู่เวลาทำาปฏิกิริยากัน จึงไม่เท่ากัน
แผนภาพแสดงการเปลี่ยนของสารใน
ขณะเกิดปฏิกิริยา
- 6.
6
A B A A
2 A B
A + B
พลังงานตำ่ากว่า Ea B B
พลังงานสูงกว่า Ea
สารเชิงซ้อนถูกกระตุ้น
[ Activated complex ]
การเปลี่ยนแปลงพลังงานของสารในระหว่ างการดำา เนิน
ไปของปฏิกิริยา
ในขณะที่สารเกิดปฏิกิริยาจะมีการเปลี่ยนแปลงพลังงานเกิดขึ้น
เสมอ ซึ่ ง ลั ก ษณะการเปลี่ ย นแปลงพลั ง งานแบ่ ง เป็ น 2 แบบ คื อ
ปฏิกิริยาดูดความร้อน และปฏิกิริยาคายความร้อน
1.ปฏิกิริยาดูดความร้อน มีลักษณะการเปลี่ยนแปลงพลังงาน
ดังนี้
พลังงาน E2
Ea
E3
E1
ก า ร ดำา เ นิ น ไ ป ข อ ง
ปฏิกิริยา
2.ปฏิกิริยาคายความร้อน มีลักษณะการเปลี่ยนแปลงพลังงาน
ดังนี้
พลังงาน E2
Ea
E3
- 7.
7
E1
ก า ร ดำา เ นิ น ไ ป ข อ ง
ปฏิกิริยา
ข้อสังเกต ปฏิกิริยาที่มีค่า Ea ตำ่า เกิดง่ายเร็ วขึ้ น : ถ้าค่า Ea สูง
เกิดยาก เกิดช้า
ในบางปฏิกิริยามีกลไกในการเกิดปฏิกิริยาหลายขั้น เช่น A2 +3B2
2AB3 เกิดปฏิกิริยา 3 ขั้น คือ
(1) B2 2B …. เร็ว
(2) A2 2A …. ช้า (อัตราขึ้นกับ
ขั้นนี)
้
(3) A + 3B AB3 …. เร็ว
อัตราการเกิดปฏิกิริยาของปฏิกิริยาที่มีหลายขั้นจะขึ้นกับขั้นที่
ช้าที่สุดเสมอ เนื่องจากขั้นที่มี Ea สูงที่สุด
ถ้านำามาเขียนกราฟจะได้ดังนี้ ( สมมติว่าปฏิกิริยานี้คาย
ความพลังงาน )
พลังงาน ขั้นที่ ٢
ขั้นที่ ١ ขั้นที่ ٣
เวลา
ปัจจัยที่มีอิทธิพลต่ออัตราการเกิดปฏิกิริยา
1. ความเข้ ม ข้ น ของสารตั้ ง ต้ น ในกรณี ที่ ส ารตั้ ง ต้ น เป็ น
สารละลาย ยิ่งสารละลายนั้น มีความเข้ มข้ นมากขึ้ นอั ตราการ
เกิ ด ปฏิ กิ ริ ย าจะเร็ ว ขึ้ น เนื่ อ งจากมี จำา นวนอนุ ภ าคของตั ว ถู ก
ละลายมากขึ้นจะชนกันบ่อยมากขึ้น
แต่การเพิ่มปริมาตรของสารละลายโดยความเข้มข้นเท่าเดิมอัตรา
การเกิดปฏิกิริยาจะเท่าเดิม
٢. อุณหภูมิ การที่อุณหภูมิของสารตั้งต้นเพิ่มขึ้น อัตราการ
เกิดปฏิกิริยาจะเพิ่มขึ้น เนื่องจากเมื่ออุณหภูมิ สูงขึ้น โมเลกุลของ
สารจะมี พ ลั ง งานจลน์ สู ง ขึ้ น เคลื่ อ นที่ เ ร็ ว ขึ้ น จึ ง ชนกั น บ่ อ ยมากขึ้ น
สุ ด ท้ า ยก็ จ ะมี จำา นวนโมเลกุ ล ที่ มี พ ลั ง งานอย่ า งน้ อ ยเท่ า กั บ หรื อ
- 8.
8
มากกว่ า Eaมากขึ้ น เมื่ อ อุ ณหภู มิ เ พิ่ ม ขึ้ น จึ ง ทำา ให้ อัต ราการเกิ ด
ปฏิกิริยาเร็วขึ้นนั้นเอง
٣. พื้ น ที่ ผิ ว สั ม ผั ส สารที่ มี พื้ น ที่ ผิ ว สั ม ผั ส มากกว่ า จะทำา
ปฏิกิริยาได้เร็วขึ้น เนื่องจากสัมผัสกัน (ชนกัน) มากขึ้น ใช้ในการ
พิจารณาสารตั้งต้นที่เป็นของแข็ง ดังนั้นสารที่เป็นของแข็งจึงต้อง
บดให้ละเอียดก่อนทำาปฏิกิริยา
٤. ตัวเร่งปฏิกิริยา ( Catalyst) ตัวเร่งปฏิกิริยาเป็นสาร
เคมีที่ช่วยทำาให้อัตราการเกิดปฏิกิริยาได้เร็วขึ้น เนื่องจากตัวเร่งจะ
ช่ ว ยในการลดพลั ง งานกระตุ้ น ในการเกิ ด ปฏิ กิ ริ ย า โดยช่ ว ยปรั บ
กลไกในการเกิ ดปฏิ กิ ริ ย าให้ เ หมาะสมกว่ า เดิ ม โดยจะเข้ า ไปช่ ว ย
ตั้งแต่เริ่มปฏิกิริยาแต่เมื่อปฏิกิริยาสิ้นสุดมันจะกลับมาเป็นสารเดิม
٥. ตัวหน่วงปฏิ กิริ ยา (Inhibitor) หมายถึง สารที่ทำา ให้
อั ตราการเกิ ดปฏิ กิ ริ ย าช้ าลงโดยขั ด ขวางกลไกในการเกิ ดปฏิ กิ ริ ย า
ทำาให้ค่าพลังงานก่อกัมมันต์สูงขึ้น
٦. ธรรมชาติของสารตั้งต้น เนื่องจากสารเคมีจะมีการยึด
เหนี่ยวด้วยพันธะที่ต่างกัน โดยปกติสารละลาย ของสารประกอบอิ
ออนิกเวลาเข้าทำาปฏิกิริยาจะแตกตัวเป็นอิออนบวกและอิออนลบก่อน
และเคลื่อนที่ได้เร็วกว่าโมเลกุลของสารประกอบโควาเลนต์ ดังนั้น
สารอิออนิกจึงทำาปฏิกิริยาได้เร็วกว่าสารโควาเลนต์ แม้กระทังสารโค ่
วาเลนต์ด้วยกันก็ยังแตกต่างกัน เนื่องจากอาจยึดด้วยพันธะเดี่ยว
พันธะคู่ หรือพันธะสามก็ได้

![2
1 ∆[ A ] 1 ∆[B ] 1 ∆[C ] 1 ∆[D ]
R= −
a ∆t
=−
b ∆t
=
c ∆t
=
d ∆t
1 d [ A] 1 d [B ] 1 d [C ] 1 d [D ]
หรือ R = −
a dt
=−
b dt
=
c dt
=
d dt
1 1 1 1
R= −
a
R A = − R B = RC = R D
b c d
อัตราการเกิดปฏิกิริยาเฉลี่ย
อัตราการเกิดปฏิกิริยาช่วงเวลาหนึ่งเราสามารถหาอัตราเร็ว
เฉลี่ยได้จากความสัมพันธ์ดังนี้
ปริมาณสารท ี่เปล่ียนแ ปลงทังหมด
้
อัตราเร็วเฉลีย =
่
เวลาท่ีใช้ ทังหมด
้
อัตราปฏิกิริยาเคมี ณ เวลาใดเวลาหนึ่ง
การหาอัตรา ณ เวลาหนึ่งๆ จะต้องคิดจากกราฟโดยสร้างกราฟ
ตามข้อมูลระหว่างปริมาณสารกับเวลา แล้วหาค่าความชัน ( slop )
ณ เวลาหนึ่งๆ ซึ่งค่าความชันนี้คือค่าของอัตรา ณ เวลานั้นๆ
จากการศึกษาของนักเคมีพบว่า อัตราการเกิดปฏิกิริยาเคมีจะ
ขึ้นอยู่กับความเข้มข้นของสารตั้งต้น ซึ่งแสดงได้ดังสมการต่อไปนี้
AA+bB cC+ dD
จะได้วา่ R α [A]m[B]n
R = K [A]m[B]n เรียกสมการนี้วา กฎอัตรา (Rate Law)
่
เมื่อ K คือ ค่าคงที่ของอัตรา
[] คือ ความเข้มข้นในหน่วย mol/dm3
m ,n เป็นตัวเลขใด ๆ ก็ได้ซึ่งหาได้จากผลการทดลองเท่านั้น
ซึ่งอาจเท่ากับ a ,b หรือไม่เท่าก็ได้
m +n เรียกว่า อันดับของปฏิกิริยา (Order of Reaction)
ถ้ า เลขยกกำา ลั ง ของสารใดเป็ น ٠ แสดงว่ า อั ต ราการเกิ ด
ปฏิกิริยาไม่ขึ้นกับความเข้มข้นของสารนั้น
ข้อสังเกตการนำากฎอัตราไปใช้
1. ต้องมีข้อมูลเป็นผลการทดลองมาให้โดยการกำา หนดความเข้ม
ข้ น / ปริ ม าณสารตั้ ง ต้ น มาให้ และกำา หนดอั ต ราการเกิ ด
ปฏิกิริยาจากการทดลองแต่ละครั้งมาให้ ( ถ้าไม่กำา หนดอัตรา](https://image.slidesharecdn.com/random-100610130641-phpapp02/85/slide-2-320.jpg)
![3
มาให้ อ าจต้ อ งคำา นวณหาเอง โดยคิ ด จากปริ ม าณสารที่
เปลียนแปลงในหนึ่งหน่วยเวลา )
่
2.เขียนสมการแสดงอัตราการเกิดปฏิกิริยาในรูปของกฎอัตราโดย
คิดค่าเลขยกกำาลังคือค่าของ m , n ไว้
3.หาค่า m , n โดยนำา ข้ อมูล แสดงการทดลองจากข้ อ 1 มา
คำานวณหา
4.ถ้าโจทย์ต้องการให้หาอัตราการเกิดปฏิกิริยาจากข้อมูลใหม่ที่
กำาหนดซึ่งไม่ใช่ผลการทดลองที่มีอยู่เดิม ให้หาค่า K แล้วนำา
ไปแทนค่ า ในสมการกฎอั ต ราในข้ อ 2 ( เพื่ อ หาอั ต ราตาม
เงื่อนไขใหม่ตามที่โจทย์กำาหนด
ตัวอย่าง ปฏิกิริยาระหว่างสารละลาย A กับสารละลาย B เป็น
ดังนี้ A + B C
ความเข้มข้นของสารละลาย อัตราการเกิด
การทดลอง
( mol/dm3 ) ปฏิกิริยา
ครั้งที่
สาร A สาร B mol/dm3.s
1 0.1 0.1 0.5
2 0.1 0.2 1.0
3 0.2 0.2 2.0
١. จงเขียนสมการแสดงอัตราการเกิดปฏิกิริยานี้
2.ถ้าสาร A และสาร B เข้ม ข้ น 0.3 และ 0.4 mol/dm3 ตาม
ลำาดับอัตราการเกิดปฏิกิริยานี้จะเป็นเท่าไร
วิธีคิด
จากการทดลองที่ 1 และ 2 ความเข้มข้นของสาร A คงที่ แต่
ความเข้ ม ข้ น ของสาร B เพิ่ ม ขึ้ น เป็ น 2 เท่ า อั ต ราก็ เ พิ่ ม ขึ้ น จาก
เดิ ม 2 เท่ า แสดงว่ า อั ต ราขึ้ น กั บ ความเข้ ม ข้ น ของสาร B ยก
กำาลัง 1
จากการทดลองที่ 2 และ 3 ความเข้มข้นของสาร B คงที่ แต่
ความเข้ ม ข้ น ของสาร A เพิ่ ม ขึ้ น เป็ น 2 เท่ า อั ตราก็ เ พิ่ ม ขึ้ น จาก
เดิ ม 4 เท่ า แสดงว่ า อั ต ราขึ้ น กั บ ความเข้ ม ข้ น ของสาร A ยก
กำาลัง 2
ดังนั้นจะได้วา R = K[A]2 [B]
่](https://image.slidesharecdn.com/random-100610130641-phpapp02/85/slide-3-320.jpg)
![4
จากการทดลองที่ 1 เมื่ อ นำา ความเข้ ม ข้ น ของสาร A สาร B
และอัตราการเกิดปฏิกิริยามาแทนในสมการที่
ดังนั้น K = 500
เมื่อนำา ความเข้ มข้ นของสาร A และสาร B แทนลงในสมการ
แสดงอัตราการเกิดปฏิกิริยาจะได้อัตราการเกิดปฏิกิริยาใหม่ดังนี้ R
= 500[0.3]2 [0.4]
= 18.0 mol/dm3.s
รูปกราฟที่น่าสนใจ
1.กราฟแสดงอัตราการเกิดปฏิกิริยาคงที่
อัตรา
เวลา
2.กราฟแสดงอัตราการเกิดปฏิกิริยาไม่ขึ้นกับความเข้มข้น
ของสารตั้งตั้น
ความเข้มข้นของสารตั้งต้น
เวลา
3.กราฟแสดงอั ตราการเกิ ดปฏิ กิ ริ ย าขึ้ น กั บ ความเข้ ม ข้ น
ของสารตั้ ง ต้ น (มี ก ารเปลี่ ย นแปลงเมื่ อ ความเข้ ม ข้ น ของสารตั้ ง ต้ น
เปลียนไป)
่
ปริมาณสารตั้งต้น](https://image.slidesharecdn.com/random-100610130641-phpapp02/85/slide-4-320.jpg)
![6
A B A A
2 A B
A + B
พลังงานตำ่ากว่า Ea B B
พลังงานสูงกว่า Ea
สารเชิงซ้อนถูกกระตุ้น
[ Activated complex ]
การเปลี่ยนแปลงพลังงานของสารในระหว่ างการดำา เนิน
ไปของปฏิกิริยา
ในขณะที่สารเกิดปฏิกิริยาจะมีการเปลี่ยนแปลงพลังงานเกิดขึ้น
เสมอ ซึ่ ง ลั ก ษณะการเปลี่ ย นแปลงพลั ง งานแบ่ ง เป็ น 2 แบบ คื อ
ปฏิกิริยาดูดความร้อน และปฏิกิริยาคายความร้อน
1.ปฏิกิริยาดูดความร้อน มีลักษณะการเปลี่ยนแปลงพลังงาน
ดังนี้
พลังงาน E2
Ea
E3
E1
ก า ร ดำา เ นิ น ไ ป ข อ ง
ปฏิกิริยา
2.ปฏิกิริยาคายความร้อน มีลักษณะการเปลี่ยนแปลงพลังงาน
ดังนี้
พลังงาน E2
Ea
E3](https://image.slidesharecdn.com/random-100610130641-phpapp02/85/slide-6-320.jpg)

