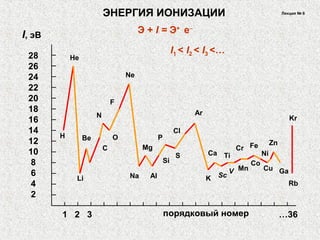
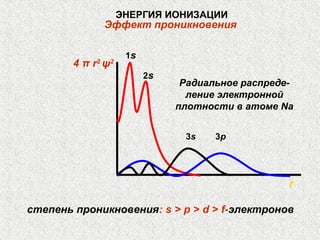
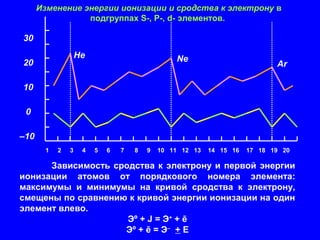
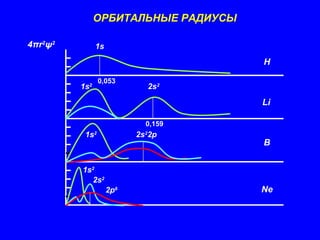
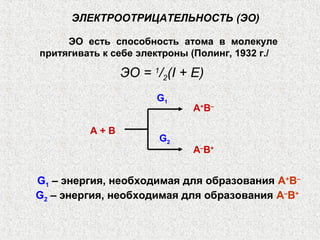
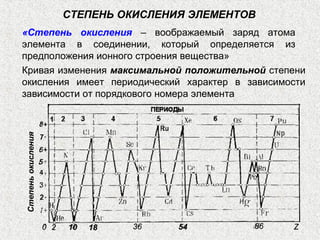
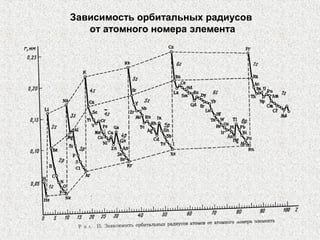
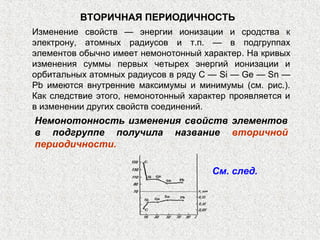
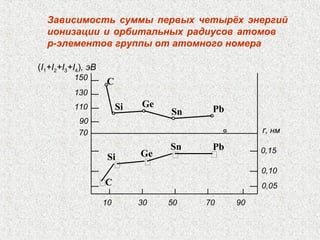
Документ обсуждает периодичность химических свойств элементов, основанных на электронной структуре атомов, и как они зависят от порядкового номера элемента. Основное внимание уделяется энергиям ионизации, сродству к электрону и атомным радиусам, подчеркивая физические принципы, такие как экранирование и проникновение. Также рассматривается немонотонный характер изменения свойств элементов в подгруппах, что ведет к понятию вторичной периодичности.