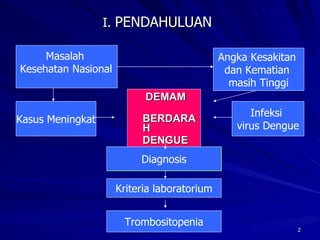
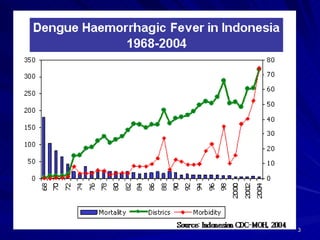
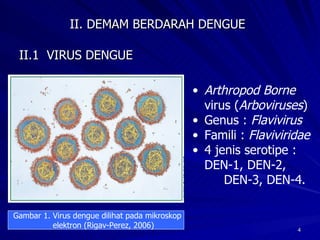
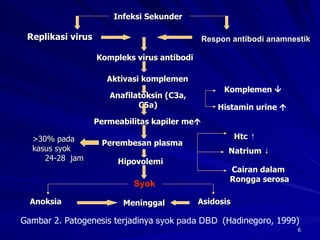
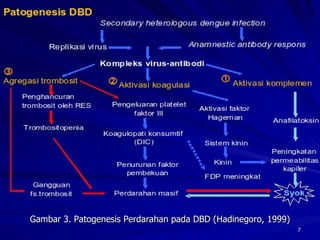
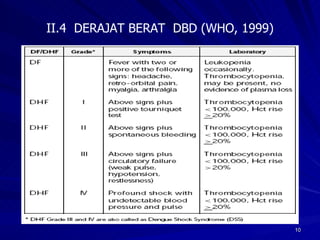
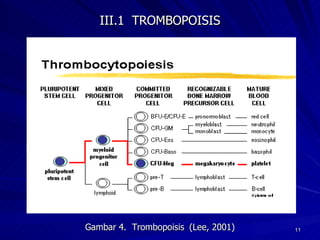
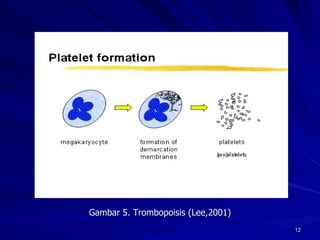
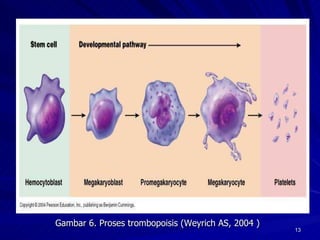
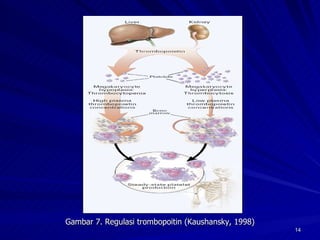
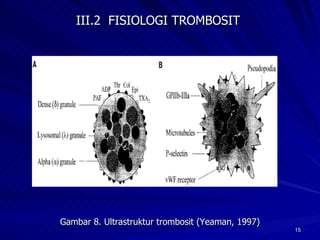
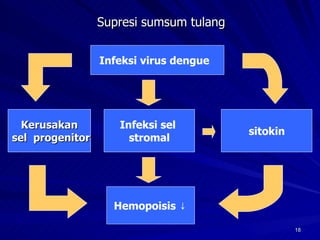
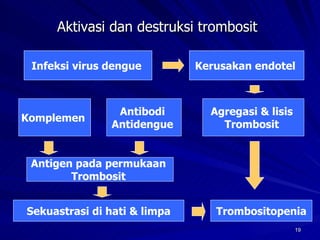
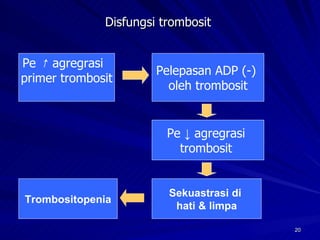
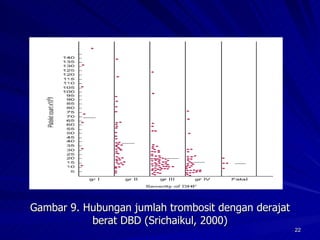
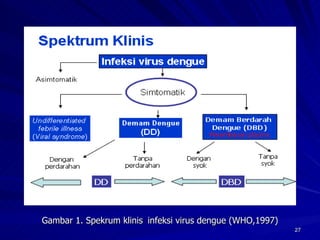
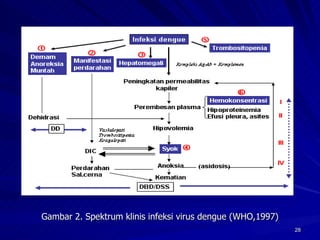
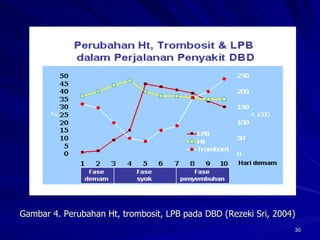
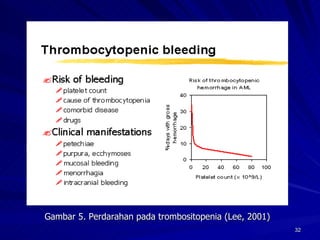
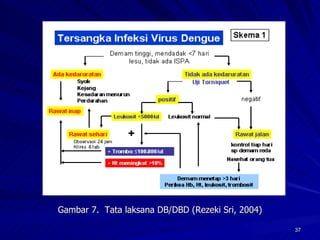
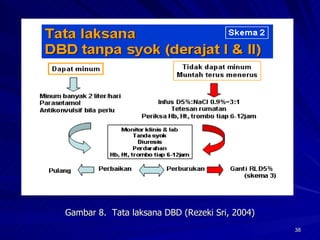
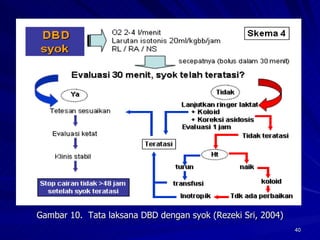
Tinjauan pustaka mengenai trombositopenia pada demam berdarah dengue membahas mekanisme penyebabnya yaitu supresi sumsum tulang, aktivasi dan destruksi trombosit oleh virus, serta disfungsi trombosit. Pemeriksaan jumlah trombosit penting untuk diagnosis dan pemantauan, dapat dilakukan secara manual maupun otomatis. Terapi trombositopenia meliputi transfusi trombosit dalam kondisi tertentu.