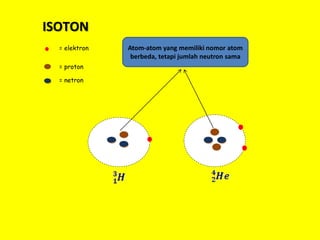
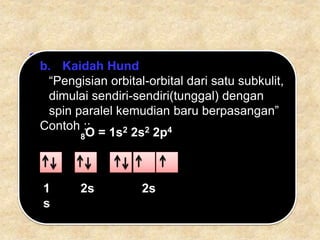
Dokumen ini menjelaskan sejarah dan perkembangan teori atom, mulai dari gagasan Democritus hingga konsep bilangan kuantum yang menjelaskan posisi dan sifat elektron dalam atom. Terdapat juga penjelasan mengenai konfigurasi elektron, isotop, isobar, isoton, dan jenis-jenis molekul serta ion. Informasi tersebut mencakup aturan-aturan pengisian orbital dan contoh senyawa ionik yang terbentuk dari kombinasi ion positif dan negatif.







![Menyingkat
penulisan
konfigurasi
menggunakan
konfigurasi
elektron Gas
Mulia
Penulisan Konfigurasi
Elektron
Uns
ur
Gol.
VIII A
Nom
or
Atom
Konfiguras
i
He 2 1s2
Ne 10 1s2 2p6
Ar 18 [Ne] 3s2 3p6
Kr 36 [Ar] 4s2 4p6
Xe 54 [Kr] 5s2 5p6
Rn 86 [Xe] 6s2 6p6
Contoh :
Na (Z=11)→ [Ne]
3s1
Ar (Z=18)→ 1s2 2s2
2p6 3s2 3p6
Sc (Z=22)→ [Ar]
3d2 4s2](https://image.slidesharecdn.com/pptkimiadasarstrukturatommolekulda-240618080841-a7ea212d/85/PPT_Kimia_Dasar_Struktur_Atom_Molekul_da-pptx-9-320.jpg)
![Tentukan konfigurasi, bilangan
kuantum, periode dan golongan
unsur Fe (Z=26)
Konfigurasi : [Ar] 3d6 4s2
Periode :
Golongan :
4
S+d=8
VIII B
Bilangan kuantum:
n = 4
l = 2
m = -2
s = -½](https://image.slidesharecdn.com/pptkimiadasarstrukturatommolekulda-240618080841-a7ea212d/85/PPT_Kimia_Dasar_Struktur_Atom_Molekul_da-pptx-10-320.jpg)