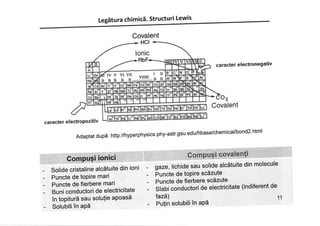
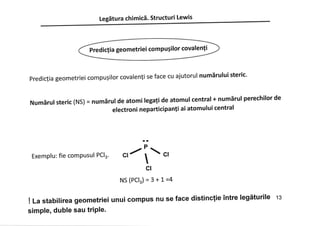
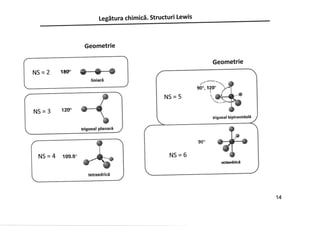
Documentul discută despre legăturile chimice, inclusiv legăturile ionice și covalente, și explică formarea acestora prin transferul sau împărtășirea electronilor. Se subliniază importanța regulii octetului în stabilizarea configurației electronice a atomilor. De asemenea, în document sunt prezentate structurile Lewis care ilustrează modul în care atomii interacționează și formează molecule.





![Legätura chimicä. Structuri Lewis
Structuri Lewis
a
'Al "
a B a
n*np1
3A(13)
a
.Si"
a
a
a
G
a
t
n&nf
4A(14)
at
rP"
¡l
a
ta
N
a
t
5A(15)
t
o
a.
s
Ç
t
]
a
.a
o
a
a
n&n/
6A(16)
a
a
aa
cl
a
a
a
*
ö
ta
F
a
I
a
n*nf
TAFn
¡l
a
aa
Ar
at
a
I
lc
!Ne!
aa
n&nÊ
8A(18)
o
o
a
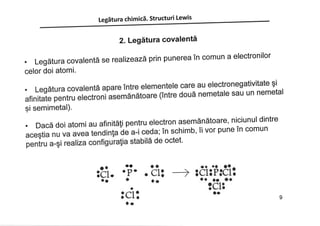
Electronii de valentä ai atomilor sunt reprezentafi sub formä de puncte.
2
t
http://www.chem.latech.edu/-upali/chem481/slides/Chemical%20Bonding. htm
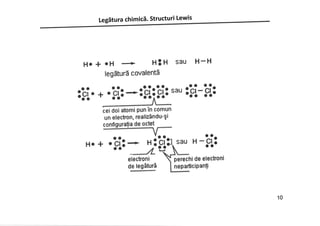
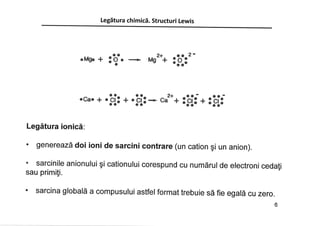
Structurile Lewis sunt diagrame care prezantä legäturile dintre atomii care
alcätuiesc o moleculä, precum ç¡ perechile de electroni neparticipanli ai
fiecärui atom din acea moleculä.
7
.Na
a
Li
ns1
1A(1)
'Mg"
. Be.
n&
2A(21](https://image.slidesharecdn.com/curschimie8structurilewis-230907102032-4a6422db/85/Curs-chimie-8-Structuri-Lewis-pdf-7-320.jpg)